bromodomain结构域对溴区包含蛋白7亚细胞定位的影响*
徐晓杰,周 鸣,李桂源#
1)南阳医学高等专科学校病理学教研室南阳 473000 2)中南大学湘雅医学院肿瘤研究所分子遗传室长沙 410078 #通讯作者,男,1951年11月生,博士,教授,研究方向:鼻咽癌的分子遗传学,E-mail:ligy@xysm.net
bromodomain结构域对溴区包含蛋白7亚细胞定位的影响*
徐晓杰1),周 鸣2),李桂源2)#
1)南阳医学高等专科学校病理学教研室南阳 473000 2)中南大学湘雅医学院肿瘤研究所分子遗传室长沙 410078 #通讯作者,男,1951年11月生,博士,教授,研究方向:鼻咽癌的分子遗传学,E-mail:ligy@xysm.net
鼻咽癌;缺失突变;亚细胞定位;bromodomain;溴区包含蛋白7
目的:探讨溴区包含蛋白7(BRD7)的亚细胞定位以及bromodomain结构域对BRD7亚细胞定位的影响。方法:首先采用GFP介导的亚细胞定位方法,在非洲绿猴肾COS7细胞中考察BRD7的亚细胞定位;然后分别构建bromodomain缺失型的BRD7重组体pCMV-Myc/BRD7△brd和pEGFP-C2/BRD7△brd,并通过GFP介导的亚细胞定位方法和间接免疫荧光方法,分别在COS7中考察bromodomain缺失型BRD7的亚细胞定位,从而探讨BRD7的bromodomain结构域对其亚细胞定位的影响。结果:成功构建了pCMV-Myc/BRD7△brd和pEGFP-C2/BRD7△brd。BRD7及bromodomain缺失型BRD7在COS7中均主要定位在细胞核,与染色质的分布存在一定程度的相似性。结论:bromodomain结构域的缺失并不影响BRD7的细胞核分布,但是在核内的分布模式发生了一定的改变。
溴区包含蛋白7(BRD7)是中南大学湘雅医学院肿瘤研究所分子遗传室通过cDNA代表性差异分析、文库筛选等方法分离克隆的一个cDNA全长新基因[1]。该基因在鼻咽癌细胞系和活检组织中表达下调,细胞计数、软琼脂集落形成、流式细胞分析及裸鼠成瘤等细胞生物学实验[2]结果均支持BRD7具有抑制鼻咽癌细胞生长的功能,提示BRD7为鼻咽癌抑瘤基因强有力的候选者。进一步的实验[3]结果显示,BRD7可能通过Ras/MEK/ERK和Rb/ E2F 2条通路影响细胞周期的进程,使细胞停滞于G0/G1期。同时研究[4]发现,BRD7能够与核转录因子BRD2、IRF2等发生交互作用,推测BRD7为一个潜在的核转录调节因子。BRD7含有一个bromodomain结构域,属于bromodomain家族成员。bromodomain是一种高度保守的结构域,一般由60~110个氨基酸残基组成。该家族的大多数成员与基因的转录调控有关,并证实了一些bromodomain蛋白是核转录因子,参与基因的转录调控[5]。因此,该研究主要探讨BRD7的亚细胞定位,另一方面通过构建BRD7的bromodomain缺失突变体,探讨bromodomain结构域对BRD7亚细胞定位的影响。
1 材料与方法
1.1 主要材料和试剂
1.1.1 质粒、菌株和细胞系 大肠杆菌JM109和真核表达质粒(pEGFP-C2、pCMV-Myc)由中南大学湘雅医学院肿瘤研究所分子遗传室购买并保存。插入了BRD7全长cDNA的真核表达重组质粒pEGFP-C2/BRD7和pCMV-Myc/BRD7由中南大学湘雅医学院肿瘤研究所分子遗传室构建保存。非洲绿猴肾COS7细胞购自中国医学科学院细胞库。
1.1.2 主要试剂和抗体 限制性内切酶(XhoⅠ、PstⅠ和EcoRⅠ等)、T4 DNA连接酶购自Promege公司,高保真酶(Pyrobest DNA聚合酶)、dNTP和T4多聚核苷酸激酶等购自大连宝生物公司;抗Myc单克隆抗体(Ab-Myc)购于Clontech公司;ECL化学发光试剂购自Pirece公司;RPMI 1640培养基为Gibco公司产品。
1.1.3 核苷酸引物的分析与合成、测序 利用Goldkey软件分析设计好的引物,确认引物内无发夹结构,引物间无二聚体形成。P1(正义:5’-AAAGCTGCAAAGAAGCTGTTGCACTCA-3’;反义: 5’-CAATTGTCTCATCAGTTGATTCAAAGC-3’)为构建BRD7的bromodomain(148~218)缺失突变体pCMV-Myc/BRD7△brd的引物;P2(正义:5’-AAT CTCGAGTATGGGCAAGAAGCACAAGAAGCACAAG-3’;反义:5’-ATACTGCAGTCAACTTCCACCAGGTC CACACTC-3’)为将bromodomain缺失型BRD7片段连接到pEGFP-C2载体中(构建pEGFP-C2/BRD7△brd)的引物。所有引物合成和重组质粒测序均由上海博亚公司完成。
1.2 bromodomain缺失型BRD7重组体的构建①构建bromodomain缺失型BRD7重组质粒pCMVMyc/BRD7△brd。利用设计好的引物P1,以pCMVMyc-BRD7为模板。PCR反应体系为50 μL:模板DAN 5 μL,高保真酶1 μL,引物4 μL,10×Buffer 5 μL,dNTP 8 μL,ddH2O 27 μL。按如下条件进行PCR扩增:95℃变性5 min,94℃变性30 s,68℃退火延伸5.5 min,扩增30个循环;72℃终末延伸10 min。产物回收纯化后用T4 PNK进行5’端磷酸化处理。最后用T4 DNA连接酶进行自身环化连接,连接产物进行转化。采用EcoRⅠ对挑选克隆进行初步鉴定后,送测序鉴定。②构建pEGFP-C2/BRD7△brd重组体。采用设计的引物P2,以上述构建好的pCMV-Myc/BRD7△brd质粒为模板,按如下条件进行PCR扩增:95℃变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸2 min,扩增30个循环;最后终末延伸10 min。PCR产物回收纯化后用XhoⅠ和PstⅠ消化接头,再与经过同样双酶切消化的pEGFP-C2载体连接,最后转化,重组质粒酶切鉴定与测序。
1.3 Western Blot 在6孔板中分别接种2.0× 105个/孔的 COS7细胞。次日,待细胞长满至50%~70%后,采用脂质体介导的细胞转染方法,分别将pCMV-Myc、pCMV-Myc/BRD7和pCMV-Myc/ BRD7△brd 3种质粒各1.5~2.0 μg转染到上述COS7中,瞬时表达后收获细胞。采用三去污裂解缓冲液抽提细胞总蛋白[6],蛋白样品变性后经120 g/ L的SDS-聚丙烯酰胺凝胶电泳分离,电转至硝酸纤维素膜上。然后再经50 g/L的脱脂奶封闭,Ab-Myc一抗4℃孵育过夜,相应羊抗小鼠二抗37℃孵育1 h,ECL发光试剂显色,胶片压片后显影、定影。
1.4 GFP介导的蛋白亚细胞定位 首先在6孔板的每个孔中分别放置一块盖玻片,然后接种1.5× 105个/孔的COS7细胞。按1.3方法分别将pEGFP-C2/BRD7、pEGFP-C2/BRD7△brd 2种质粒各1.5~2.0 μg转染到上述细胞中。瞬时表达后,取出盖玻片。丙酮/甲醇(体积比1∶1)固定细胞,DAPI染色后,再于荧光显微镜下观察、摄片。
1.5 免疫荧光实验考察蛋白的亚细胞定位 采用1.3方法分别将pCMV-Myc/BRD7和 pCMV-Myc/ BRD7△brd 2种质粒各1.5~2.0 μg转染到COS7细胞中,瞬时表达后,取出盖玻片。丙酮/甲醇(体积比1∶1)固定细胞,抗原修复液对细胞进行核抗原修复,体积分数0.25%Triton-100处理30 min,正常血清封闭30 min,Ab-Myc一抗4℃孵育过夜,Cy3标记的羊抗鼠二抗37℃孵育1 h。DAPI染色后,于荧光显微镜下观察、摄片。
2 结果
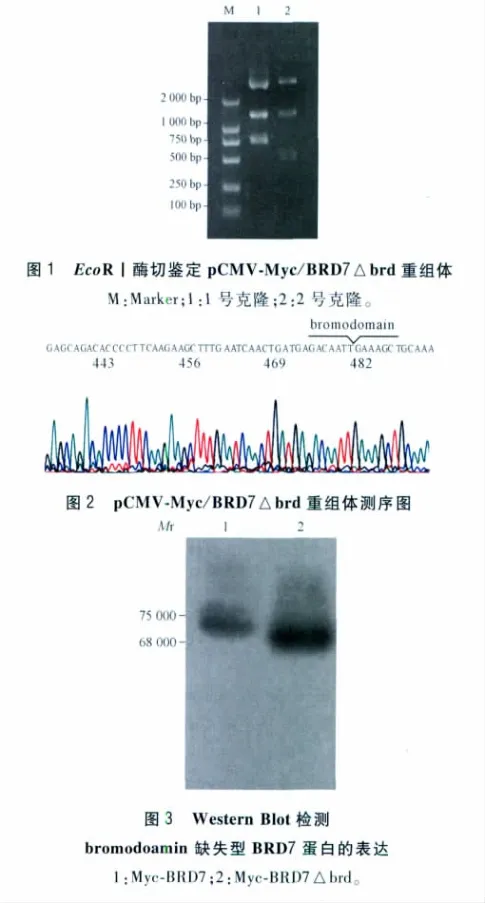
2.1 质粒pCMV-Myc/BRD7△brd的鉴定 重组质粒EcoRⅠ酶切鉴定结果见图1。若无 bromodomain结构域的缺失,则酶切产物片段应为5 000 bp+760 bp;若有bromodomain结构域的缺失,则酶切产物片段应为5 000 bp+547 bp。故2号克隆为候选阳性克隆,将2号克隆送测序鉴定(图2)。测序结果表明bromodomain结构域已完整缺失,衔接处及整个BRD7编码区无碱基缺失、错配和移位。Western Blot检测结果显示外源表达的BRD7缺失型蛋白比野生型BRD7低,大小约为68 000,与预测大小完全一致(图3),表明bromodomain缺失型BRD7重组体pCMV-Myc/BRD7△brd构建成功。
2.2 pEGFP-C2/BRD7△brd的鉴定 重组质粒XhoⅠ和PstⅠ双酶切鉴定结果见图4,发现1、2号克隆均为阳性克隆,随机挑选1号克隆送测序鉴定。测序结果表明,重组体pEGFP-C2/BRD7△brd中BRD7的bromodomain结构域完整缺失,无序列错配和阅读框架改变(图5),表明 pEGFP-C2/BRD7△brd构建成功。

图4 XhoⅠ和PstⅠ双酶切

图5 pEGFP-C2/BRD7△brd重组体测序图
2.3 bromodomain对BRD7蛋白亚细胞定位影响结果表明,bromodomain缺失并不影响BRD7的细胞核分布,但是在核内的分布模式发生了一定的改变,野生型BRD7在核内主要以细点状或条索状分布,相对均匀(图6A和图7A);bromodomain缺失型BRD7主要以颗粒状分布,不规则(图6B和图7B)。

3 讨论
BRD7含有一个bromodomain结构域,属于bromodomain家族成员。bromodomain是近年来发现的广泛分布于多种生物中的一种高度保守的结构域,一般由60~110个氨基酸残基组成[5]。许多bromodomain蛋白家族成员的bromodomain结构域参与了组蛋白的乙酰化作用,与基因的转录调控相关联。蛋白乙酰化和去乙酰化是蛋白活性调节的一种重要形式,通过乙酰化或去乙酰化,改变了染色质结构或是转录因子的活性,从而使下游靶基因的表达水平发生改变[6-9]。先前的研究[10]发现,BRD7能够和乙酰化的组蛋白 H3结合,说明 bromodomain在BRD7基因功能发挥中可能起到了关键的作用。
转录因子有2种分布形式:胞核形式和潜在的胞质形式;蛋白质在这2种分布形式下的功能完全不同[11]。作者考察了BRD7在COS7细胞中的定位,发现BRD7主要定位在细胞核,呈条索状或片状分布。这种分布同活性染色质的分布比较一致,也可能是其转录活性功能发挥的关键所在。文献[12]报道,多种bromodomain家族的成员都有类似的分布模式,如BRD4等。因而BRD7在细胞内的定位模式与其功能发挥是统一的。
缺失突变是研究蛋白质结构与功能关系常用的方法和手段,是架构蛋白质结构和功能的桥梁和纽带。BRD7是bromodomain蛋白家族的成员,其bromodomain结构域可能在BRD7的亚细胞定位和功能发挥过程中起了关键的作用。为此作者通过一种新型PCR方法[13]构建了bromodomain缺失的BRD7突变体,并通过测序和表达分析的方法进行了证实。结果显示,bromodomain缺失并不影响BRD7的细胞核分布,但是在核内的分布模式发生了一定的改变。bromodomain缺失型BRD7主要以粗点状分布,不规则;与野生型BRD7在核内的分布模式存在一定不同。BRD4亦为bromodomain蛋白家族成员,含有2个bromodomain结构域。野生型BRD4的核定位分布与活性染色质的分布比较一致,但当bromodomain缺失突变后(无论是单个bromodomain的缺失,还是双bromodomain同时缺失),BRD4在核内的分布发生明显改变,与染色质的分布完全不同[14-15],说明bromodomain在BRD4的核内分布模式上起了关键作用。
上述改变是否与BRD7的细胞生物学功能直接相关,仍有待于进一步的研究。
[1]Wu M,Li X,Li X,et al.Signaling transduction network mediated by tumor suppressor/susceptibility genes in NPC[J].Curr Genomics,2009,10(4):216
[2]Li XL,Wu MH,Li GY.Functional genomics of nasopharyngeal carcinoma susceptibility/suppressor gene[J].Zhong Nan Da Xue Xue Bao Yi Xue Ban,2008,33(7):553
[3]李淑芳,周鸣,刘华英,等.BRD7调控Rb/E2F通路的分子机制研究[J].生物化学与生物物理进展,2007,34 (8):881
[4]Gyuris A,Donovan DJ,Seymour KA,et al.The chromatintargeting protein Brd2 is required for neural tube closure and embryogenesis[J].Biochim Biophys Acta,2009,1789 (5):413
[5]LeRoy G,Rickards B,Flint SJ.The double bromodomain proteins Brd2 and Brd3 couple histone acetylation to transcription[J].Mol Cell,2008,30(1):51
[6]程晓丽,神吉智丈,李春燕,等.热休克蛋白10和热休克蛋白60的表达、纯化及与线粒体DNA转录因子A相互结合[J].郑州大学学报:医学版,2007,42(1):50
[7]孙陆果,马克威.Prohibitin 2调节肌细胞增强因子2转录因子活性的分子机制[J].吉林大学学报:医学版,2009,35(5):774
[8]周鹏,何凤田,刘东擘,等.人类乳头瘤病毒18 E7原癌蛋白对宫颈癌细胞系中组蛋白去乙酰化酶1表达的下调作用[J].第三军医大学学报,2010,32(2):139
[9]杨文婷,刘树艳,郑鹏生.转录因子KLF4在宫颈癌中的表达及意义[J].西安交通大学学报:医学版,2010,31 (1):22
[10]Senthilkumar R,Mishra RK.Novel motifs distinguish multiple homologues of Polycomb in vertebrates:expansion and diversification of the epigenetic toolkit[J].BMC Genomics,2009,10:549
[11]李敏,纪泽泉,陈永达.核转录因子-κB反义核酸对肾小球硬化细胞炎性反应的干预[J].实用儿科临床杂志,2008,23(15):1190
[12]You J,Li Q,Wu C,et al.Regulation of aurora B expression by the bromodomain protein Brd4[J].Mol Cell Biol,2009,29(18):5094
[13]殷德涛,王琳,尹峰燕,等.分化型甲状腺癌组织中脆性组氨酸三联体基因外显子5、8纯合性缺失及突变检测[J].郑州大学学报:医学版,2008,43(2):242
[14]Lee AY,Chiang CM.Chromatin adaptor Brd4 modulates E2 transcription activity and protein stability[J].J Biol Chem,2009,284(5):2778
[15]Lin YJ,Umehara T,Inoue M,et al.Solution structure of the extraterminal domain of the bromodomain-containing protein BRD4[J].Protein Sci,2008,17(12):2174
Effects of bromodomain on subcellular localization of BRD7
XU Xiaojie1),ZHOU Ming2),LI Guiyuan2)1)Department of Pathology,Nanyang Medical School,Nanyang 473000 2)Department of Molecular Genetics,Cancer Research Institute,Xiangya School of Medicine,Central South University,Changsha 410078
nasopharyngeal carcinoma;deletion mutation;subcellular localization;bromodomain;BRD7
Aim:To investigate the subcellular localization of BRD7 and the effects of bromodomain on its localization.Methods:Firstly,the subcelluar localization of BRD7 was detected in COS7 cells by direct GFP fluorescence.Secondly,bromodomain deleted BRD7 mutations,pCMV-Myc/BRD7△brd and pEGFP-C2/BRD7△brd,were constructed to investigate the effects of bromodomain on the subcellular localization of BRD7 in COS7 cells by GFP fluorescence and indirect immunofluorescence.Results:It was found that BRD7 and bromodomain deleted BRD7 mutations were all mainly localized in nucleus,which was similar to the nuclear distribution of chromatin,to some extent.Conclusion:Bromodomain deletion may not affect the nuclear localization of BRD7,but the localization pattern of BRD7 in nucleus is changed.
R739.6
*国家自然科学基金资助项目 30300175,30200135,30400238,30470367
(2010-11-25收稿 责任编辑姜春霞)

