新生牛血清对大鼠脂肪来源细胞生长的影响
李 萍,田 方,宋 琦,刘焕霞,李孟芳,魏 丹
(遵义医学院附属口腔医院 病例科,贵州遵义563000)
Zuk等[1]于2001年首次从人抽取脂肪中分离出一种具有成纤维样形态的细胞亚群,并命名为提取的抽脂物细胞(processed lipoaspirate,PLA),经特异因子诱导可向骨细胞、脂肪细胞、肌细胞和软骨细胞等多谱系细胞分化,次年,又从PLA细胞亚群中分离出形态均一、经分子生物学和生物化学检测可多系分化的细胞克隆,称之为脂肪来源干细胞(Adipose-derived stem cells ,ADSCs)[2]。ADSCs因其对组织损伤小、具有多系分化潜能,且来源广泛、获得率高、没有伦理道德问题等优点,有望替代骨髓组织来源的间充质干细胞(mesenchymal stem cells,MSCs)成为自体成体干细胞来源,应用于临床移植治疗。
脂肪来源细胞培养普遍使用含血清的培养基,尤其是胎牛血清(fetal bovine serum,FBS)。我们采用新生牛血清替代传统的胎牛血清培养分离的大鼠脂肪来源细胞,观察新生牛血清对大鼠脂肪来源细胞生长的影响,以期用价格较便宜的新生牛血清替代传统价格较贵的胎牛血清进行脂肪来源细胞培养。
1 材料和方法
1.1 主要实验材料 出生后3~5d的SD大鼠(我校实验动物中心);Ⅰ型胶原酶(Sigma,美国);DMEM/F12(1:1)培养基(Gibco,美国);新生牛血清(杭州四季青);超净工作台(苏州净化设备有限公司);倒置相差显微镜(Olympus,日本);CO2孵箱(Thermo,美国)。
1.2 大鼠脂肪来源细胞的分离和培养
1.2.1 切取大鼠腹沟股脂肪组织 取出生后4d的SD乳鼠4只,引颈处死、消毒,切腹股沟脂肪组织,剔除结缔组织及肉眼可见的小血管,含1%抗生素的PBS冲洗3次。具体方法详见参考文献[3]。
2.2.2 细胞悬液的制备 眼科剪将脂肪组织块剪成浆糊状;移至青霉素小瓶中,加入1~2 mL0.1%Ⅰ型胶原酶溶液,37℃水浴箱孵育40~60min;消化液吹、过滤,收集滤液。
2.2.3 大鼠脂肪来源细胞的培养 将上述单细胞悬液离心,弃去上层脂肪和上清,清洗2~3次;加入2mL基础培养液(D/F12+10%新生牛血清+1%青霉素链霉素)重悬细胞以1×106接种于培养瓶,CO2孵箱培养。待细胞长满瓶底面积的80%,标准的胰酶消化法1:3传代细胞。倒置相差显微镜观察细胞生长情况。
2 结果
新生牛血清培养的P0代脂肪来源细胞的形态:原代脂肪来源细胞在24h后大部分都会贴壁,在倒置相差显微镜下细胞呈集落样生长,似鱼群状或漩涡状,随培养时间延长,集落逐渐增大、相互融合直至细胞长满瓶底;大部分细胞呈现成纤维细胞样形态,短梭形或多角形,细胞形态较均一。(图1)。
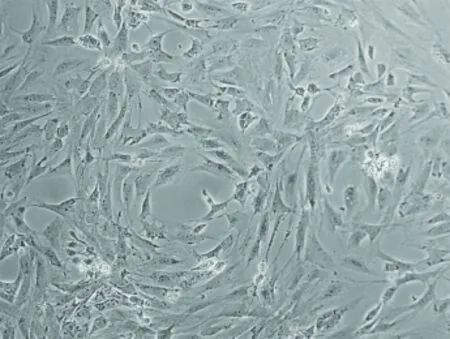
图1 P0代脂肪来源细胞鱼群状的细胞集落(×100)
在P2~P3代细胞分支增多,胞体增大,细胞的形态趋向多样,细胞胞浆内特别是在核区附近出现黑色颗粒,提示细胞开始出现老化(图2、3)。

图2 新生牛血清培养的P3代老化细胞(×100)
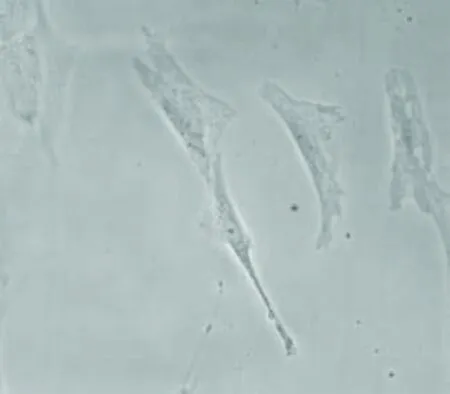
图3 新生牛血清培养的P3代老化细胞(×200)
3 讨论
体外培养的细胞受到外界环境影响的因素很多,细胞状态的改变也与多方面因素有关。细胞老化的原因很复杂。在培养过程中,不仅是培养液、血清、消化液因素,还有温度,光照,含氧量等因素都可能。细胞在培养过程中如果环境不适合其生长就会出现部分细胞的老化现象,表现为:①细胞胞浆内特别是在核区附近出现黑色颗粒;②细胞胞浆内出现空泡;③细胞立体感逐渐消失,细胞间的间隔不清,部分细胞扁平状,细胞的形态趋向多样;④贴壁性减退,出现一些漂浮的细胞;⑤部分分泌强的细胞分泌物增多,细胞表面会比较脏;⑥细胞增殖速度明显下降,分裂相的细胞明显减少等。
有研究认为,血清质量的好坏最直接影响到胚胎干细胞(embryonic stem cells,ES)的培养,使用优质血清ES细胞的克隆率能达20%以上[4]。在胎儿、儿童和成人组织中存在的成体干细胞(adult stem cells)是由ES细胞继续分化形成的多能干细胞。脂肪来源干细胞是多能干细胞。因此,血清质量的好坏可影响体外培养的脂肪来源干细胞。牛血清作为细胞培养中用量最大的天然培养基,其中含有丰富的细胞生长必须的营养成份。胎牛血清取自剖腹产的胎牛;新牛血清取自出生24h内的新生牛。
据实验[5],使用DMEM培养基并添加5%胎牛血清的培养条件下,P2代~P3代时增殖迅速、形态均匀、大部分呈长梭形、排列规则,P5代后脂肪干细胞仍可以保持较强的增殖能力,并保持其表型和更强的多向分化潜能。本实验中,我们使用了新生牛血清代替传统培养脂肪来源细胞使用的胎牛血清,脂肪来源细胞在P0代生长较好:细胞形态大致均一、呈放射状排列的团样细胞集落,伸出长短不一、粗细不均的突起、胞核大、核仁清晰、有较多分裂相;但P2代~P3代即出现了老化现象。该现象提示,脂肪来源细胞的体外培养中,优质的胎牛血清可能优于新生牛血清。可能与胎牛尚未与外界环境接触,其血清中所含的抗体、补体等对细胞有害的成分较少有关。王福科等[6]发现:新生牛血清培养的脂肪来源细胞较纯,而胎牛血清更适于血管内皮细胞生长。但我们的实验结果显示,尽管采用新生牛血清可以得到形态较为均一的原代脂肪来源细胞,但细胞在较早期即出现了老化现象。因此,我们推测,新生牛血清对脂肪来源细胞的活力有负面影响,可能不适用于脂肪来源细胞的培养。
[1]Zuk P A,,Min Zhu,Ashjian Peter,et al.Human adipose tissue is a source of multipotent stem cells[J].Molecular Biology of the Cell,2002,13:(12)4279-4295.
[2] Zuk P A.,Min Zhu,Mizuno H,et al.Multilineage cells from human aipose tissue:implications for cell-based therapies[J].Tissue Engineering,2001,7(2):211-228.
[3] 陈小红,刘鲁川,金岩,等.脂肪来源干细胞诱导分化为成牙本质样细胞的体外培养研究[J].实用口腔医学杂志,2008,24(1):9-12.
[4] Boquest AC,Shahdadfar A,Brinchmann JE.Isolation of stromal stem cells from human adipose tissue[J].Methods Mol Biol,2006,325:35-46.
[5] 赵彩霞.脂肪干细胞向成牙本质细胞分化的初步研究[D],硕士学位论文,2009.1-42.
[6] 王福科,赵德萍,代晓明,等.不同类型血清对大鼠脂肪干细胞分离培养的影响[J].昆明医学院学报,2010(3):4-10.

