CD40和CD86在慢性阻塞性肺疾病患者中的变化及意义
符丹丹,欧阳瑶,薛令合
(遵义医学院附属医院 呼吸内科,贵州遵义563000)
慢性阻塞性肺疾病(Chronic Obstructive Pul- monary Disease,COPD)是威胁中老年健康的常见疾病,其发病机制尚未完全清楚,目前认为主要与气管、支气管炎症反应有关。树突状细胞(Dendritic Cells,DCs)是体内功能最强的抗原递呈细胞(Antigen Presenting Cells,APCs),表达多种识别外源性抗原的受体,并监控黏膜上皮表面出现的各种危险信号,快速高效地摄取、加工处理和提呈抗原,显著地刺激初始型T细胞的增殖和活化,是启动、调控并维持特异性免疫应答的中心环节。正常情况下,DCs持续性低水平表达CD40、CD86分子,但在炎症刺激的过程中CD40、CD86分子的表达会明显上调[1]。此外,DCs上MHCII类抗原也是靠CD40分子维持其高水平的表达[2]。目前,有关DCs在COPD发病中的作用知之甚少,因此,本研究将通过检测不同COPD人群痰液中DCs的表面标志物CD40和CD86分子的表达变化,探讨DCs与COPD的关系。
1 对象和方法
1.1 对象及分组 纳 入我院2008年1月至2009年3月住院患者51例,分为Ⅰ组:无吸烟正常对照组(n=5,平均65.1±4.5岁);Ⅱ组:吸烟无COPD组(n=5,平均69.2±2.6岁);Ⅲ组:COPD GOLDⅠ级(n=11,平均68.9±7.4岁);Ⅳ组:COPD GOLDⅡ级(n=17,平均71.0±5.7岁);Ⅴ组:COPD GOLDⅢ~Ⅳ级(n=13,平均72.9±6.5岁)。入院当天采集临床资料。参照《根据2007版慢性阻塞性肺疾病全球倡议(GOLD)评价》,对COPD患者按病情轻重程度进行分级,对COPD患者的病情严重程度进行临床评估。
1.2 肺通气功能测定 采 用意大利MIR肺功能仪,参照美国胸科协会肺功能检查操作规范进行常规肺通气功能测定。本研究观察指标包括:用力肺活量(FVC)、第1秒用力呼气容积(FEV1%)、FEV1/FVC。
1.3 标本采集 采 用氧气雾化吸入法收集受试者的诱导痰,采用改良pin法,常用梯度高渗盐水法,试剂配制:3%、4%、5%高渗盐水,0.1%二硫苏糖醇(DTT)等。
1.4 痰液处理及标本 测 定①痰液称重,加入2倍体积的0.1%的DTT充分混合,在漩涡振荡器上混匀;②再置于37℃恒温水浴箱中孵育并震荡30min,加入与DTT等体积的D-PBS后继续水浴并震荡5min;③将稀释的痰液经4层无菌纱布过滤,滤液在离心机中以1000r/min的速度离心10min,弃上清;④细胞层(沉淀)用D-PBS重悬,用300目尼龙网过滤,并在离心机中以1000r/min的速度离心10min,离心2次,吸管吸去每次离心后的上清液;⑤沉淀用D-PBS重悬,在倒置显微镜下调整细胞数为1×106/mL;⑥分别加入两个流式细胞仪专用试管内;⑦其中一个管作为自身对照管;向另一个管内加入Mouse Anti-Human CD40(美国BD公司),PE 5l和Mouse Anti-Human CD86(美国BD公司),FITC 5L作为待测标本管,加入试剂时均需漩涡混匀;⑧室温避光孵育30min,尼龙网过滤;(9)4℃避光流式细胞仪检测。
1.5 统计学处理 所 有数据均用SPSS11.0统计学软件包进行统计分析。计量资料数据均采用均数±标准差(±)表示。两组间的比较,采用两独立样本检验。两因素相关分析用直线相关分析<0.05,有统计学差异<0.01认为有显著性统计学差异。
2 结果
2.1 不同受试组基本资料及肺功能比较 对 不同受试组的性别及年龄进行两两比较无明显差异(>0.05),具有可比性。各组肺功能测定结果如表1。
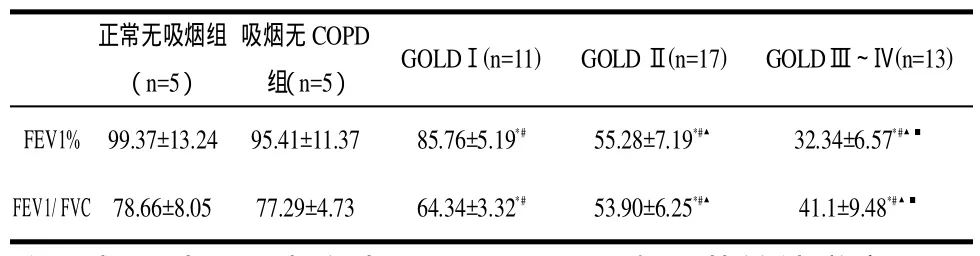
表1 不同受试组肺功能的测定结果Tab 1 The results of pulmonary function in the different groups
2.2 诱导痰中的DCs CD40的测定结果:CD40在GOLDⅠ级、GOLDⅡ级及GOLDⅢ~Ⅳ级均高于正常对照组和吸烟无COPD组。且有显著统计学意义(P<0.01),但正常无吸烟组与吸烟无COPD组无统计学意义(见表2,图1)。CD86的测定结果:CD86在GOLDⅠ级、GOLDⅡ级以及GOLDⅢ~Ⅳ级均高于正常对照组和吸烟无COPD组。且有显著统计学意义,但正常无吸烟组与吸烟无COPD组无统计学意义(< 0 .01)(表2,图 2 )。
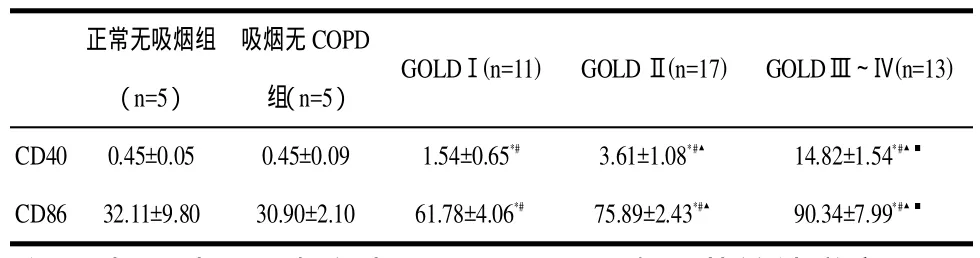
表2 不同受试组痰CD40和CD86的测定结果Tab2 The resultsof sputun CD40in the differentgroups

图1 各组DCs的CD40的表达

图2 各组DCs的CD86的表达
2.3 DCs与FEV1%的相关性分析 DCs与FEV1%呈负相关关系(r=-0.913,-0.893<0.05)
3 讨论
慢性阻塞性肺疾病是引起世界范围内致死和致残的重要疾病。COPD的发病机制尚不清楚,可能与多种因素有关,其中吸烟和感染被认为是最重要的两个因素。
DCs最早由美国学者Ralph于1973年发现,因其成熟时伸出许多树突样或伪足样突起而得名。目前COPD与肺部DCs的关系,国内尚未见报道,国外相关研究也较少,且结果并不一致。来自大鼠COPD模型的研究显示DCs亦参与了COPD的发病机制。D'hulst等[3]研究显示,吸烟小鼠气道和肺实质炎症细胞如中性粒细胞、巨噬细胞和淋巴细胞等进行性增加,支气管肺泡灌洗液(Broncho-alveolar Lavage,BAL)的分析结果显示,吸烟3d时就可见肺内DCs开始增多;80d时,气道和肺实质的DCs浸润明显增加,DCs的主要组织相容性抗原MHC II分子和共刺激分子CD40、CD86等表达上调,且出现类似于肺气肿和COPD的肺形态学改变。此外,Zeid等[4]研究亦证实被动吸烟的大鼠肺内DCs的数目明显增多。但这些结果均未涉及COPD患者。
本研究采用流式细胞仪检测DCs的表面标志CD40和CD86表达水平,分析COPD患者诱导痰中DCs数量的变化,探讨DCs与COPD的关系,国内鲜有类似报道。结果显示,所有COPD患者,无论GOLD分级水平高低,CD40和CD86表达水平均明显高于正常对照组和吸烟无COPD组(< 0 .01),这提示,与无吸烟的正常对照组及吸烟无COPD组相比,COPD患者气道中DCs的数量是明显增加的。同时,本研究根据FEV1%水平对COPD患者病情严重程度进行分级后,探讨DCs数目与COPD病情严重程度的关系,结果显示,COPD患者中,随着GOLD分级增加和FEV1%水平的降低,DCs的数量明显增加,与COPD病情严重程度成正相关,与Demedts等[5]的研究结果类似。由此推测,DCs数目可反映COPD患者气道病变的严重程度,亦可作为气流阻塞的一个客观指标对COPD的病情变化做出一定的评估。
吸烟是否影响肺组织中DCs的数量仍有一些争议。D'hust等[3]研究显示吸烟小鼠气道和肺实质中DCs浸润明显增加但也有不一致的结论。Demedts等[5]研究发现,COPD患者较吸烟无COPD者以及从不吸烟者气道DCs数目明显升高,但吸烟者与不吸烟者气道DCs数目没有差异,提示DCs在COPD患者中数目增加,且以小气道(直径<2mm)中DCs数目增加为主[6]。Rogers等[7]比较了吸烟与已戒烟的COPD患者中支气管粘膜上皮DCs数目差别,结果显示:与已戒烟的COPD患者相比,吸烟的COPD患者和吸烟正常人上皮下组织中DCs数目均明显减少(分别为<0.05,<0.01),而已戒烟的COPD患者DCs数目与变应性哮喘和健康人DCs数目相似。这一研究表明,在COPD患者中,吸烟者DCs数目是降低的。Robbins等[8]的研究显示,吸烟可以减少小鼠肺部DCs数目,影响肺部抗病毒免疫功能。不仅如此,长期吸烟能降低DCs的成熟和功能,增加肺部反复感染几率和恶化频率,加速COPD进程[9,10]。本研究中所选取的COPD患者均为长期大量吸烟者(均>400年支),分析发现,在吸烟的COPD患者诱导痰中CD40和CD86的表达显著上调,进一步说明DCs在COPD患者的气道浸润明显增加;而正常无吸烟者的DCs的数量与吸烟无COPD者DCs数量无明显差异。这似乎提示,吸烟并不影响肺部DCs的数目。但本研究标本量偏少以及吸烟且COPD者的吸烟指数较低亦可能影响结果分析。总之,吸烟是否影响COPD患者肺部DCs数目尚未完全明确,有待进一步深入研究。
综上所述,本研究在国内首次证明了COPD患者气道内DCs数量的明显增加,且与COPD病情的严重程度呈正相关。未来的研究需探讨DCs在COPD的发病机制中所扮演的角色,从而为COPD的治疗提供一个新的思路。
[1] Bugeou L,Dallmon S.Co-stimulatin of T cells[J].Am J Respir Cur Canc Med,2000,162(4):164-S168.
[2] Parry R,V,Rumbley C A,Vandenberghe,et al.CD28 and inducible costimulatory protein src homology 2 binding domains show distinct regulation of phosphatidylinositol 3-Kinase,Bcl-xl,and IL-2 expression in primary human CD4 T lymphocytes[J].J Immunol,2003,171(1):166-174.
[3] D'hulst AI,Vermaelen KY,Brusselle GG,et al.Time course of cigarette smoke-induced pulmonary inflammation in mice[J].Eur Respir J,2005,26(2):204-213.[4] Zeid NA,Muller HK.Tobacco smoke induced lung granulomas and tumors:association with pulmonary Langerhans cells[J].Pathology,1995,27:247-254.
[5] Demedts IK,Bracke KR,et al.Accumulation of dendritic cells and increased CCL20 levels in the airways of patients with chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,2007,175:998-1005.
[6] Demedts IK,Bracke KR,et al.Identification and characterization of human pulmonary dendritic cells[J].Am J Respir Cell Mol boil,2005,32:177-184.
[7] Rogers AV,Adelroth E,Hattotuwa K.Bronchial mucosal dendritic cells in smokers and ex-smokers with COPD:an electron microscopic study[J].Thorax,2008,63:108-114.
[8] Robbins CS,Dawe DE,Goncharova SI,et al.Cigarette smoke decreases pulmonary dendritic cells and impacts antiviral immune responsiveness[J].Am J Respir Cell Mol Biol,2004,30(2):202-211.
[9]Tsoumakidou M,Demedts IK,Brusselle GG.,Et al.Dendritic Cells in Chronic Obstructive Pulmonary Disease:New Players in an Old Game[J].Am J Respir Crit Care Med,2008,177:1180-1186.
[10]Maclay JD,Rabinovich RA,Mac Nee W.Update in Chronic Obstructive Pulmonary Disease 2008[J].Am.J.Respir.Crit.Care Med,2009,179:533-541.

