促红细胞生成素对新生鼠缺氧缺血性脑损伤后学习记忆功能的影响
段淼
(遵义市第一人民医院新生儿科,贵州 遵义 563000)
促红细胞生成素不仅能促进红系祖细胞的增殖与分化,而且具有显著的神经保护作用。大量的动物实验发现EPO能促进胎儿脑的成熟,而且能明显改善脑损伤的预后[1]。临床研究发现EPO治疗急性脑中风病人安全有效[2];对新生儿缺氧缺血性脑病的患者,300U/kg/次EPO能促进神经功能恢复[3],但是增加剂量是否会增大疗效,我们对此进行实验研究,现报道如下。
1 材料和方法
1.1 模型制备 新生7日龄Wistar大鼠40只,雌雄不限,清洁级,体重15±2.5g,由重庆第三军医大学野战外科研究所动物室提供[许可证号:scxk(渝)2009-0006]。HIBD模型制备参照文献[15]。把随机选中的Wistar大鼠仰卧固定于手术板上,用0号线双线结扎右侧的颈总动脉,并在中下处剪断,然后用6-0一次性缝线缝合切口。术后让大鼠休息1小时后,将其放置在自制的有机玻璃缺氧舱内(缺氧舱内温度由恒温水槽维持在37.0±0.1℃),持续以1-2 L/min的速度输入含92%N2+8%O2的低氧气源2h,结束后随机将成功制模的32只大鼠分为4组,即HIBD对照组,EPO治疗Ⅰ组,EPO治疗Ⅱ组、EPO治疗Ⅲ组,每组8只,分别给予相应剂量的EPO和生理盐水,再放回原母鼠笼中继续哺育。剩余8只为假手术组,仅分离右侧颈总动脉,不结扎,不干预,不缺氧。
1.2 实验分组 假手术组(8只):仅分离右侧颈总动脉,正常饲养,不结扎,不给予药物,没有缺氧缺血的处理。 HIBD对照组(8只):缺氧缺血处理后正常饲养,与EPO治疗在相同时间按体重给予相同体积的生理盐水。EPO治疗Ⅰ组(8只):术后30min内腹腔注射EPO5u/g,连用14天。EPO治疗Ⅱ组(8只):术后30min内腹腔注射EPO10u/g,连用14天。EPO治疗Ⅲ组(8只):术后30min内腹腔注射EPO 15u/g,连用14天。
1.3 实验试剂及仪器 ①重组人促红素注射液 (Recombinant human erythropoietin injection):3000Iu/支,购自哈药集团生物工程有限公司,产品批号:S20050090。②氮氧混合气(92%N2+8%O2):贵阳申建气体有限公司。③甲醛:重庆市奇星达化工有限公司。④自制常压缺氧舱:容积为30cm×20cm×40cm。顶面及侧壁各有一直径为2cm的圆形小孔与外界相通,顶面小孔连接气源,侧壁小孔连接水封瓶。⑤Morris水迷宫:成都泰盟科技有限公司。
1.4 实验方法学习记忆功能的测评 Morris水迷宫实验,Morris水迷宫由圆形水池和计算机录像系统组成。水池直径130厘米,高45厘米,池内水深32厘米。水池按方位平均分为四个象限,标记为 E(east)、S(south)、W(west)、N(north)作为试验的起始点,在NE(northeast)象限内置一直径为11.5厘米,高30厘米的平台,平台没于水面下2厘米,平台及水池壁均为乳白色,水中加入奶粉使其与平台和水池壁颜色一致,训练时,水温保持在23~25℃,整个实验过程中水池及周围环境保持不变,5组大鼠于生后第28天开始进行Morris水迷宫行为测定。实验历时6天。①定位航行实验:实验前1天让大鼠自由游泳120秒,体会爬上平台的感觉,适应周围的环境。定位航行实验历时5天,每天训练4次,分别从4个不同的入水点入水,由MT-200 Morris水迷宫自动跟踪系统软件通过摄像机自动记录,观察大鼠寻找并爬上平台的路线图和所需的时间,即逃逸潜伏期(escape latency,EL),如果大鼠在120秒内未找到平台,需将大鼠引至平台,这时潜伏期记为120秒,每次训练间隔60秒后进行下一次训练。②空间探索实验:实验第6天进行空间探索实验(与最后一次训练间隔24小时后进行):移去平台,大鼠从SW(southwest)位置入水,记录大鼠在2分钟内穿过平台所在位置的次数,即为穿环指数。
2 结果
判断动物模型成功的标准采用运动功能评价的方式:3分:结扎对侧前肢屈曲,侧推抵抗力弱,转圈试验阳性;2分:结扎对侧前肢屈曲,侧推抵抗力弱,转圈试验阴性;1分:结扎对侧前肢持续屈曲;0分:向地面伸展双前肢,未见行为异常。3分者为成功模型,进行实验。
5组逃避潜伏期和穿环指数比较:随训练次数增加,各组大鼠的逃避潜伏期均呈下降趋势,同一组大鼠在不同时间点测得的逃避潜伏期有统计学差异(<0.05),随着训练天数的增加而逃避潜伏期缩短;同一时间点测得的各组大鼠的逃避潜伏期间存在统计学差异(<0.05),其中HIBD对照组时间最长,EPO治疗Ⅰ、Ⅱ、Ⅲ组次之,假手术组时间最短;EPO治疗Ⅰ、Ⅱ、Ⅲ间相互比较差异无统计学意义。5组穿环指数比较有统计学差异(<0.05),其中,假手术组较HIBD对照组高,EPO治疗Ⅰ、Ⅱ、Ⅲ组较HIBD对照组高,而假手术组和EPO治疗Ⅰ、Ⅱ、Ⅲ组差异无统计学意义(>0.05);EPO治疗Ⅰ、Ⅱ、Ⅲ组间两两比较,差异亦无统计学意义(>0.05)。
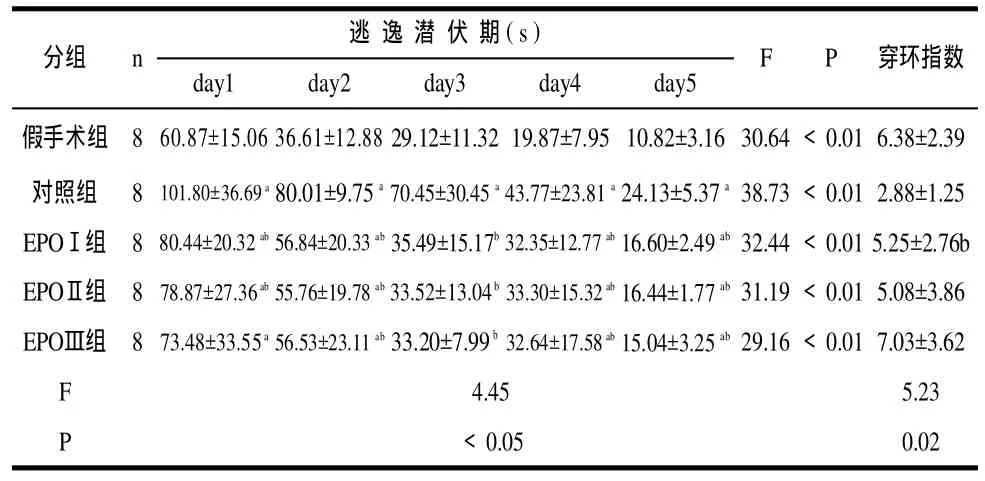
表1 五组大鼠逃逸潜伏期的比较(±)
3 讨论
新生儿窒息时其机体严重缺氧缺血,常导致缺氧缺血性脑损伤,严重者甚至死亡,部分存活者常留有不同程度的神经系统后遗症[4]。尽管目前研究证实脑缺氧缺血可以激活自体中枢神经干细胞的增殖、迁移和分化,但这并不能有效代偿因缺氧缺血造成的海马神经元丢失和空间学习记忆障碍,因此探索促进脑缺氧缺血海马神经发生的方法,已成为研究热点之一。近来研究发现脑缺氧缺血时EPO表达增加,EPO对缺氧缺血性脑损伤有保护作用,它具有抗凋亡、抗氧化性损伤、减轻炎症反应及促进神经系统血管再生[5],减少脑缺血梗死面积[6]的作用;动物和临床实验证实,EPO可以通过血脑屏障,为外源性EPO通过外周途径用药提供了实验依据,也为临床上外周应用EPO治疗新生儿窒息后脑损伤带来希望[7]。有研究者将EPO中和抗体注入到缺氧缺血性脑损伤后动物脑室内,采用免疫组化方法检测发现中枢神经干细胞数量显著降低[8]。赵舒武等[9]采用体外培养大鼠中枢神经干细胞方法,发现重组促红细胞生成素对缺氧干预的神经干细胞有显著保护作用,可维持其存活,促进其增殖,抑制缺氧诱发的异常凋亡发生。实验结果还显示,EPO对缺氧干预的中枢神经干细胞分化有明确的影响。以上均提示,EPO及其受体在脑缺氧缺血性损伤时起内源性保护作用,同时给予外源性EPO可加强其对神经元的保护。Wang等[10]提出了EPO治疗缺氧缺血性脑损伤的一种新思路,即血管内注入EPO基因。应用一种含有巨细胞病毒启动子控制下的EPO-cDNA裸体质粒,把这种质粒经尾动脉快速注入经缺氧缺血处理的小鼠体内,在小鼠体循环中产生高水平的EPO蛋白,一天后达到高峰,可维持14天,在水迷宫实验中发现经EPO基因治疗的小鼠,其地点认知能力障碍明显减轻,实验还发现EPO基因治疗的机制是使CA1区的神经元避免了缺氧缺血引起的致死性损伤,阻止了CA1区神经元的凋亡,降低了胼眂体神经胶质的活性。
学习和记忆是生物的基本特征之一,其物质基础是大脑皮质,其中海马在学习和记忆中发挥着重要作用[11]。海马具有易损性、选择性,因此脑缺氧缺血后海马结构遭受破坏,导致脑发育过程中功能和行为异常[12]。而本实验采用的Morris水迷宫是目前世界公认的较为客观的学习记忆功能评价方法,其原理为:让实验动物学习在水中寻找隐藏平台,然后通过分析大鼠寻找平台所需的时间和所走的路径判断其记忆功能好坏的实验方案,是一种研究空间学习记忆的标准实验。该实验系统以电脑和摄像机作为硬件基础,实验过程中只需对实验大鼠的头部涂上黄色的标记,以便追踪。软件识别算法采用了轨迹预测、局部和全局相结合的搜索技术,可以任意追踪和记录实验动物的位置。鼠脑发育的关键时期为生前5周至生后3周,大脑发育成熟是1个月左右,此期间脑组织的结构、生化及生理功能均迅速成熟,如果有缺氧缺血的发生,则可导致脑细胞水肿、坏死、出血,这些都会影响到大脑的发育。因此我们选择实验开始的时间是生后第28天,即大脑基本发育成熟,但学习、记忆的能力还不强的时期。从本实验的结果看出,5组大鼠的逃避潜伏期随日龄增加、游泳次数增多而呈现逐渐下降的趋势,说明随着学习次数的增加,大鼠对同一空间环境逐歩熟悉;同一时间点测得的各组大鼠的逃避潜伏期间亦存在统计学差异,其中HIBD对照组时间最长,EPO低、中、高剂量组次之,假手术组时间最短,EPO低、中、高三组剂量之间比较无统计学差异,提示HIBD后大鼠学习能力下降,早期给予EPO干预治疗能改善HIBD大鼠学习能力,但剂量大小的给予与改善HIBD大鼠学习能力没有关系;而穿环实验则说明总体比较有统计学差异,假手术组和HIBD对照组之间比较有统计学差异,HIBD对照组和EPO低、中、高剂量组之间比较亦有统计学差异,假手术组和EPO低、中、高剂量组比较无统计学差异,EPO低、中、高三组剂量之间比较无统计学差异,提示大鼠在空间记忆能力方面,假手术组和EPO低、中、高剂量干预组记忆能力强于HIBD对照组,虽然假手术组和EPO高、中、低剂量干预组比较没有统计学差异,但我们仍可认为缺氧缺血脑损伤可以使新生大鼠的空间记忆能力降低,而EPO有一定的改善空间记忆能力的作用,但剂量大小与改善空间记忆能力之间有无关联、给予多大的剂量才是安全有效的临床剂量等问题还需进一步探讨。
[1] Ehrenreich H,Aust C,Krampe H,et al.Erythropoietin:novel approaches to neuroprotection in human brain disease[J].Metab Brain Dis,2004,19(3-4):195-206.
[2] Ehrenreich H,Hasselblatt M,Dembowski C,et al.Erythropoietin therapy for acute stroke is both safe and beneficial[J].Mol Med,2002,8(8):495-505.
[3] 康文清,朱长连,熊虹,等.重组人促红细胞生成素治疗新生儿缺氧缺血性脑病的疗效[J].实用儿科临床杂志,2006,21(2):86-87.
[4] 王爱平,于凤琴,张家洁,等.新生儿窒息病因与远期预后的关系[J].中国妇幼保健,2007,15(22):2801-2802.
[5] Cotena S,Piazza O,Tufano R.The use of erythropoietin in cerebral diseases[J].Panminerva-Med,2008,50(2):185-192.
[6]Wakida K,Shimazawa M,Hozumi I,etal.Neuroprotective effect of erythropoietin,and role of metallothionein-1 and-2,in permanent focal cerebral ischemia[J].Neuroscience,2007,148(1):105-114.
[7] Xenocostas A,Cheung WK,Farrell F,et al.The pharmacokinetics of erythropoietin in the cerebrospinal fluid after intravenous administration of recombinant human erythropoietin[J].Eur J Clin Pharmacol,2005,61(3):189-195.
[8] Wen TC,Rogido M,Genetta T,et al.Permanent focal cerebral ischemia activates erythropoietin receptor in the rat brain[J].Neurosci Lett,2004,355:165-168.
[9] 赵舒武,高英茂,汪涛,等.促红细胞生成素对神经干细胞缺氧性损伤保护作用的实验研究[J].中国组织化学与细胞化学杂志,2008,17:293-297.
[10]Wang CH,Liang CL,Huang LT,etal.Single icuraveaous injection of plasmid DNA encoding erythropoietin provides neuroproteetion in hypoxia-ischemia rats[J].Biochem Biophys Res Commun,2004,314(4):1064-1071.
[11]Prior H,Schwegler H,Marashi V,et al.Exploration emotionality and hippocampalm ossy fibers in nonaggressive AB/Gat and congenic highly aggressive mice[J].Hippocampus,2004,14:135-140.
[12]谢玉波,陶红蕾,陈静,等.丙泊酚对大鼠空间学习记忆及海马钙调蛋白依赖性激酶Ⅱ的影响[J].中华麻醉学杂志,2008,24(7):617-619.

