亚氨二乙酸型复合材料IDAA-PGMA/SiO2对重金属及稀土离子的吸附行为与吸附热力学
姜桂明 高保娇 许文梅 王晓华
(中北大学化学工程系,太原030051)
亚氨二乙酸型复合材料IDAA-PGMA/SiO2对重金属及稀土离子的吸附行为与吸附热力学
姜桂明 高保娇*许文梅 王晓华
(中北大学化学工程系,太原030051)
将甲基丙烯酸缩水甘油酯(GMA)接枝于硅胶微粒表面,制得了接枝微粒PGMA/SiO2;使亚氨二乙酸(IDAA)与接枝PGMA的环氧基团发生开环反应,从而将亚氨二乙酸基团引入接枝微粒表面,制得了复合螯合微粒材料IDAA-PGMA/SiO2.本文研究了IDAA-PGMA/SiO2对重金属及稀土离子的螯合吸附行为,深入地研究了吸附机理与吸附热力学.研究结果表明:凭借亚氨二乙酸基团与重金属离子之间的静电作用与配位螯合作用的协同,复合微粒材料IDAA-PGMA/SiO2对重金属离子可产生强的螯合吸附作用,尤其对Pb2+离子表现出很强的螯合吸附能力,常温下吸附容量可达0.235 g·g-1;IDAA-PGMA/SiO2对重金属离子的吸附过程为一放热过程,且为焓驱动的过程,升高温度,吸附容量降低;对稀土离子的吸附过程则为熵驱动的过程;在可抑制金属离子水解的pH范围内,介质的pH值越高,IDAA-PGMA/SiO2的螯合吸附能力越强;IDAA-PGMA/SiO2对重金属离子的吸附容量远高于对稀土离子的吸附容量.
亚氨二乙酸;甲基丙烯酸缩水甘油酯;螯合吸附;重金属离子;稀土离子
1 引言
随着全球工业化进程的推进,重金属离子对水质的污染已对人类的生存造成了极大的威胁,1-3相关的分离技术与材料急待发展.目前,分离与去除水介质中重金属离子的方法有多种,如化学沉淀法、化学还原法、离子交换法、生物处理法及吸附法,诸方法相比,吸附法是一种简便、高效且吸附剂可再生与循环使用的有效方法,4-6而在各种固体吸附材料中,螯合吸附材料由于其选择性高与吸附容量高,7-9是被大力发展的一类固体吸附材料.
所谓螯合吸附材料(包括螯合树脂),是在固体基质表面键合有对金属离子具有螯合功能基团的固体(微粒)材料.螯合功能基团有多种类型,如亚氨乙酸型、Schiff碱型、水杨酸型、8-羟基喹啉型以及偕氨肟型等,在这些类型的螯合基团中,由于亚氨乙酸型螯合基团对金属离子具有普遍性的强螯合作用,10-13因此,目前在金属离子的分析检测方面,从水介质中去除重金属离子,在稀土及贵重金属离子的富集与回收方面,在蛋白质的分离与纯化以及金属络合物催化剂等方面,14-18亚氨乙酸型螯合吸附材料都备受关注.尤其在环境保护方面,由于亚氨乙酸型螯合基团对各种金属离子具有广泛的强螯合作用,可从水介质中高效地去除各种毒性金属离子,从而有效地保护与治理水质,故发展亚氨乙酸型螯合材料具有重要的科学价值与环境意义.
关于亚氨乙酸型螯合材料,目前研究较多的是在大孔交联聚苯乙烯微球表面键合亚氨乙酸基团的螯合树脂.19,20本研究则采用逐步接枝聚合的方式,先将甲基丙烯酸缩水甘油酯(GMA)接枝聚合在硅胶微粒表面,得到接枝微粒PGMA/SiO2,然后通过环氧键的开环反应,将亚氨二乙酸(IDAA)基团键合在接枝PGMA大分子链的侧链,制得了亚氨二乙酸型复合螯合吸附材料IDAA-PGMA/SiO2.21本文重点考察了该复合螯合吸附材料对重金属离子及稀土离子的螯合吸附行为与吸附机理,深入研究了螯合吸附热力学.
2 实验部分
2.1 试剂与仪器
硅胶(120-160目,青岛海洋化工有限公司),试剂级;γ-(甲基丙烯酰氧)丙基三甲氧基硅烷(MPS,商品名KH-570,南京曙光化工集团有限公司),分析纯;甲基丙烯酸缩水甘油酯(GMA,苏州南航化工有限公司),分析纯,使用前经减压蒸馏提纯;偶氮二异丁腈(AIBN)、六次甲基四胺、硝酸铅(Pb(NO3)2,天津市大茂化学试剂厂),分析纯;亚氨基二乙酸(IDAA,南通永盛化工有限公司),分析纯;硝酸镍(Ni(NO3)2,天津市天大化工实验厂),分析纯;硝酸镉(Cd(NO3)2,三氧化二钕(Nd2O3,国药集团化学试剂有限公司),高纯试剂;二甲酚橙(北京化工厂),分析纯;紫脲酸铵(沈阳市试剂五厂),分析纯;其它所用试剂均为市售分析纯试剂.
1700型傅里叶红外光谱仪(FTIR,美国Perkin-Elmer公司);PHS-2型酸度计(上海第二分析仪器厂);THZ-92C型气浴恒温振荡器(上海博迅实业有限公司医疗设备厂).
2.2 复合型功能微粒IDAA-PGMA/SiO2的制备与表征
2.2.1 接枝微粒PGMA/SiO2的制备与表征
按文献21所述的过程并加以一定的改进,采用“接出”法在硅胶表面接枝聚合GMA,典型的步骤如下:使用偶联剂KH570对硅胶微粒进行表面改性,将可聚合双键引入硅胶微粒表面,制得改性硅胶微粒MPS-SiO2.将1.5 g改性微粒MPS-SiO2置于溶解有11 mL GMA的100 mL N,N-二甲基甲酰氨(DMF)溶液中,加入引发剂偶氮二异丁腈(单体质量的1.4%),N2气氛中,恒温(70°C)并在搅拌条件下进行接枝聚合反应,得到接枝微粒PGMA/SiO2.用盐酸-丙酮法22测定接枝微粒表面PGMA的接枝度(g· g-1);21采用KBr压片法测定接枝微粒的红外光谱,表征其化学结构.本研究制备与使用的接枝微粒PGMA/SiO2其接枝度为0.235 g·g-1.
2.2.2 在接枝微粒PGMA/SiO2表面键合IDAA
采用文献21所述的步骤并加以一定的改进,在接枝微粒PGMA/SiO2表面键合IDAA:将2 g的接枝PGMA/SiO2微粒置于100 mL四口烧瓶中,加入10 mL的二甲亚砜浸泡溶胀12 h;然后将5 g IDAA、2 g NaCl加入到2 mol·L-1的50 mL碳酸钠溶液中,用氢氧化钠溶液调节上述溶液,使其pH=12.5,将此溶液加入到装有PGMA/SiO2微粒的四口烧瓶中,70°C恒温,在搅拌条件下使IDAA与接枝PGMA环氧基团之间发生开环反应(在此体系中,实际上IDAA是以钠盐形式存在,其目的是使环氧基团的开环反应更易于进行),反应24 h,过滤,用蒸馏水反复洗涤产物微粒,以除去未反应的IDAA,真空干燥,产物微粒即为键合有IDAA基团的复合螯合微粒IDAA-幕 PGMA/SiO2.
采用KBr压片法测定复合功能微粒IDA-PGMA/ SiO2的FTIR光谱,确认其化学结构;采用称重法计算接枝的PGMA大分子链上环氧基团开环反应的效率,21本研究制备与使用的复合螯合微粒其环氧基团开环率为70%.
2.3 复合螯合微粒IDAA-PGMA/SiO2对重金属离
子的等温吸附实验
2.3.1 吸附等温线的测定
在0.001-0.02 mol·L-1范围内配制浓度系列变化的Pb2+离子溶液.先考察螯合微粒IDAA-PGMA/ SiO2对Pb2+离子的吸附动力学行为,测得吸附达平衡的时间为3 h,在此基础上,进行等温吸附试验:分别移取20 mL浓度不同的Pb2+离子溶液,置于若干个50 mL的具塞磨口锥形瓶中,加入准确称取的质量为0.05 g的IDAA-PGMA/SiO2微粒,用稀盐酸调节溶液的pH值,使之处于某一定值,然后在气浴恒温振荡器中恒温振荡,使吸附达平衡,静置分离,测定上清液中Pb2+离子的平衡浓度(以二甲酚橙溶液为指示剂,用乙二胺四乙酸(EDTA)络合滴定法测定溶液中Pb2+离子浓度),按公式(1)计算Pb2+离子的平衡吸附量Qe,绘制平衡吸附量(Qe)-平衡浓度(Ce)关系曲线,即吸附等温线.

式中,Qe为平衡吸附量(g·g-1);V为溶液体积(mL); C0为Pb2+离子溶液的初始浓度(mol·L-1);Ce为Pb2+离子平衡浓度(mol·L-1);m为IDAA-PGMA/SiO2微粒的质量(g),Pb原子摩尔质量207 g·mol-1.
2.3.2 考察不同因素对复合螯合微粒IDAA-PGMA/ SiO2吸附性能的影响
改变吸附介质的pH值,进行等温吸附实验,考察pH值对IDAA-PGMA/SiO2微粒吸附性能的影响,以探索吸附机理;在不同温度下进行IDA-PGMA/ SiO2微粒对Pb2+离子的吸附实验,考察温度对其吸附性能的影响,从而进行吸附热力学的研究;配制Pb2+、Cd2+及Ni2+等3种离子溶液,进行等温吸附实验(溶液中的Cd2+和Ni2+离子的浓度,分别以铬黑T及紫脲酸铵为指示剂,采用EDTA络合滴定法进行测定),考察IDAA-PGMA/SiO2微粒对不同重金属离子的吸附性能.
2.4 复合螯合微粒IDAA-PGMA/SiO2对稀土离子的等温吸附实验
配制浓度系列变化的钕离子(Nd3+)及钐离子(Sm3+)溶液,采用上述对重金属离子进行等温吸附的相同步骤,实施螯合微粒IDAA-PGMA/SiO2对稀土离子的等温吸附实验,绘制吸附等温线.
3 结果与讨论
3.1 复合螯合微粒IDAA-PGMA/SiO2的制备过程
先将带有双键的偶联剂MPS键合在硅胶表面,制得了改性微粒MPS-SiO2;然后采用逐步接枝方法,实现了甲基丙烯酸缩水甘油酯的接枝聚合,制得了接枝微粒PGMA/SiO2;然后通过亚氨二乙酸对接枝大分子PGMA链节中的环氧键进行开环反应,从而将IDAA基团键合于接枝微粒表面,制得了复合螯合微粒IDAA-PGMA/SiO2.制备该复合螯合微粒的化学过程如示意图1所示.
3.2 微粒IDAA-PGMA/SiO2对重金属及稀土离子的等温吸附行为
分别使用接枝微粒PGMA/SiO2与复合螯合微粒IDAA-PGMA/SiO2,在30°C及pH=5的条件下,对初浓度不同的Pb2+离子及稀土Nd3+离子溶液进行了吸附,图1为等温吸附曲线.
从图1可以看到,接枝微粒PGMA/SiO2对重金属Pb2+离子及稀土Nd3+离子基本不发生吸附,但是,通过亚氨二乙酸与接枝大分子PGMA环氧键之间的开环反应,将IDAA基团键合于接枝微粒表面后,微粒IDAA-PGMA/SiO2对Pb2+离子表现出很强的吸附能力,吸附模式是典型的Langmuir单分子层等温吸附模型,饱和吸附量高达0.235 g·g-1.微粒IDAAPGMA/SiO2对稀土Nd3+离子也表现出一定的吸附能力.亚氨二乙酸基团属三齿配位基团,对Pb2+离子会产生强的配位螯合作用,形成稳定的五元螯合环,从而产生强螯合吸附作用;而且由于接枝的PGMA大分子链上环氧基团的开环率为70%,因此在微粒IDAA-PGMA/SiO2表面,亚氨二乙酸基团的密度很高,导致对重金属离子Pb2+有很高的吸附容量.微粒IDAA-PGMA/SiO2对Pb2+离子螯合吸附的模式可能有多种,示意图2为典型的2种,同时也给出了对Nd3+离子螯合吸附的模式.
3.3 介质pH对IDAA-PGMA/SiO2吸附性能的影响及螯合吸附机理分析
改变介质的pH值,进行了IDAA-PGMA/SiO2对Pb2+离子的等温吸附,图2给出了不同pH条件下IDAA-PGMA/SiO2对Pb2+离子的等温吸附线.为了更清楚地显示介质pH值对吸附容量的影响,由图2中各等温吸附线上的饱和吸附量Qm对pH值作曲线,见图3.

示意图1 复合螯合微粒IDAA-PGMA/SiO2的制备过程Scheme 1 Reaction process for preparing composite chelating particle IDAA-PGMA/SiO2
从图2与图3可以发现,在pH<5的范围内,随着介质pH值的增大,IDAA-PGMA/SiO2对Pb2+离子的吸附容量在增大;pH=5时,吸附容量最大,达0.235 g·g-1;当pH超过5,吸附容量转而下降.键合在PGMA大分子链上的亚氨二乙酸基团,含有2个羧基和1个叔氨基团,在低pH值时,羧基电离度很小,而叔氨基团会被高度地质子化,使亚氨二乙酸基团显阳离子性;在较高pH值时,羧基电离度变大,叔氨基团质子化度减弱,使亚氨二乙酸基团显阴离子性.故在低pH值时,由于Pb2+被正电性所排斥,23,24微粒IDAA-PGMA/SiO2对Pb2+离子的螯合吸附能力很弱;随着pH增加,羧基电离度增大,在静电吸引作用下,大量Pb2+离子接近到微粒IDAA-PGMA/SiO2表面,继而被三齿配位基团螯合吸附,这样,静电相互作用与配位螯合作用的协同,导致随pH值的增大, IDAA-PGMA/SiO2对Pb2+离子的吸附容量增大.但是,重金属离子一般均易发生水解作用,当pH>5 (30°C)后,Pb2+离子会明显发生水解作用(Pb2+离子的一级水解常数K1=6.3×10-8),此时沉积在吸附剂表面的水解产物将会严重影响吸附性能,25导致IDAAPGMA/SiO2对Pb2+离子的吸附容量下降.IDAAPGMA/SiO2对Nd3+离子饱和吸附量Qm与pH值之间的关系曲线也示于图3,也显示出类似的规律,但由于稀土离子的抗水解性能比Pb2+离子要强,故吸附容量出现最大值时的pH值较高,pH=6.

图1 两种微粒对Pb2+及Nd3+离子的等温吸附线Fig.1 Adsorption isotherms of two particles for Pb2+and Nd3+ionsT=30°C;pH=5;Qe:equilibrium-adsorption;Ce:equilibriumconcentration; Pb2+-IDDA-PGMA/SiO2; Nd3+-IDDA-PGMA/SiO2; Pb2+-PGMA/SiO2; Nd3+-PGMA/SiO2

示意图2 IDAA-PGMA/SiO2对Pb2+及Nd3+离子螯合吸附的可能模式Scheme 2 Possible models of chelation adsorption of IDAA-PGMA/SiO2for Pb2+and Nd3+ions
另外,需要指出的是,在pH<7的酸性介质中,复合微粒IDAA-PGMA/SiO2的基质SiO2是很稳定的,而接枝聚合物PGMA也不会发生水解(其酯基的水解作用一般在强碱性条件下才能发生),故在上述pH值变化的条件下,复合微粒IDAA-PGMA/SiO2具有良好的化学稳定性.
3.4 IDAA-PGMA/SiO2对不同金属离子的吸附性能

图2 不同pH条件下IDAA-PGMA/SiO2对Pb2+离子等温吸附线Fig.2 Adsorption isotherm of IDAA-PGMA/SiO2for Pb2+ ion at different pH values of medium T=30°C
使用复合螯合吸附材料IDAA-PGMA/SiO2,分别对Pb2+、Cd2+、Ni2+等3种不同的重金属离子,以及Nd3+、Sm3+2种稀土离子进行了等温吸附,图4给出了等温吸附曲线(平衡吸附量单位用mmol·g-1表示).
由图4中得知,IDAA-PGMA/SiO2对3种重金属离子的吸附容量顺序为Pb2+>Cd2+≈Ni2+(对Cd2+与Ni2+的吸附容量很相近),显然,IDAA-PGMA/SiO2对Pb2+表现出优良的螯合吸附亲合性.同一种螯合吸附材料对不同重金属离子的吸附能力应该取决于金属离子的性质及它们价电子层轨道的构型.Pb与Cd两种金属的电负性顺序为Pb(1.6)>Cd(1.5),26,27IDAAPGMA/SiO2对两种重金属离子吸附容量的顺序Pb2+>Cd2+,显然与电负性顺序相一致,说明Pb2+离子在亚氨二乙酸型螯合材料表面的高吸附容量是由于Pb2+离子与微粒材料之间的强静电相互作用所导致的.26,27

图3 介质pH值对IDAA-PGMA/SiO2吸附性能的影响Fig.3 Effect of pH values on adsorption property of IDAA-PGMA/SiO2T=30°C;Qm:saturated adsorption capacity
图4中还显示,稀土离子Nd3+和Sm3+在IDAAPGMA/SiO2表面的吸附容量远小于重金属离子的吸附容量.镧系离子的价电子层轨道的构型是4fn5s25p6,4f电子被外层电子所遮挡,与外部配体轨道之间的作用力很弱,配键以离子性为主,所形成的配离子稳定性差,这就导致在相同螯合材料IDAAPGMA/SiO2表面,稀土离子表现出较差的被螯合吸附能力,导致较低的吸附容量;当然,稀土离子配位数较大(一般为6),螯合吸附所需的配基数目较多,这也是导致其在相同螯合材料表面吸附容量较低的原因之一.从图4中还可以看出,Nd3+和Sm3+2种稀土离子在IDAA-PGMA/SiO2表面的吸附容量几乎相同,这是由镧系离子物理化学性质很接近所导致的.
3.5 温度对IDAA-PGMA/SiO2吸附性能的影响及
吸附热力学
在不同温度下进行了IDAA-PGMA/SiO2对Pb2+离子的等温吸附(为确保Pb2+离子在较高温度下不发生水解,将介质的pH值调节为pH=4),图5给出了各温度下的等温吸附线.从图5看到,Pb2+离子的吸附容量随温度的升高而减小.
Langmuir等温吸附方程的直线形式为方程(2)

式中,Ce(mol·L-1)是平衡浓度,Qe(g·g-1)是平衡吸附量,Qm(g·g-1)是饱和吸附量,b是Langmuir吸附常数.显然,Ce/Qe对Ce作图应该为一条直线.严格地说,对于固-液(水溶液)之间的吸附,研究溶质在固体吸附剂上被吸附的同时,还应考虑溶剂(水)的吸附,此时,Langmuir吸附常数b与溶质在固体吸附剂上的吸附平衡常数K有如下关系式:5,28,29

图4 IDAA-PGMA/SiO2对不同金属离子等温吸附线Fig.4 Adsorption isotherms of IDAA-PGMA/SiO2for different metal ionsT=30°C;pH=5

图5 不同温度下IDAA-PGMA/SiO2对Pb2+离子等温吸附线Fig.5 Adsorption isotherms of IDAA-PGMA/SiO2forPb2+ion at different temperaturespH=4

式中,M与ρ分别是溶剂水的摩尔质量与密度.按方程(2)作各温度下的直线,如图6所示,各直线线性关系良好.由直线的斜率与截距分别求出各温度下的兰格缪尔吸附常数b,再由(3)式求得各温度的吸附平衡常数K.
如方程(4)所示的Van′t Hoff方程,表示出了温度与吸附平衡常数K之间的关系,5以lnK对1/T作直线(图7),由直线斜率可求得吸附焓ΔH.

再由方程(5)与(6)所示的热力学关系式求取吸附过程的吉布斯自由能ΔG与熵变ΔS,3,5吸附过程中的各热力学数据一并列于表1(上述诸方程中的R为摩尔气体常数).

图6 不同温度下的直线化Langmuir吸附等温线Fig.6 Linearized Langmuir isotherm plots at different temperatures

图7 lnK对1/T的关系曲线(Pb2+离子体系)Fig.7 Relationship curve between lnK and 1/T(Pb2+ion system)

表1数据显示:(1)复合螯合吸附材料IDAAPGMA/SiO2对Pb2+离子的螯合吸附过程中,吉布斯自由能ΔG小于零,表明吸附为一自发过程;(2)吸附焓ΔH小于零,表明吸附过程为放热过程(导致图5中Pb2+离子的吸附容量随温度升高而减小);(3)熵变ΔS大于零,显示吸附为熵增大的过程;(4)|ΔH|>|TΔS|,表明IDAA-PGMA/SiO2对重金属离子的吸附是焓驱动的过程.
关于上述螯合吸附过程中ΔS>0,可作如下解释:在未发生吸附的Pb2+离子溶液中,每个Pb2+离子均以水合离子的形式存在,当Pb2+离子与IDAAPGMA/SiO2表面的亚氨二乙酸基团发生配位螯合后,水合离子中的水分子被取代,且以自由分子的形式被释放出来,显然,体系中的质点数目大大增加,导致体系的熵值增大.在水溶液中发生螯合吸附时,往往可出现此结果.
关于上述螯合吸附过程中ΔH<0,可作如下解释:亚氨二乙酸型螯合材料对水溶液中的金属离子发生螯合吸附时,往往会发生放热现象,这是由于螯合过程与离子交换过程竞争且前者占主导作用所导致的.3,30亚氨二乙酸基团中含有羧基氢离子,水溶液中的金属离子被亚氨二乙酸型螯合材料吸附时,离子交换过程与螯合过程同时发生,当螯合作用占优势时,宏观上即表现出放热现象.3,30

表1 IDAA-PGMA/SiO2对Pb2+离子吸附的热力学数据Table 1 Thermodynamic data for adsorption of Pb2+ions on IDAA-PGMA/SiO2particles
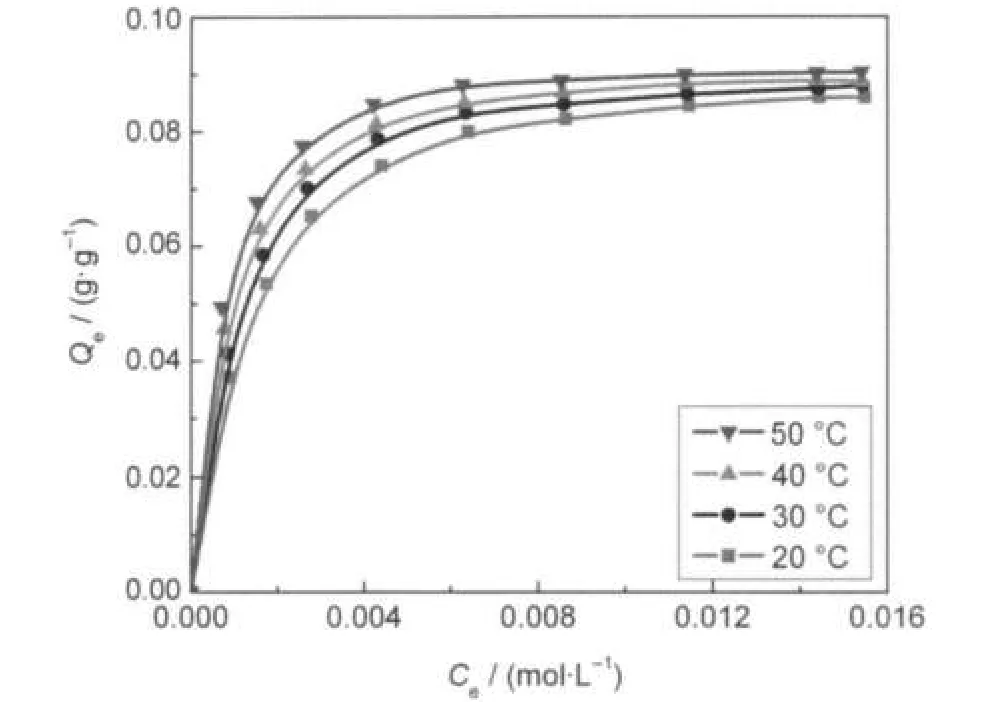
图8 不同温度下IDAA-PGMA/SiO2对Nd3+离子等温吸附线Fig.8 Adsorption isotherm of IDAA-PGMA/SiO2for Nd3+ ions at different temperaturespH=4.5
在不同温度下也进行了IDAA-PGMA/SiO2对稀土Nd3+离子的等温吸附,图8给出了各温度下的等温吸附线,图9给出了lnK对1/T的关系曲线.从两图中看到,Nd3+离子的吸附容量和吸附平衡常数随温度的升高而增大.
采用与Pb2+离子体系相同的数据处理方法,得到Nd3+离子体系的吸附热力学数据,列于表2.

图9 lnK对1/T的关系曲线(Nd3+离子体系)Fig.9 Relationship curve between lnK and 1/T(Nd3+ion system)
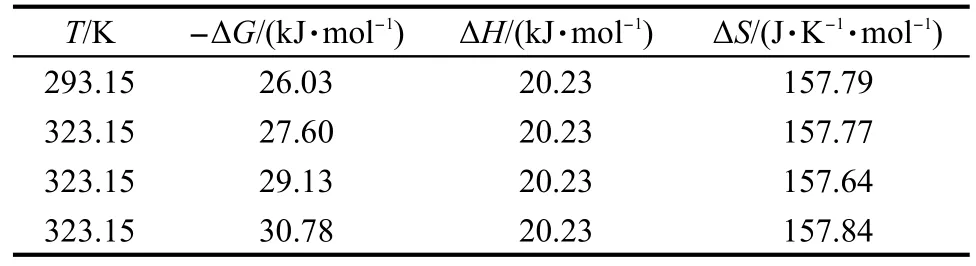
表2 IDAA-PGMA/SiO2对Nd3+离子吸附的热力学数据Table 2 Thermodynamic data for adsorption of Nd3+ions on IDAA-PGMA/SiO2particles
表2数据显示:(1)复合螯合吸附材料IDAAPGMA/SiO2对稀土Nd3+离子的螯合吸附过程中,吉布斯自由能ΔG小于零,表明吸附亦为一自发过程; (2)吸附焓ΔH大于零,表明吸附过程为吸热过程(导致图8中Nd3+离子的吸附容量随温度升高而增大); (3)熵变ΔS大于零,显示吸附亦为熵增大的过程,其原因与Pb2+离子螯合吸附体系相同.不过,由于水合稀土离子所含水分子较多(一般含6个水合分子),稀土离子被螯合吸附时释放出的自由水分子数目更多,故吸附熵变ΔS的数值比Pb2+离子体系要大很多; (4)ΔH>0,ΔS>0,且ΔH<|TΔS|,表明IDAA-PGMA/ SiO2对稀土离子的吸附是熵驱动的过程.
另外,需要指出的是,由于基质SiO2具有优良的热稳定性,而接枝聚合物PGMA的玻璃化转变温度为72°C,故在上述温度的变化范围内,复合微粒IDAAPGMA/SiO2具有良好的热稳定性.因此,可以预期,复合螯合微粒材料IDAA-PGMA/SiO2良好的化学与热稳定性将赋予该材料具有优良的再生与再循环使用性能.
4 结论
将甲基丙烯酸缩水甘油酯接枝在硅胶微粒表面,然后使亚氨二乙酸对接枝大分子链上的环氧基团进行开环反应,成功地制备了亚氨二乙酸型复合螯合吸附材料IDAA-PGMA/SiO2.该功能微粒材料含有高密度的亚氨二乙酸基团,且将亚氨二乙酸基团的强螯合功能与硅胶微粒的优良物理化学性能相结合,预期将是一种具有重要应用价值的复合型螯合吸附材料.通过静电相互作用与配位螯合作用的协同,IDAA-PGMA/SiO2对Pb2+等重金属离子发生强吸附作用,螯合物具有稳定的五元环结构.IDAAPGMA/SiO2对重金属离子的吸附为焓驱动的吸附过程,升高温度,吸附容量降低;IDAA-PGMA/SiO2对稀土离子的吸附过程为熵驱动的吸附过程. IDAA-PGMA/SiO2对重金属离子的吸附容量远比对稀土离子的吸附容量高.
1 Kumar,G.P.;Kumar,P.A.;Chakraborty,S.;Ray,M.Sep.Purif. Technol.2007,57,47.
2 Sun,S.L.;Wang,A.Q.Sep.Purif.Technol.2006,49,197.
3 Dinu,M.V.;Dragan,E.S.React.Funct.Polym.2008,68,1346.
4 Özcan,A.S.;Gök,Ö.;Özcan,A.J.Hazard.Mater.2009,161, 499.
5 Cestari,A.R.;Vieira,E.F.S.;Mattos,C.R.S.J.Chem. Thermodyn.2006,38,1092.
6 Sun,S.G.;Wang,A.Q.J.Hazard.Mater.2006,131,103.
7 Sirola,K.;Laatikainen,M.;Lahtinen,M.;Paatero,E.Sep.Purif. Technol.2008,64,88.
8 Atia,A.A.;Donia,A.M.;Yousif,A.M.Sep.Purif.Technol. 2008,61,348.
9 Atia,A.A.;Donia,A.M.;Elwakeel,K.Z.Sep.Purif.Technol. 2005,43,43.
10 Busche,B.;Wiacek,R.;Davidson,J.;Koonsiripaiboon,V.; Yantasee,W.;Addleman,R.S.;Fryxell,G.E.Inorg.Chem. Commun.2009,12,312.
11 Chang,T.C.;Shih,C.C.;Yin,C.P.;Chen,H.B.;Wu,T.R. Polym.Degrad.Stab.2005,87,87.
12 Hubicka,H.;Kołodyńska,D.J.Rare Earths 2008,26,619.
13 Barron,L.;O′Toole,M.;Diamond,D.;Nesterenko,P.N.;Paull, B.J.Chromatogr.A 2008,1213,31.
14 Pons,C.;Forteza,R.;Cerdà,V.Anal.Chim.Acta 2005,197.
15 Lin,L.C.;Li,J.K.;Juang,R.S.Desalination 2008,225,249.
16 Oshita,K.;Sabarudin,A.;Takayanagi,T.;Oshima,M.; Motomizu,S.Talanta 2009,79,1013.
17 Ma,Z.Y.;Liu,X.Q.;Guan,Y.P.;Liu,H.Z.Colloids Surf.A 2006,87.
18 Wu,X.M.;Wang,Y.Chin.Chem.Lett.2010,21,51.
19 Zainol,Z.;Nicol,M.J.Hydrometallurgy 2009,96,283.
20 Lin,L.C.;Juang,R.S.Chem.Eng.J.2007,132,205.
21 Jiang,G.M.;Gao,B.J.;Zhang,R.X.J.Func.Poly.2010,23, 256.[姜桂明,高保娇,张瑞霞.功能高分子学报,2010,23, 256.]
22 Sun,M.;Qiu,H.D.;Wang,L.C.;Jiang,S.X.J.Chromatogr.A 2009,1216,3904.
23 Chen,C.Y.;Chiang,C.L.;Huang,P.C.Sep.Purif.Technol. 2006,50,15.
24 El-Shahat,M.F.;Moawed,E.A.;Burham,N.J.Hazard.Mater. 2008,160,629.
25 Anirudhan,T.S.;Ramachandran,M.Ind.Eng.Chem.Res.2008, 47,6175.
26 Ling,P.P.;Liu,F.Q.;Li,L.J.;Jing,X.S.;Yin,B.R.;Chen,K. B.;Li,A.M.Talanta 2010,81,424.
27 Christophi,C.A.;Axe,L.J.Environ.Eng.2000,126,66.
28 Airoldi,C.;Alcântara,Edésio F.C.J.Chem.Thermodyn.1995, 27,623.
29 Anjos,F.S.C.;Vieira,E.F.S.;Cestari,A.R.J.Colloid Interface Sci.2002,253,243.
30 Baraka,A.;Hall,P.J.;Heslop,M.J.React.Funct.Polym.2007, 67,585.
December 31,2010;Revised:February 3,2011;Published on Web:April 15,2011.
Adsorption Behavior and Thermodynamics of Iminodiacetic Acid-Type Material IDAA-PGMA/SiO2for Heavy Metal Ions and Rare Earth Ions
JIANG Gui-Ming GAO Bao-Jiao*XU Wen-Mei WANG Xiao-Hua
(Department of Chemical Engineering,North University of China,Taiyuan 030051,P.R.China)
Glycidyl methacrylate(GMA)was grafted onto micron-sized silica gel particles and the grafted particles of PGMA/SiO2were obtained.Subsequently,a ring-opening reaction of the epoxy groups on the grafted PGMA was carried out using iminodiacetic acid(IDAA)as a reagent,which resulted in IDAA group bonding and in the preparation of the composite chelating particles IDAA-PGMA/SiO2.In this work,the adsorption behavior and adsorption thermodynamics of IDAA-PGMA/SiO2toward heavy metal ions and rare earth ions were investigated,and the adsorption mechanism was investigated in depth.The experimental results show that the particles IDAA-PGMA/SiO2possess strong adsorption action for heavy metal ions and the adsorption capacity of the Pb2+ions reached 0.235 g·g-1.The adsorption of heavy metal ions on IDAA-PGMA/SiO2is exothermic and is driven by enthalpy,leading to a decrease in the adsorption capacity as temperature is raised.The adsorption of rare earth ions on IDAA-PGMA/SiO2is driven by entropy.The adsorption ability of IDAA-PGMA/SiO2toward heavy ions is much stronger than that toward the rare earth ions.
Iminodiacetic acid;Glycidyl methacrylate;Chelating action;Heavy metal ion; Rare earth ion
O648;O631
*Corresponding author.Email:gaobaojiao@126.com;Tel:+86-351-3924795.
The project was supported by the Natural Science Foundation of Shanxi Province,China(201002100843).
山西省自然科学基金(201002100843)资助项目

