超滤技术分离双低油菜ACE抑制肽及其性能研究
田万敏 马海乐 骆 琳 贾俊强 刘 斌 何荣海
超滤技术分离双低油菜ACE抑制肽及其性能研究
田万敏 马海乐 骆 琳 贾俊强 刘 斌 何荣海
(江苏大学食品与生物工程学院,镇江 212013)
采用超滤技术对双低油菜酶解物中的ACE抑制肽进行了分离提纯研究,考核了分离参数对分离效果的影响,分析了不同分子质量段多肽HPLC肽谱的变化,研究了双低油菜高ACE抑制活性多肽的耐消化性、酸碱稳定性和耐热性。结果表明,超滤分离能明显提高双低油菜ACE抑制肽的活性,截留分子质量为3 ku的超滤膜透过液IC50值下降了15%,活性多肽回收率超过58%,酶解物中有4个高活性的组分峰,小于3 ku分子质量段的ACE抑制肽有良好的耐热性、酸碱稳定性和耐消化性。
双低油菜籽 ACE抑制肽 超滤 半抑制浓度 性能
高血压是当今世界五大常见疾病之一,抑制血管紧张素转换酶(ACE)的活性是治疗高血压的重要途径[1]。油菜是重要的油料作物之一,我国油菜和菜籽饼粕产量均居世界首位。双低油菜籽粕中芥酸和硫代葡萄糖苷的含量均较低,具有作为食品资源开发利用的价值。但是目前绝大多数菜籽粕仅作为饲料使用。双低油菜籽粕可以通过酶解反应被应用于制备ACE抑制肽[2]。就多肽的制备而言,酶解物的生物活性与其分子质量大小有密切的关系。超滤技术是进行蛋白酶解物中多肽分离纯化简单而有效的手段[3]。因此进行双低油菜籽粕酶解物的超滤技术研究,并对超滤产物的热稳定性、耐酸碱性和抗肠道酶解能力等稳定性特征进行研究,为双低油菜ACE抑制肽的开发利用提供理论和技术参考。
1 材料与方法
1.1 材料与仪器
1.1.1 主要材料
双低油菜籽饼粕:湖北老河口回天油脂有限公司;截留分子质量为5 ku和3 ku的Pellicon系列纤维素平板膜,有效膜面积0.5 m2:Millipore公司;胃蛋白酶、胰蛋白酶:Amresco公司;马尿酰组氨酰亮氨酸(Hip-his-leu,HHL):Sigma公司;碱性蛋白酶(酶活40万单位/g):无锡雪梅酶制剂有限公司;液相色谱所用试剂为色谱纯,其他试剂均为国产分析纯。1.1.2 主要仪器
超声处理系统:自制;Pellicon小型超滤系统:美国Millipore公司;蠕动泵:常州市诚和卫生设备厂;HH型恒温水浴锅:江苏金坛市中大仪器厂;Avanti TMJ-25型高速冷冻离心机:美国Backman有限公司;LC-20AT高效液相色谱系统:日本岛津。
1.2 方法
1.2.1 双低油菜ACE抑制肽的酶法制备
双低油菜ACE抑制肽的制备按照本课题组已经确立的条件进行。双低油菜籽饼粕蛋白经超声(料液质量分数5%、温度20℃、超声功率600 W/15 L)预处理40 min,用碱性蛋白酶进行酶解,酶解参数为:pH 9.0、温度50℃、底物质量分数5%、加酶量(E/S)5%、酶解时间30 min。酶解完成后,沸水浴中灭酶10 min,经3 500 r/min离心10 min收集上清液,喷雾干燥后备用。
1.2.2 超滤分离
称取100 g喷雾干燥后产品,配成3%的多肽液,先经过双层滤纸(Φ9 cm)布氏抽滤,然后顺序透过截流分子质量为5 ku(第1级超滤)和3 ku(第2级超滤)的平板膜,分别得到分子质量在5 ku以上、3~5 ku和3 ku以下的产物。以膜通量为指标,考核压力、多肽液温度和浓度等参数对分离效果的影响。压力由进料蠕动泵流速控制,多肽液温度由水浴锅控制。
超滤过程的特性指标主要是膜通量(Jv),即单位时间内通过单位膜面积滤过液的体积,计算如下:

式中:Ac为活性回收率/%;Mo为分离后组分的质量/mg;Ro为分离后组分的IC50值/mg/mL;Mi为原料的质量/mg;Ri为原料的IC50值/mg/mL。
1.2.3 双低油菜ACE抑制肽的HPLC肽谱分析
蛋白质或多肽在高效液相色谱(HPLC)或高效毛细管电泳(HPCE)上分离所得到的谱图即为肽谱。这一方法常用于蛋白质或多肽的鉴定以及突变点的检测。高效液相色谱测定条件为:ZORBAX-C18柱(4.6×250 mm,填料粒径5 μm)、柱温28 ℃、检测波长220 nm、进样量 10μL、洗脱液超纯水 -乙腈(80%∶20%,各含0.5‰三氟乙酸)、流速 1 mL/min、洗脱时间25 min。
1.2.4 ACE抑制活性与半抑制浓度(IC50)的测定
IC50指抑制50%的ACE活性所需抑制剂的浓度[4],是表征ACE抑制肽体外降血压活性的主要指标,IC50的测定依据吴琼英等[5]的方法,采用高效液相色谱进行检测。
1.2.5 双低油菜ACE抑制肽的体外消化试验
参考陈季旺等[6]的方法进行双低油菜ACE抑制肽的体外消化试验,具体操作:取超滤后活性最强的双低油菜ACE抑制肽配制成一定浓度的溶液,取定量样测定ACE抑制率。将溶液调节至pH 2.0后,加入2%(E/S)的胃蛋白酶,在37℃条件下保温4 h,在沸水中保持10 min,使胃蛋白酶钝化失活,将溶液调节至pH 8.1,取定量样测定ACE抑制率。将剩余溶液加入2%(E/S)的胰蛋白酶,在37℃条件下保温4 h,在沸水中保持10 min,使胰蛋白酶钝化失活,取定量样测定ACE抑制率。
1.2.6 双低油菜ACE抑制肽的酸、碱稳定性试验
将超滤后活性最好的组分溶液pH分别调节至2.0、7.0、9.0、11.0,然后在 37 ℃保温 0.5、1.0、1.5、2.0、3.0 h,测定其 ACE 抑制活性。
1.2.7 双低油菜ACE抑制肽的热稳定性试验
将超滤后活性最好的组分溶液调节至pH 7.0,分别在37、50、70、90 ℃处理 0.5、1.0、1.5、2.0、3.0 h,测定其ACE抑制活性。

式中:V为滤过液的体积/mL;A为膜的面积/m2;t为超滤时间/min。
超滤后各分子质量段组分活性回收率的计算公式如下:
2 结果与分析
2.1 压力对超滤膜通量的影响
在多肽液质量浓度为3 mg/mL、第1级超滤温度为45℃、第2级超滤温度为35℃的条件下,不同操作压力对超滤膜通量的影响如图1所示。

图1 操作压力对膜通量的影响
从图1中可以看出,随着操作压力的增加,2种截留膜的通量开始都逐渐增大。对于截留分子质量为5 ku的膜,压力在0.1~0.5 kg/cm2范围内,膜通量随着操作压力升高几乎呈直线上升,压力进一步增加至0.7 kg/cm2时,膜通量增加趋于平缓。这主要是多肽液中的大分子溶质在膜表面吸附积聚达到饱和浓度形成凝胶层和浓差极化快速增加[7],导致有效的传质推动力下降,因此膜通量增长速率降低。对于截留分子质量为3 ku的膜,压力在0.1~0.7 kg/cm2范围内,膜通量随着操作压力升高几乎呈线性上升,压力进一步增加至0.9 kg/cm2时,膜通量增加不显著,这主要是第1级超滤后,大分子溶质被截留下来,减少了凝胶层的厚度,因此第2级超滤压力可以相应增加。但是操作压力过大时,除了增加能耗外,超滤过程也加重了膜的污染。因此选择截留分子质量5 ku的膜的操作压力以0.5 kg/cm2为宜,选择截留分子质量3 ku的膜的操作压力以0.7 kg/cm2为宜。
2.2 温度对超滤膜通量的影响
在多肽液质量浓度为3 mg/mL、第1级超滤压力0.5 kg/cm2、第 2 级超滤压力 0.7 kg/cm2的情况下,不同多肽液温度对超滤膜通量的影响如图2所示。随着温度的升高,2张膜的通量均增加,这主要是由于温度升高,分子热运动加强,物料黏度下降,溶质的扩散系数增大,有利于减轻膜表面的浓差极化影响,传质系数增大,因此膜通量增加。对于截留分子质量为5 ku的膜,当温度增加到45℃时,膜通量增加缓慢,与55℃的膜通量相比差别不大。对于截留分子质量为3 ku的膜,当温度增加到35℃时,膜通量增加缓慢,与45℃的膜通量相比差别不大,虽然从45℃增加到55℃的过程中膜通量上升速率较快,但是过高的温度不仅增加能耗而且还会损伤超滤膜及其壳体。从节约能源角度考虑,选择截留分子质量5 ku的膜的料液温度以45℃为宜,选择截留分子质量3 ku的膜的料液温度以35℃为宜。
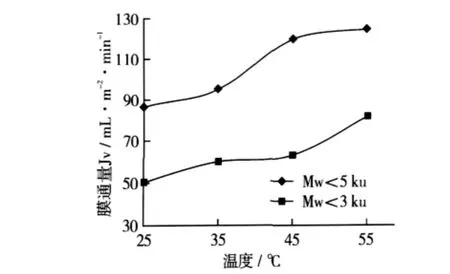
图2 多肽液温度对膜通量的影响
2.3 多肽液浓度对超滤膜通量的影响
在第1级超滤压力为0.5 kg/cm2、多肽液温度为45℃,第2级超滤压力为0.7 kg/cm2、多肽液温度为35℃的条件下,不同多肽液浓度对超滤膜通量的影响如图3所示。随着多肽液浓度的升高,两张膜的通量均降低,这主要是由于多肽是两性化合物,有很强的表面活性,极易吸附在聚合物表面。多肽液溶质浓度越大,黏度越大,扩散系数小,且极容易形成凝胶层,减少膜通量的同时也增加了污染程度。对于截留分子质量为5 ku的膜,当多肽液质量浓度达到3 mg/mL时,再增加多肽液浓度,膜通量急速下降。对于截留分子质量为3 ku的膜,当多肽液质量浓度从1 mg/mL增加3 mg/mL时,膜通量下降速率较大,之后再增加多肽液浓度膜通量下降速率减缓。考虑到生产工艺的合理性和经济生产可行性,选取3%多肽液作为第1级和第2级超滤时溶液的基本浓度比较合适。
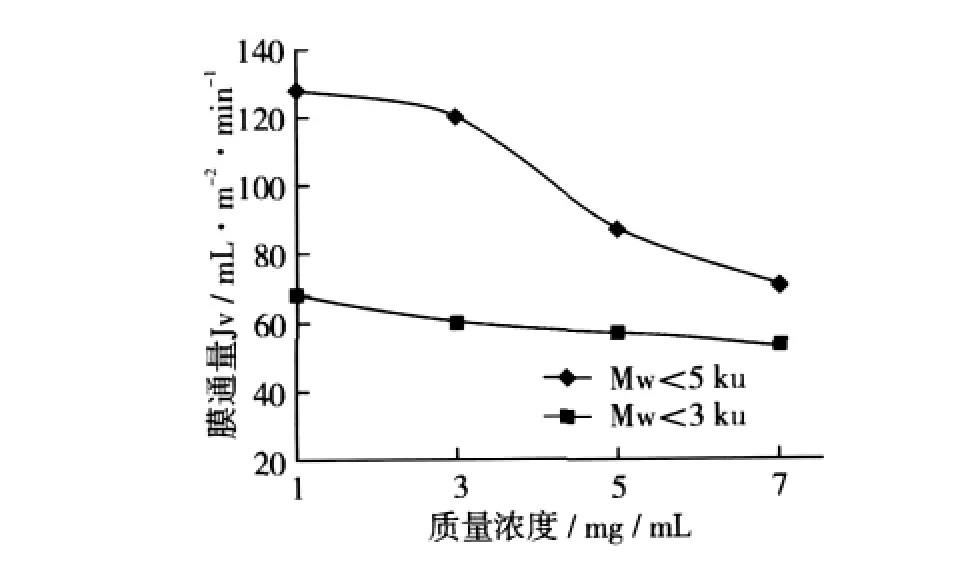
图3 多肽液浓度对膜通量的影响
2.4 超滤后各分子质量段多肽的回收率及其活性
超滤后各分子质量肽段的回收率和IC50值见表1,活性肽总回收率合计为76.44%,其余23.56%主要因超滤操作中管道料液残存所致。从表1中可见,随着截留分子质量的减小,超滤物的ACE抑制活性逐渐增高,高活性肽分子质量主要集中在3 ku以下,IC50值从母液的2.0 mg/mL 下降到 1.72 mg/mL,活性肽回收率也高达58.4%。其他研究结果也表明ACE抑制肽主要是一些小分子的多肽[8]。

表1 不同分子质量段活性肽的回收率及IC50值
2.5 超滤后各分子质量段多肽的肽谱
双低油菜ACE抑制肽经截留分子质量为5 ku和3 ku的膜过滤后所得的各分子质量段的ACE抑制肽的肽谱如图4所示。超滤前双低油菜ACE抑制肽主要有4个组分峰,其保留时间分别为2.0、3.0、5.0、6.0 min。经过5 ku 的膜过滤后,分子质量大于5 ku的ACE抑制肽在2.0、3.0 min出的组分峰面积下降很多,5.0、6.0 min出的组分峰几乎消失。经过3 ku的膜过滤后,分子质量在3~5 ku以及小于3 ku的ACE抑制肽在2.0、3.0 min出的组分峰面积明显高于未过膜的ACE抑制肽,5.0、6.0 min出的组分峰相对于未过膜的ACE抑制肽峰面积有所增加。从肽谱可以直观地看出,经过2个分子质量截留膜过滤后各分子质量ACE抑制肽的组分有了显著地变化,且有效的活性组分应该在这4个组分峰里。

图4 超滤后各分子质量双低油菜ACE抑制肽的高效液相色谱
2.6 双低油菜ACE抑制肽的体外消化试验
分子质量小于3 ku的双低油菜ACE抑制肽与胃蛋白酶、胰蛋白酶等肠道酶作用后产物对ACE的抑制活性效果如图5所示。双低油菜ACE抑制肽与胃蛋白酶作用后其对ACE抑制率略微升高,说明双低油菜ACE抑制肽在胃蛋白酶作用下,有可能水解液中原来对ACE具有抑制活性效果的活性组分,或者是一些原来对ACE没有抑制效果的长分子肽链与胃蛋白酶反应后产生了活性更高、新的ACE抑制肽。
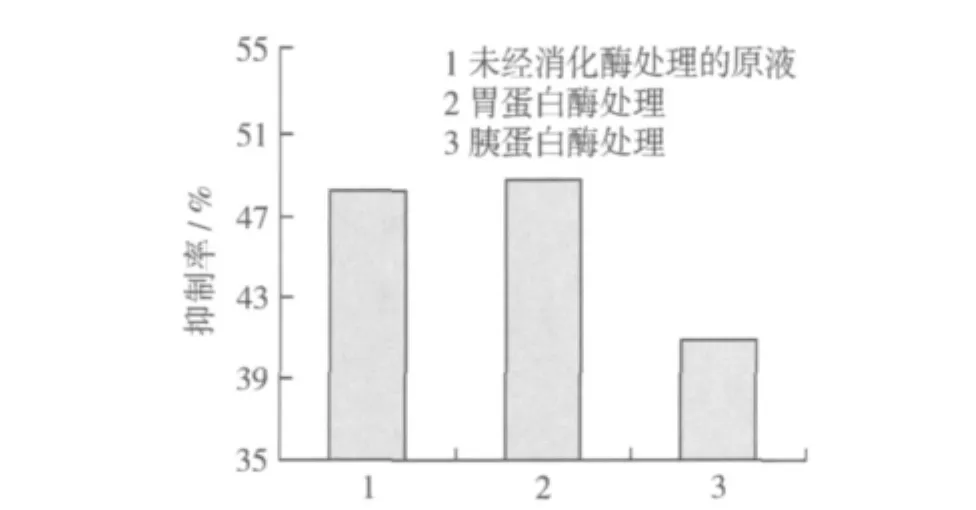
图5 肠道酶降解双低油菜ACE抑制肽对ACE的抑制效果
胃蛋白酶作用后的产物与胰蛋白酶作用后,产物被进一步降解,其对ACE抑制率下降较多,说明双低油菜ACE抑制肽虽能抵抗胃蛋白酶的降解,但其中较多活性组分却不能抵抗胰蛋白酶的降解作用,从而导致产物对ACE的抑制活性有所下降,但即便如此,其对ACE抑制率仍能保持未消化前的84.48%,说明对双低油菜ACE抑制肽具有良好的抗肠道消化的能力,经口服后很可能继续保持降血压作用。
双低油菜ACE抑制肽经消化酶降解后的肽谱见图6。双低油菜ACE抑制肽经胃蛋白酶作用后的HPLC谱图与原液相比,3.0 min时出峰,其峰高、峰面积明显降低,再经胰蛋白酶作用后该峰的峰高、峰面积进一步降低,且经胰蛋白酶消化后,未经消化酶作用的原液在5.0~6.0 min之间的2个小峰消失,并出现1个峰面积较大的峰,这谱图的变化也可以说明胃蛋白酶、胰蛋白酶等肠道消化酶对双低油菜ACE抑制肽的降血压活性有一定的消解作用。
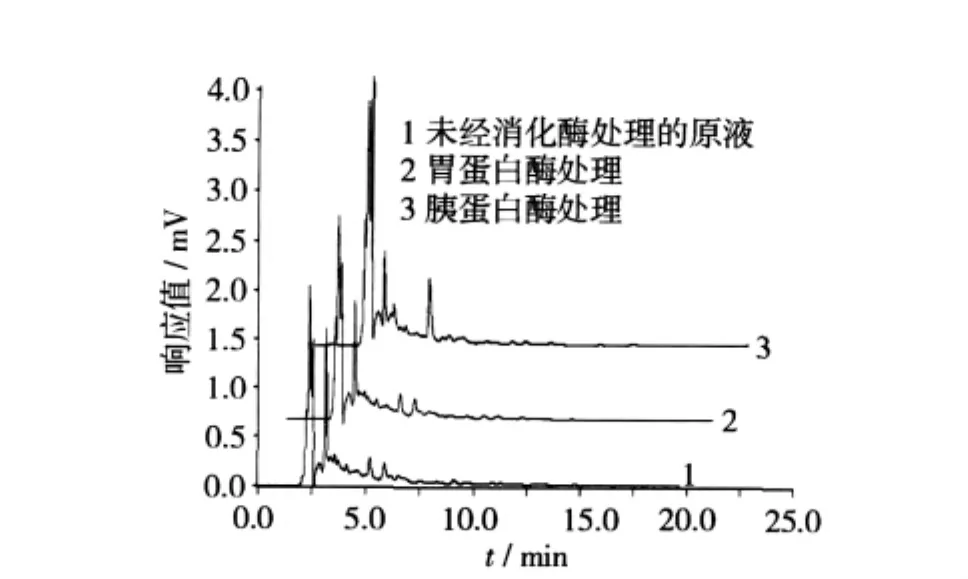
图6 肠道酶消化后双低油菜ACE抑制肽的高效液相色谱
2.7 pH对双低油菜ACE抑制肽活性影响
取分子质量小于3 ku的双低油菜ACE抑制肽进行耐酸碱试验,pH对双低油菜ACE抑制肽活性影响如图7所示。当pH为2.0时,双低油菜ACE抑制肽的ACE抑制率随着时间的延长显著下降,3 h时下降为初始时的69.37%。当pH为7.0时,双低油菜ACE抑制肽活性随着时间的延长几乎不变,3 h时保留有初始96.28%的活性;当pH分别为9.0和11.0时,活性损失不多,在保留3 h后,ACE抑制活性分别保留有初始值的90.15%和83.13%。由此可以看出,双低油菜ACE抑制肽具有良好的酸碱稳定性,在中性条件下保存或者使用时活性稳定。这一结果与丁青芝等[9]在研究米糠蛋白质酶解产物的酸碱性试验中的发现基本一致。
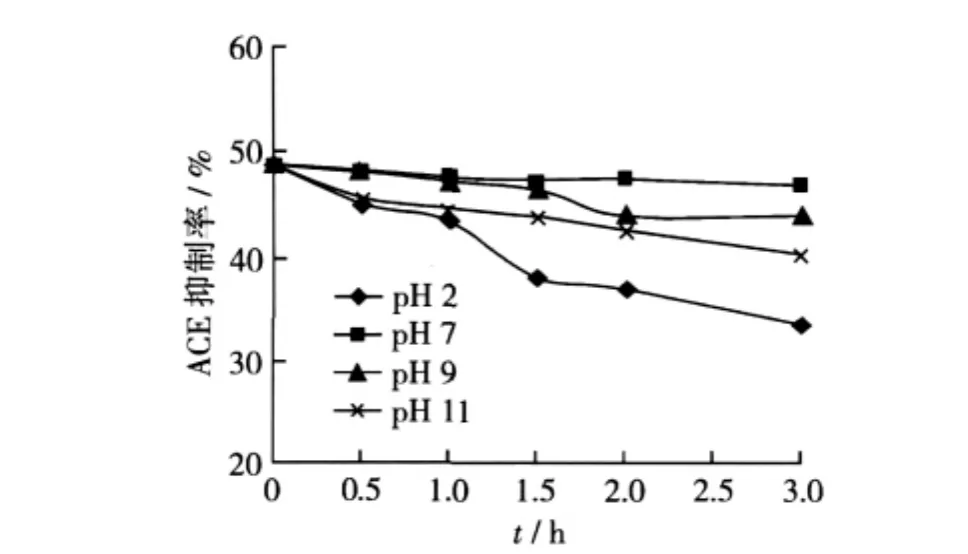
图7 pH对双低油菜ACE抑制肽活性影响
2.8 不同温度对双低油菜ACE抑制肽活性影响
取分子质量小于3 ku的双低油菜ACE抑制肽进行保温试验,不同温度对双低油菜ACE抑制肽活性影响如图8所示。

图8 温度对双低油菜ACE抑制肽活性影响
从图8可以看出,当保存温度为37℃时,在整个保存过程中,双低油菜ACE抑制肽的活性随着时间的延长几乎保持不变,在3 h时ACE抑制活性还保留有初始时的96.85%;当保存温度为50~90℃时,双低油菜ACE抑制肽的活性随着时间的延长逐渐下降,3 h时ACE抑制活性保留有初始时的84.58% ~75.54%。结果表明:双低油菜ACE抑制肽具有良好的热稳定性,在实际生产中能满足高温杀菌等工艺要求,在常温下保存或者使用时活性稳定。这一结果与I-Chuan Sheih等[10]在研究水藻废物蛋白酶解产物的热稳定性试验的发现基本一致。
3 结论
3.1 对于截留分子质量为5 ku的第一级超滤分离而言,操作压力为0.5 kg/cm2、多肽液温度为45℃、多肽液质量浓度为3 mg/mL时具有较高的膜通量;对于截留分子质量为3 ku的第二级超滤分离,操作压力为0.7 kg/cm2、多肽液温度为35℃、多肽液质量浓度为3 mg/mL时具有较好的膜通量。
3.2 双低油菜酶解物中高ACE抑制活性多肽的分子质量主要集中在3 ku以下,IC50值为1.72 mg/mL。
3.3 双低油菜ACE抑制肽具有较好的抗胃肠道酶解性,经肠道模拟消化后,其ACE抑制活性保留初始时的84.48%以上。
3.4 双低油菜ACE抑制肽具有良好的热稳定性及酸碱稳定性,极端条件如高温,强酸性和强碱性条件下保留3 h时,其ACE抑制活性保留值在初始时的75.54%以上。
[1]尹雪艳,侯红艳.ACEI在心血管疾病领域的应用[J].医学综述,2003,9(7):413 -414
[2]Ewa D Marczak,Hachiro Usui,Hiroyuki Fujita,et al.New antihypertensive peptides isolated from rapeseed[J].Peptides,2003,24:791 -798
[3]张绵松,孟秀梅,袁文鹏,等.海蜇血管紧张素转化酶抑制肽的超滤分离[J].食品与药品,2010,12(1):20-23
[4]Roy M K,Watanabe Y,Tamai Y.Yeast protease B - digestd skim milk inhibits angiotensin - I- enzyme activity[J].Biotechnol Appl Biochem,2000,31:95 -100
[5]吴琼英,马海乐,骆琳,等.高效液相色谱法测定血管紧张素转化酶抑制剂的活性[J].色谱,2005,23(1):79-81
[6]陈季旺,孙勤,夏文水,等.鱼降压肽的大孔吸附树脂分离及其活性稳定性[J].食品科学,2009,30(18):25 -28
[7]梁国明,陆晓峰,陈仕意,等.操作条件对膜污染及蛋白质超滤滤出速度影响的研究[J].净化技术,1999,67(1):7-10
[8]Mullally M M,Meisel H,Fitz- Gerald R J.Angiotensin leonverting enzyme inhibitory Activities of gastrie and panereatie proteinase digests of whey protein[J].Int Dairy J1997,7:299 -303
[9]丁青芝,马海乐,骆琳,等.米糠蛋白ACEI活性肽的超滤分离及其稳定性研究[J].食品研究与开发,2008,29(9):48-51
[10]I- Chuan Sheih,Tony J Fang,Tung - kung Wu.Isolation and characterization of a novel angiotensin I-converting enzyme(ACE)inhibitory peptide from the algae protein waste[J].Food Chemistry,2009,115:279 -284.
Study on Purification of Angiotensin Converting Enzyme Inhibitory Peptides from Double-low Rapeseed by Ultrafiltration and its Properties
Tian Wanmin Ma Haile Luo Lin Jia Junqiang Liu Bin He Ronghai
(School of Food and Biological Engineering,Jiangsu University,Zhenjiang 212013)
The ultrafiltration Tech-nology was adopted for the separation of angiotensin converting enzyme inhibitory peptides from double-low rapeseed hydrolysate and the influence of separation parameters on the purification effect was investigated.The change of the peptide mapping of different molecular weight peptides was analyzed and the properties of digestion resistance,heat resistance and pH stability of the higher activity peptides from double- low rapeseed were studied as well.The results showed that the ultrafiltration could raise the activity of the ACE inhibitory peptides from double-low rapeseed markedly,the IC50value of permeate liquid of 3 ku membrane was decreased by 15%,the recovery rate of active peptides reached more than 58%,there were four high activity component peaks in the hydrolysate,the ACE inhibitory peptides with molecular weight lower than 3 ku retained activity under various temperature and pH treatments,and showed resistance to in vitro digestion.
double - low rapeseed,ACE inhibitory peptides,ultrafiltration,IC50,properties
TS201.2
A
1003-0174(2011)09-0087-05
江苏省科技成果转化专项资金(BA2008100)
2010-10-12
田万敏,男,1985年出生,硕士,食品生物技术
马海乐,男,1963年出生,博士,教授,博士生导师,食品生物技术

