环磷酰胺LDM联合MTD化疗对乳腺癌抗血管作用的实验研究
陈 伶 邓金昆 刘 星 史莉莉 李 丽
乳腺癌是女性常见的恶性肿瘤,也是典型的血管依赖性疾病,其发生、发展、生长、转移等均与血管生成密切相关。因此,将血管作为乳腺癌治疗的靶点成为研究热点,抗血管药物也陆续被研发。近几年研究显示,一些化疗药物在低浓度剂量下具有抗血管生成作用,提高抗癌效果且不良反应小,不易产生耐药,将这种给药方式称为低剂量节律化疗(low-dose metronomic chemotherapy,LDM)。以往在以传统的最大耐受量(maximum tolerated dose,MTD)为基础的化疗方案,是通过干扰肿瘤细胞的DNA复制、酶及微管功能或代谢来直接杀灭肿瘤细胞达到抑瘤的效果,因其化疗间歇期较长,使正常细胞得以恢复,但同时血管内皮细胞也得以修复,故其抗血管生成作用并没有带来良好的疗效。本实验建立裸鼠人乳腺癌模型,将传统的化疗方式MTD与LDM相结合,通过观察治疗后裸小鼠肿瘤组织中TSP-1、MVD及AI表达的变化,以研究环磷酰胺MTD联合LDM的化疗方案,对乳腺癌血管生成的抑制作用。
1 材料与方法
1.1 材料
人乳腺癌细胞株MCF-7由大连医科大学附属第一医院中心实验室提供。BALB/c-nu裸鼠20只,雌性,4~6周龄,体重16~22 g,购于大连医科大学动物实验中心。环磷酰胺注射液粉剂购于江苏恒瑞医药有限公司,大鼠抗小鼠CD34单克隆抗体购于美国Biolegend公司,兔抗小鼠TSP-1单克隆抗体购于武汉博士德生物技术有限公司,TUNEL凋亡试剂盒购于南京凯基生物技术有限公司。免疫组化相关试剂盒购于北京中杉生物技术公司。
1.2 方法
1.2.1 动物模型建立 将人乳腺癌细胞株MCF-7细胞接种于含10%胎牛血清的IMDM培养基中,于5%CO2、37℃、饱和湿度的孵箱中培养,于对数生长期将其调至细胞浓度为6×107个/ml的MCF-7细胞悬液,按0.2 ml/只接种于裸鼠右侧胸壁乳垫下,待肿瘤体积长到150~200 mm3时开始分组用药。
1.2.2 实验分组及用药 将20只荷瘤裸鼠随机(随机数字表法)分成4组,每组5只,A组(LDM单药组)CTX 20 mg/kg,qd,ip,共 21 d;B 组(LDM+MTD 联合组)CTX 150 mg/kg,qod,ip,共 3 次,隔天予 CTX 20 mg/kg,qd,ip,共21 d;C 组(MTD 单药组)CTX 150 mg/kg,qod,ip,共3 次,共21 d;D 组(生理盐水组)NS等体积,qd,ip,共 21 d。
1.2.3 组织取材及病理切片检查 用药结束采用颈椎脱臼法处死裸鼠,在无菌条件下剥离瘤组织,称重。瘤标本离体后,15 min内浸泡于10%的中性福尔马林液中,常温下固定8~24 h,石蜡包埋,2 μm连续切片,行HE染色,CD34、TSP-1免疫组织化学染色及TUNEL凋亡检测(按说明书操作)。
1.2.4 结果评定标准 用药期间,每周尾静脉采血计数外周血白细胞数,隔天测量肿瘤体积,用游标卡尺测量肿瘤最大直径(a)及与之相垂直的横径(b),根据公式V(mm3)=1/2ab2,计算出肿瘤相对体积并绘制肿瘤生长曲线。用药结束后,脱颈处死裸鼠,称瘤重,并计算瘤质量抑瘤率,抑瘤率=(对照组重量-实验组重量)/对照组重量×100%。
MVD 判定:按照 Weidner[1]的微血管判断标准,低倍镜确定肿瘤组织内微血管密度最密集的视野(新生血管热点区),高倍镜10×20视野范围内计数所有染色的微血管,取4个视野计数结果的均值。
TSP-1判定:正常的黏膜上皮细胞或肿瘤细胞胞质及细胞间质出现棕黄色颗粒为阳性,阳性表达判断标准:①低倍镜下选染色均匀的肿瘤区域,在400倍视野下,按着色细胞占视野细胞总数的百分数分为3级:无着色细胞为0级(0分);着色细胞数<25%为1级(1分);25% ~56%为2级(2分);>56%为3级(3分)。②按细胞着色强弱分级:0级(0分):不着色;1级(1分):着色弱;2级(2分):中等着色;3级(3分):着色强。根据上两项分数之和判断:0分为阴性,1~2分为弱阳性,3~4分为中度阳性,5~6分为强阳性。
TUNEL判定:细胞核内有棕黄色或棕黑色者为凋亡细胞,凋亡程度以凋亡指数(AI)表示。随机取5个高倍镜视野,每个视野计数200个细胞,计算阳性细胞百分率(%),AI=阳性细胞数/观察细胞数×100%。
1.3 统计学分析
采用SPSS 19.0软件包进行统计学分析,实验数据用均数±标准差表示,多组均数间的比较采用单因素方差分析,相关性分析采用Pearson相关分析。
2 结果
2.1 CTX对肿瘤体积生长的抑制作用
用药前期,各组肿瘤体积未见明显差异;随作用时间延长,各组肿瘤体积逐渐出现差异,B组瘤体积增长速度明显慢于D组。用药后期,各用药组瘤体积增长速度均慢于D组,B组肿瘤体积增长平缓,D组肿瘤生长曲线陡直,低剂量节律化疗组与最大耐受量组间瘤体积无明显差异(表1,图1)。用药第14天D组与各用药组间比较,有统计学差异(P<0.05);第21天B组肿瘤体积小于A、C两组(P<0.05)。

表1 各组裸鼠用药后1、7、14、21 d移植瘤体积
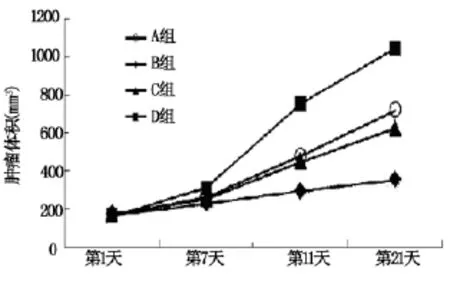
图1 各组裸鼠用药期间移植瘤生长曲线图
2.2 瘤重与抑瘤率
结果显示,各用药组与D组比较均有统计学意义,B组与A组和C组比较,有统计学差异(P<0.05),B组瘤质量最小,抑瘤率达69.15%,A组与C组抑瘤率比较无统计学差异(表2)。
表2 治疗后各组瘤质量及抑瘤率情况(s,%)
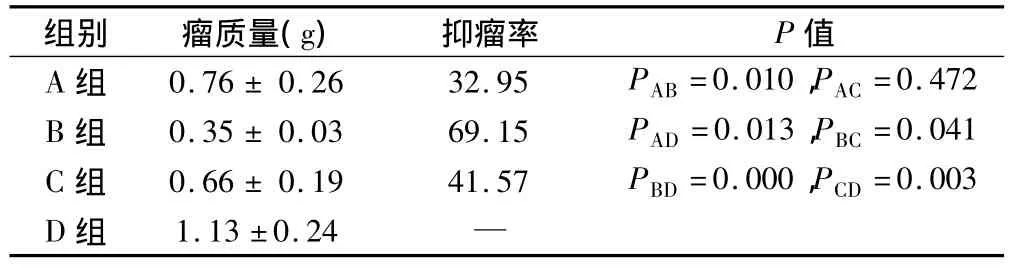
表2 治疗后各组瘤质量及抑瘤率情况(s,%)
组别 瘤质量(g)抑瘤率 P值A 组 0.76 ± 0.26 32.95 PAB=0.010,PAC =0.472 B 组 0.35 ± 0.03 69.15 PAD=0.013,PBC=0.041 C 组 0.66 ± 0.19 41.57 PBD=0.000,PCD=0.003 D 组 1.13 ±0.24—
2.3 毒副作用
化疗给机体带来的不良反应主要表现为骨髓抑制、呕吐、腹泻等,其中以Ⅲ~Ⅳ度骨髓抑制为主要的、最常见的不良反应。小鼠用药前后一般状况良好,各组间白细胞计数无统计学意义,MTD用药后细胞数量呈现出上下浮动趋势(图2),但均在正常值范围内(小鼠白细胞参考值为4~12×109个/L)。考虑可能由于传统最大耐受量的化疗方式,大量杀灭了正常白细胞,刺激了机体的自身保护机制,动员骨髓中的未成熟的白细胞进入外周血中。
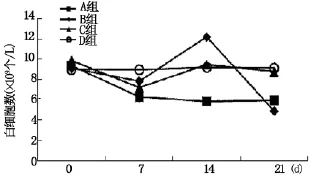
图2 小鼠用药前后白细胞变化情况
2.4 病理检测结果
2.4.1 MVD结果 本实验结果显示,D组MVD阳性表达水平明显高于各用药组(表3)。C组MVD表达水平高于A组和B组(P<0.05),而A组与B组比较、C组与D组比较均无差异(P>0.05)。
表3 治疗后各组裸鼠移植瘤MVD检测结果(s)
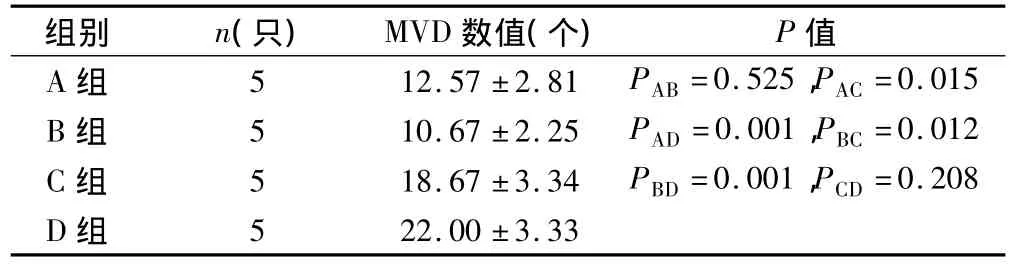
表3 治疗后各组裸鼠移植瘤MVD检测结果(s)
组别 n(只)MVD数值(个)P值A 组 5 12.57 ±2.81 PAB=0.525,PAC =0.015 B 组 5 10.67 ±2.25 PAD=0.001,PBC=0.012 C 组 PBD=0.001,PCD=0.208 D组
2.4.2 TSP-1结果 本实验结果显示,B组 TSP-1阳性表达水平明显高于 C、D两组(P<0.05)(表4),A组其表达水平高于C、D两组(P<0.05),A组与B组比较未见差异(P>0.05)。
表4 治疗后各组裸鼠移植瘤TSP-1检测结果(s)

表4 治疗后各组裸鼠移植瘤TSP-1检测结果(s)
组别 n(只)TSP-1分值 P值A 组 5 3.40 ±0.14 PAB=0.548,PAC =0.021 B 组 5 3.71 ±0.76 PAD=0.004,PBC=0.004 C 组 PBD=0.001,PCD=0.48 D组
2.4.3 TUNEL结果 本实验结果显示,B组镜下凋亡细胞数目,显著多于其他用药组和D组,D组与其他组间比较,AI值均存在差异,AI值B组与A、C组比较均有统计学意义(P<0.05),但C组与A组比较未见差异(P >0.05)(表5)。
表5 治疗后各组裸鼠移植瘤凋亡指数(AI)(s,%)
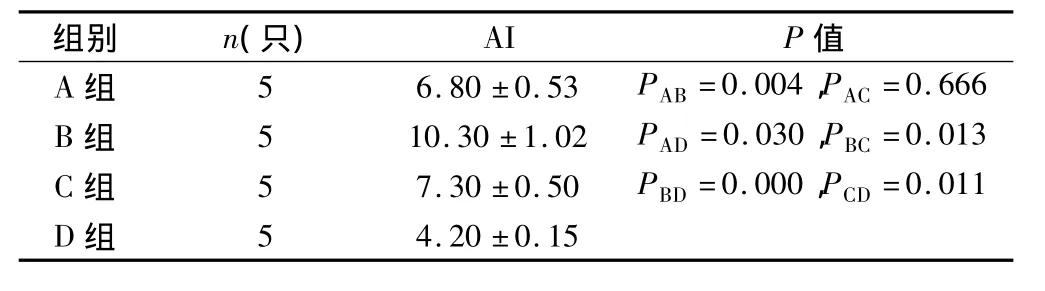
表5 治疗后各组裸鼠移植瘤凋亡指数(AI)(s,%)
A 组 5 6.80 ±0.53 PAB=0.004,PAC =0.666 B 组 5 10.30 ±1.02 PAD=0.030,PBC=0.013 C 组 5 7.30 ±0.50 PBD=0.000,PCD=0.011 D组
2.5 TSP-1、MVD、TUNEL 相关性
统计学结果显示,裸鼠移植瘤中MVD与TSP-1表达呈负相关性(γ = -0.503,P=0.014),TSP-1 表达与肿瘤细胞凋亡呈正相关性(γ =0.420,P=0.046)。
3 讨论
恶性肿瘤的生长、转移依赖于肿瘤血管的生成。Hanahan[2]2011年重诉了肿瘤细胞的10个基本特征,其中基因组不稳定和突变、持续的血管生成及回避凋亡均为肿瘤细胞的重要特征。传统的化疗方式主要是以细胞毒性理论为基础,肿瘤细胞的不稳定性,易于突变,很容易使肿瘤细胞产生耐药性。相对而言,肿瘤血管内皮细胞比较稳定,不易发生突变导致耐药,因而抗血管生成成为治疗乳腺癌的新手段。最大耐受剂量的CTX(MTD)能诱导肿瘤微血管内皮细胞凋亡,但化疗周期之间的较长间歇能使大部分受损的血管系统得以恢复,因而不能带来持久的治疗效果[3]。本实验采用了最大耐受剂量的CTX能诱导肿瘤微血管内皮细胞凋亡的优点,摒弃化疗周期较长间歇使大部分受损的血管系统得以恢复的缺点,考虑到小剂量节律化疗对机体的不良反应较低,且能够持续治疗较长时间,故在传统的最大耐受剂量间歇期给与小剂量节律化疗,在很大程度上增强了杀灭肿瘤细胞和抗血管生成的双重作用。
环磷酰胺作为经典的化疗药物,属双功能烷化剂及细胞周期非特异性药物,其主要干扰DNA及RNA功能,抑制肿瘤细胞增殖。传统的化疗方案主要是通过抑制肿瘤细胞生长或诱导其凋亡而发挥作用的,而节律化疗虽对肿瘤细胞也有作用,但主要是通过破坏肿瘤血管而达到抗肿瘤的作用,而TSP-1可能是低剂量环磷酰胺抗肿瘤作用的潜在因子[4,5],Hamano 等[6]和Samantha等[7]研究又提出,TSP-1诱导内皮细胞凋亡可产生抗血管生成的作用。乳腺癌经典的化疗方案中(如CAF、CEF、AC-T等)均使用环磷酰胺作为基础药物,故本实验采用环磷酰胺为治疗药物,将传统的最大耐受量的化疗方案与低剂量节律化疗相结合,免疫组化结果证实其上调TSP-1,抑制MVD表达,提高肿瘤细胞凋亡率。因而,我们得出结论,环磷酰胺MTD联合LDM可抗肿瘤血管生成、诱导肿瘤细胞凋亡,并不增强毒副作用;其可能通过上调TSP-1表达,间接达到抑制肿瘤血管生成。
[1]Weidner N.Current pathologic methods for measuring intratumoral microvessel density with in breast carcinoma and other solid tumors〔J〕.Breast Cancer Res Treat,1995,36(2):169.
[2]Hanahan D,Weinberg RA.Hallmarks of cancer:the next generation〔J〕.Cell,2011,144(5):646.
[3]Man S,Bocci G,Francia G.Antitumor effects in mice of lowdose cyclophosphamide administered continuously through the drinking water〔J〕.Cancer Res,2002,62(10):2731.
[4]Bocci G,Francia G,Man S.Thrombospondin-1,amediator of the antiangiogenic effects of low-dose metronomic chemotherapy〔J〕.Proc Natl Acad Sci,2003,100(22):12917.
[5]王 云,梁宪斌,纪媛媛,等.环磷酰胺节律化疗的抗血管生成作用探讨〔J〕.山东医药,2006,46(6):17.
[6]Hamano Y,Sugimoto H,Soubasakos MA,et al.Thrombospondin-1 associated with tumor microenvironment contributes to low-dose cyclophosphamide-mediated endothelial cell apoptosis and tumor growth suppression〔J〕.Cancer Res,2004,64(5):1570.
[7]Samantha AG,Christopher RH,Stephen GH,et al.Thrombospond-1 inhibits angiogenesis and promotes follicular atresia in a novel in vitro angiogenesis assay〔J〕.Endocrinology,2010,151(3):1280.

