塞来昔布对宫颈癌细胞的化疗增敏作用
周自华 徐宁红 陈尚忠 邹 媚 袁志华 肖 丽
COX-2在结肠癌、肺癌、胃癌、食管癌、乳腺癌、宫颈癌、鼻咽癌等多种恶性肿瘤中均呈高度表达[1~7]。因此,塞来昔布作为1种高选择性COX-2抑制剂,研究表明,它具有预防和抑制肿瘤的作用。由于其靶向性强,副作用小,已在多种肿瘤预防和治疗中发挥作用[8]。本研究主要验证塞来昔布假设在无细胞毒作用浓度下,可通过上调Bax蛋白和下调Bcl-2蛋白水平,达到增强顺铂对Hela细胞的增殖抑制和诱导凋亡作用。
1 材料与方法
1.1 材料
宫颈癌细胞株Hela细胞,由南华大学肿瘤研究所提供。塞来昔布购自安徽合肥森瑞化工有限公司,用95%的乙醇溶解,配成40 mmol/L的储存液备用。顺铂注射液购自山东齐鲁制药厂,小牛血清购自杭州四季青生物工程公司,RPMI-1640培养基购自Gibco公司,四甲基偶氮唑蓝(MTT)购自Amresco公司,鼠抗人Bcl-2抗体、鼠抗人Bax抗体均购自Santa公司。
1.2 细胞培养
采用常规培养,培养液为含10%小牛血清的RPMI-1640,在37℃、饱和湿度、5%CO2温箱中培养,每1~2天换液传代,取对数生长期细胞用于实验。
1.3 四甲基偶氮唑蓝比色法(MTT)检测细胞增殖率
取对数生长期细胞,接种于96孔板,每孔180 μl,含1×104个细胞。培养6 h后每孔加入处理因素,设调零组、空白对照组、酒精对照组(含1.75%酒精的RPMI-1640)、塞来昔布组(5、10 μmol/L)、顺铂组(1、2、4 μg/ml)、塞来昔布与顺铂联合组(塞来昔布 5、10 μmol/L+顺铂 1、2、4 μg/ml)。每组设 3 个平行孔,再培养24 h后,加入5 g/LMTT液20 μl/孔(调零组除外),再培养4 h,然后吸去上清液,每孔加入100 μl DMSO液,待结晶完全溶解后,在570 nm波长下测吸光度A值,按下列公式计算药物对细胞的生长抑制率(IR)。IR=(1-用药组A值/对照组A值)×100%。联合用药效果根据文献[4]提供的金氏公式计算,求出q值进行判断:q=Ea+b/(Ea+Eb)-Ea×Eb,其中Ea+b为两药合用的抑制率,Ea及Eb为各药单用时的抑制率,当q<0.85时,表示两药合用有拮抗作用;q>1.15 时,表示两药合用有增效作用;1.15≥q≥0.85时,表示两药合用有相加作用。
1.4 流式细胞仪检测细胞凋亡率
收集对数生长期细胞,培养6 h贴壁后,加入含药物的培养液,分为5组:空白对照组、酒精对照组、塞来昔布组(5 μmol/L)、顺铂组(1、2、4 μg/ml)、塞来昔布与顺铂联合组(塞来昔布 5 μmol/L+ 顺铂 1、2、4 μg/ml)。培养24 h后收集细胞,计数制成1 ml 1×109/L的单细胞悬液。4℃预冷的70%乙醇2 ml固定细胞,过夜,PBS洗3次后经0.5 g/L的 Rnase A消化30 min,应用终浓度为65 mg/L的碘化丙啶(propidium iodidu,PI)染色1 h后应用流式细胞仪测定,计算细胞凋亡率。
1.5 Western blot检测蛋白的表达
取对数生长期的细胞,分为4组:空白对照组、酒精对照组、5 μmol/L 塞来昔布组、10 μmol/L 塞来昔布组。处理24 h后,用PBS洗3次后,加入细胞裂解液,提取蛋白。灌制10%-聚丙烯酰胺凝胶,常规电泳,蛋白转PVDF膜,5%脱脂牛奶封闭1 h,加相应的一抗,4℃过夜,加二抗,室温反应1 h后洗膜,加发光剂、压膜、显影、定影。采用薄层扫描仪测定胶片印迹区带的吸光度值。
1.6 统计学处理
2 结果
2.1 塞来昔布与顺铂联合作用及单用顺铂对Hela细胞增殖的影响
5、10 μmol/L塞来昔布对Hela细胞无明显毒性作用,增殖抑制率分别为1.25%、2.50%,两药合用时细胞生长抑制率均明显高于相应顺铂单药组,q>1.15。在顺铂浓度相同条件下,两药合用时细胞增殖抑制率随塞来昔布浓度增加而增高。Hela细胞生长抑制率与塞来昔布、顺铂浓度的关系见表1。
表1塞来昔布和顺铂对Hela细胞增殖的影响(s,n=3)

表1塞来昔布和顺铂对Hela细胞增殖的影响(s,n=3)
注:a为与空白对照组比较,P<0.05;b为与相应顺铂单药组比较,P<0.05
塞来昔布浓度(μmol/L)顺铂0 μ 顺铂 1 μ g/ml IR(%)g/ml IR(%)q 值 顺铂 2 μg/ml IR(%)q 值 顺铂 4 μg/ml IR(%)q 值0 29.61 ±1.76 41.18 ±2.26 47.91 ±2.67 5 0 0.70 ±0.14 35.16 ±3.27(a,b) 1.16 50.64 ±1.95(a,b) 1.22 56.38 ±2.83(a,b) 1.17 10 1.04 ±0.04 41.60 ±1.13(a,b) 1.37 56.97 ±3.65(a,b) 1.35 63.89 ±1.33(a,b)1.31
2.2 塞来昔布单独及与顺铂合用时对Hela细胞凋亡的影响
Hela细胞的自然凋亡率为 1.18% ±0.07%,5 μmol/L塞来昔布作用于Hela细胞24 h后,细胞凋亡率为1.55% ±0.30%,无显著性变化(P >0.05),说明5 μmol/L塞来昔布并不能诱导Hela细胞凋亡。不同浓度顺铂(1、2、4 μg/ml)与 Hela细胞作用24 h后,在一定程度上诱导Hela细胞凋亡。两药合用时细胞凋亡率均明显高于相应顺铂单药组(P<0.05),见图1,各顺铂组与塞来昔布(5 μmol/L)联合组细胞凋亡率比较见表2。
表2 塞来昔布与顺铂作用Hela细胞24 h后凋亡率情况(s,n=3)

表2 塞来昔布与顺铂作用Hela细胞24 h后凋亡率情况(s,n=3)
注:a为与顺铂组比较,P<0.05
顺铂浓度(μg/ml)Hela细胞凋亡率(%)顺铂组 顺铂 +5 μmol/L塞来昔布组0 1.18 ±0.07 1.55 ±0.30 a
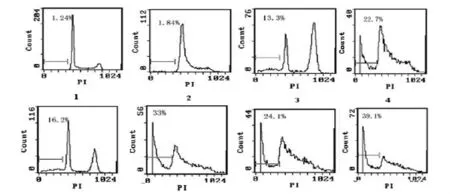
图1 流式细胞术检测Celecoxib与DDP作用于Hela细胞24 h后凋亡情况
2.3 塞来昔布对Hela细胞相关蛋白的影响
正常生长的Hela细胞中有Bcl-2、Bax蛋白的表达,酒精对照组与空白对照组上述蛋白表达比较无显著性差异(P>0.05)。灰度扫描仪显示,随着塞来昔布浓度的增加,Bcl-2蛋白与β-actin的灰度值比逐渐减少,Bax蛋白与β-actin的灰度值比逐渐增大,且呈量效关系(P <0.05),见表3,图3。
表3 Western blot检测目的蛋白分别与β-actin的灰度值比较(s,n=3)

表3 Western blot检测目的蛋白分别与β-actin的灰度值比较(s,n=3)
注:a为与各空白对照组比较,P<0.05
塞来昔布(μmol/L)Bcl-2蛋白 Bax蛋白0 2.16 ±0.22 0.83 ±0.17酒精组 2.14 ±0.18 0.85 ±0.15 a

图2 Westernblot检测Bcl-2和Bax蛋白的表达情况
3 讨论
宫颈癌的主要治疗方法是手术和放疗,作为1种全身治疗手段,化疗在宫颈癌高危病例和晚期复发转移患者的治疗中是不可或缺的,可更好的提高局部和远处转移控制率,提高长期生存率和改善生活质量。含铂类药物化疗已成为局部中晚期宫颈癌的标准治疗模式[9]。其中顺铂是被证明在铂类中最有效的药物,它是1种广谱抗癌药[10]。但顺铂的不良反应和肿瘤细胞的耐药性使宫颈癌的化疗效果不理想,因此寻找1种高效的化疗增敏剂或本身亦有抗肿瘤活性的药物倍受关注。本实验结果显示,单用塞来昔布在0~10 μmol/L的浓度时,对Hela细胞的生长无明显抑制作用,而联用顺铂后,2种药物联合作用组细胞增殖抑制率,都明显高于相应的顺铂单独用药组。提示对于上述浓度的顺铂,联用塞来昔布能够发挥两者的协同效应,起到化疗増敏作用。并且在同一顺铂浓度下,两药合用时的增殖抑制率随塞来昔布浓度增加而增高,但协同作用的大小与塞来昔布浓度关系不明显。顺铂用于宫颈癌化疗常规浓度为50 mg/m2,其血浆峰值浓度为2.5 μg/ml,故本实验采用与血浆峰值接近的药物浓度进行研究。不同浓度的顺铂(1、2、4 μg/ml)作用于Hela细胞24h后在一定程度上诱导凋亡,而与塞来昔布(5 μmol/L)合用时,其凋亡率均较相应浓度的顺铂单独用药组有明显增高,表明塞来昔布在无细胞毒作用浓度下能增强宫颈癌细胞对顺铂的敏感性,可能成为1种极具潜力的化疗增敏药。
大多数肿瘤化疗药物是通过诱导细胞凋亡而发挥抗肿瘤作用的。Bcl-2是凋亡抑制基因,有研究发现Bcl-2的过度表达与瘤细胞中的耐药基因的表达相关联,并可通过抑制细胞凋亡而导致耐药性的发生[11]。Bax是Bcl-2家族的成员,其作用与Bcl-2相反,是促进细胞凋亡的基因。Bcl-2与Bax在体内是通过二聚体而发挥作用的,Bax/Bcl-2下降,抑制凋亡,Bax/Bcl-2升高,促进凋亡。研究提示COX-2是Bcl-2的上游调节成员,它可通过提高Bcl-2的表达,诱导肿瘤组织减少凋亡蛋白Bax表达,降低肿瘤细胞凋亡,从而延长肿瘤细胞生存时间。而选择性COX-2抑制剂可减少COX-2表达,从而下调Bcl-2抗凋亡蛋白表达,诱导肿瘤细胞凋亡。本组Western blot实验显示,经塞来昔布处理后,随着药物浓度增加,抗凋亡蛋白Bcl-2表达减弱,而凋亡蛋白Bax表达增强,使得Bax和Bcl-2比例中,Bax占优势,因而使Bax等蛋白从细胞质转移至线粒体外膜,并多聚化,形成膜通道,刺激线粒体释放细胞色素C(CytC),使CytC释放进入细胞质,通过线粒体/细胞色素 C 途径发生凋亡[12,13]。综上所述,塞来昔布增强Hela细胞对顺铂的敏感性机制之一,也可能是通过调控这2种蛋白,降低肿瘤细胞的凋亡抗性有关。
[1]Wendum D,Masliah J,Trugnan G,et al.Cyclooxygenase-2 and its role in colorectal cancer development〔J〕.Virchows Arch,2004,445(4):327.
[2]Khuri FR,Wu H,Lee JJ,et al.Cyclooxygenase-2 overexpression is a marker of poor prognosis in stageⅠnon-small cell lung cancer〔J〕.Clin Cancer Res,2001,7(4):861.
[3]Uefuji k,Ichikura T,Mochizuki H.Expression of cyclooxygenase-2 in human gastric adenomas and adenocarcinomas〔J〕.J Surg Oncol,2001,76(1):26.
[4]France M,Drew PA,Dodd T,et al.Cyclo-oxygenase-2 expression in esophageal adenocarcinoma as a determinant of clinical outcome following esophagectomy〔J〕.Dis Esophagus,2004,17(2):136.
[5]Visscher DW,Pankratz VS,Santisteban M,et al.Association between cyclooxygenase-2 expression in atypical hyperplasin and risk of breast cancer〔J〕.J Natl Cancer Inst,2008,100(6):421.
[6]Fermandina G,Lauriola L,Distefano MG,et al.Increased cyclooxygenase-2 expression is associated with chemotherapy resistance and poor survival in cervical cancer patients〔J〕.J Clin Oncol,2002,20(4):973.
[7]许新华,胡国清,李道俊,等.环氧化酶-2对鼻咽癌血管生成及预后的影响〔J〕.中华放射肿瘤学杂志,2003,12(3):154.
[8]易 芳,许新华.塞来昔布在肿瘤防治中的研究进展〔J〕.临床肿瘤学杂志,2007,12(4):316.
[9]Shoji T,Takatori E,Murai M,et al.Results of neoadjuvant chemotherapy using tri-weekly CDDP/CPT211 for locally advanced cervical cancer〔J〕.Gan To Kagaku Ryoho,2010,37(4):643.
[10]刘天亮,吴 云.多西紫杉醇联合顺铂治疗晚期乳腺癌21 例分析〔J〕.中国误诊学杂志,2008,8(3):707.
[11]Tse C,Shoemaker AR,Adickes J,et al.ABT-263:a potent and orally bioavailable Bcl-2 family inhibitor〔J〕.Cancer Res,2008,68(9):3421.
[12]Li X,Ding X,Adrian TE.Arsenic trioxide causes redistribution of cell cycle,Caspase activation,and GADD expression in human colonic,breast and pancreatic cancer cells〔J〕.Cancer Invest,2004,22(3):389.
[13]邢 茂,张恩娟,叶 鑫.三氧化二砷诱导肿瘤细胞凋亡途径的研究〔J〕.中国药理学通报,2002,18(1):87.

