酪氨酸蛋白激酶EphA7蛋白在胃癌组织中的表达及与其预后的关系
陈千益 欧敬民 刘颖斌 穆嘉盛 庄鹏远 何晓华
胃癌是常见的恶性肿瘤之一,在发病机制中已发现许多相关基因高或低表达、变异或缺失等影响着肿瘤的恶性转化、侵袭或转移发挥着重要的作用。通过检测胃癌组织中的相关基因,对临床治疗及评估预后有一定的价值。近年来,酪氨酸蛋白激酶EphA7在肿瘤发生和发展过程中的作用受到越来越多关注,已发现EphA7在许多恶性肿瘤中表达异常,且与肿瘤血管的形成、肿瘤细胞的增殖、侵袭或转移过程有密切关系[1~6]。本研究通过检测酪氨酸蛋白激酶 EphA7蛋白在胃癌组织中的表达,旨在探讨EphA7蛋白表达水平及与其临床病理特征和预后的关系。
1 材料与方法
1.1 研究对象
收集上海交通大学医学院附属新华医院2003年1月至2008年12月、手术切除并经病理组织学检查证实为胃癌的83例标本作为实验组,术前均未行放疗、化疗、免疫治疗等抗肿瘤治疗。其中男性56例,女性27例;年龄43~82岁,平均64岁。83例胃癌中,近端胃癌(U)17例(20.5%)、中段胃癌(M)13例(15.7%)和远端胃癌(L)53例(63.8%)。经病理检查证实高分化腺癌11例(13.3%),中分化腺癌35例(42.2%),低分化腺癌29例(34.9%)(其中印戎细胞癌16例、黏液腺癌13例),未分化腺癌8例(9.6%);Borrmann大体类型:溃疡型11例(13.3%),乳头状型17例(20.5%),结节型 23 例(27.7%),浸润型 32 例(38.5%);浸润深度:T1 4 例(4.8%)(黏膜下层),T2 21例(25.3%)(肌层6例、浆膜下层15例),T3 39例(47.0%)(浆膜层),T4 19 例(22.9%)(累及邻近脏器);淋巴结转移:阴性23例(27.7%),阳性60例(72.3%);TNM 分期:Ⅰ期 6 例(7.2%),Ⅱ期 14 例(16.9%),Ⅲ期 35 例(42.2%),Ⅳ期 28 例(33.7%)。83例患者中45例行血清CA19-9、癌胚抗原(CEA)检查,其中血清CA19-9阳性率为84.4%(38/45)(分界值34 000 U/L),血清 CEA阳性率为22.2%(10/45)(分界值19 μg/L)。对照组30例癌旁组织,均经病理检查证实为手术切缘阴性标本。
1.2 试剂与方法
EphA7蛋白鼠抗人单克隆抗体购于福州迈新生物技术有限公司,S-P试剂盒及DAB显色试剂盒均购自武汉博士德生物工程有限公司。应用免疫组化法,检测胃癌组织中EphA7表达,将蜡块制成4 μm厚的切片。选取1张行常规HE染色,确定组织学分化程度,检测胃癌组织中EphA7表达的步骤如下:石蜡切片常规脱蜡至水洗;0.01 mol/L pH 6.0枸橼酸盐缓冲液高温高压1.5 min,分别用3%H2O2和非免疫血清阻断内源性过氧化物酶活性,并封闭非特异性结合位点;滴加一抗(EphA7 1∶200稀释),4℃过夜;生物素标记的二抗37℃孵育30 min;SP复合物37℃孵育30 min,DAB显色,苏木精复染3 min,盐酸酒精分化2~3 s,脱水、透明、中性树胶封片。以已知EphA7阳性组织切片作为阳性对照,PBS代替一抗作为阴性对照。
1.3 结果判定标准
1.3.1 双人盲法观片 在不知道临床病理资料的情况下,对免疫组化切片进行评估。EphA7抗原定位于细胞质内,胞质内出现棕黄色或棕褐色的颗粒或斑片,癌旁正常组织中也可见EphA7阳性表达,但颜色较浅,呈浅黄色。
1.3.2 光镜下计分标准 按切片中细胞显色有无及深浅计分(A):0分,细胞无显色;1分,胞质显色为浅黄色;2分,胞质显色为棕黄色;3分,胞质显色为棕褐色。按切片中显色细胞的比例计分(B):1分,显色癌细胞占癌细胞总数<1/3;2分,癌细胞显色比例在1/3~2/3;3分,癌细胞显色比例>2/3。每例积分=A×B,按积分高低分为:0分为阴性(-);1~2分为弱阳性(+);3~6分为阳性(++);>6分为强阳性(+++)。
1.4 随访及统计学方法
电话随访或信访。采用SPSS 16.0统计学软件,根据数据类型不同分别进行t检验、Spearman秩相关分析、χ2检验及Fisher精确概率法;生存率的计算采用Kaplan-Meier法,并作Long-Rank检验及 Cox多因素生存分析。
2 结果
2.1 EphA7蛋白在胃癌组织中的表达情况
EphA7蛋白主要表达于肿瘤细胞胞质和血管内皮细胞,呈棕黄色或棕褐色颗粒状或斑片状,染色均一;癌旁组织中也可见EphA7蛋白阳性表达,但颜色普遍较浅,呈浅黄色。83例肿瘤组织中,EphA7蛋白表达阳性68例(81.9%)。对照组30例中EphA7阳性表达7例(23.3%)。EphA7蛋白阳性表达率胃癌组织高于癌旁正常组织(P<0.05)(表1)。

表1 EphA7蛋白在胃癌组织中的表达情况(例,%)
2.2 EphA7蛋白表达与胃癌临床病理特征的关系
EphA7蛋白表达与胃癌临床病理特征的关系(表2)。
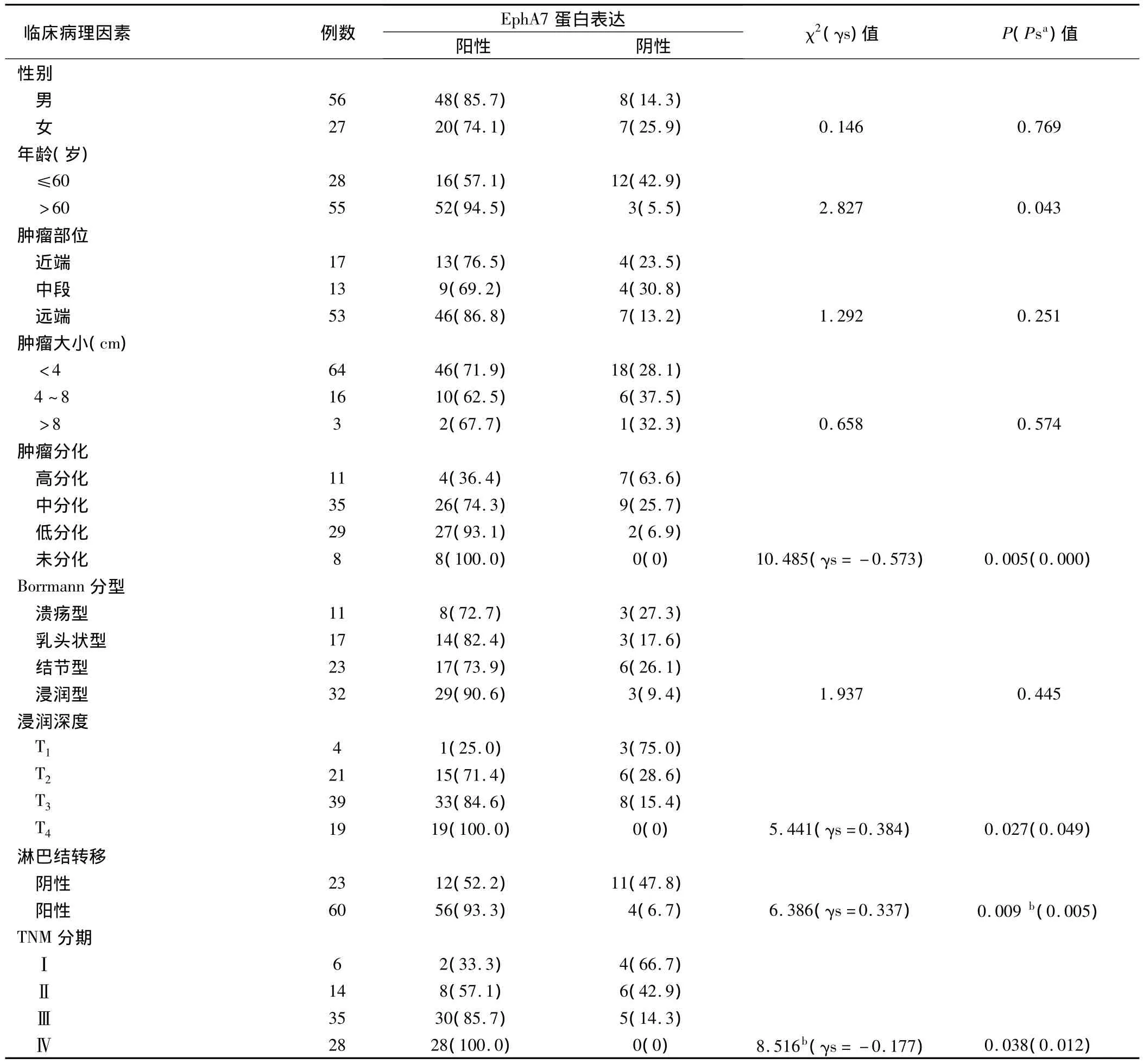
表2 EphA7蛋白表达与胃癌临床病理特征的关系(例,%)
2.3 术前血浆肿瘤标志物浓度与EphA7蛋白表达水平的关系
83例胃癌患者中45例行血清CA19-9、CEA检测。EphA7蛋白阳性表达组术前血清CA19-9浓度[(315 500 ±45 700)U/L,n=36]高于阴性表达组[(94 300 ± 27 200)U/L,n=9](t=2.259,P=0.038)。EphA7蛋白阳性表达组和阴性表达组血清CEA 浓度分别为(34.3 ±6.5)μg/L 和(23.5 ±5.9)μg/L,差异无统计学意义(t=1.433,P=0.155)。E-phA7蛋白表达水平与血清CA19-9、CEA呈正相关性(表3)。

表3 EphA7蛋白表达与血清CA19-9、癌胚抗原(CEA)的关系
2.4 EphA7蛋白表达水平与患者生存期的关系
2.4.1 EphA7蛋白表达阳性组及阴性组的生存情况83例患者中EphA7蛋白表达阳性者68例,阴性者15例。Kaplan-Meier生存分析显示,83例患者1、2、3、5 年生存率分别为 79.2%、66.7%、57.5% 和 20.3%,平均生存期为37.8个月。其中EphA7蛋白表达阴性组1、3、5 年生存率分别为 91.4%、75.6% 和 39.5%,平均生存期为48.3个月;EphA7蛋白表达阳性组1、3、5 年生存率分别为 67.5%、35.2% 和 12.3%,平均生存期为22.7个月。EphA7蛋白表达阳性组与阴性组生存率比较,差异有统计学意义(χ2=10.568,P=0.001)。
2.4.2 EphA7蛋白表达水平对患者预后的影响 单因素分析显示,患者年龄、浸润深度、分化程度、淋巴结转移、TNM分期和EphA7蛋白表达水平与患者预后有关,而性别、肿瘤大小、肿瘤部位、肿瘤大体分型与患者预后无关。对单因素筛选出的显著性变量,纳入Cox模型进行多因素生分析,结果显示EphA7蛋白表达水平、淋巴结转移和TNM分期是胃癌独立的预后因素。
3 讨论
3.1 EphA7蛋白在胃癌中表达及其与临床病理特征的相关性
EphA7是酪氨酸蛋白激酶受体家族(receptor tyrosine kinase,RTK)中的一员,定位于染色体6q16.1靠近断裂点的位置,在人体内分布广泛,参与了细胞生长、分化、胚胎发育及细胞内信号转换等过程中具有相当重要的生理功能[7]。近年研究发现EphA7在许多恶性肿瘤的发生发展过程中发挥重要作用,可能是反映恶性肿瘤进展、生物学行为及预后的重要生物学标志物。Surawska等[8]研究发现,EphA7在肺癌组织中的表达水平较正常肺组织中上升了4.6倍,而Hafner等[9]研究显示结肠癌组织中EphA7表达水平较正常结肠癌组织中下降了5.8倍。本研究结果显示,E-phA7蛋白阳性表达率为81.9%,相应的癌旁组织阳性表达率为23.3%,阳性染色定位于胃癌细胞质和血管内皮细胞中;与癌旁组织比较,EphA7蛋白的表达阳性率在胃癌组织中明显上调。有研究显示,胃癌肿瘤Borrmann大体分型、分化程度、浸润深度、淋巴结转移、TNM分期、切缘癌残留、治疗方式等是影响患者生存率的重要因素[3,10]。本研究显示,EphA7 蛋白表达与肿瘤分化程度呈负相关性,与肿瘤浸润深度、淋巴结转移、TNM分期呈正相关性。
3.2 EphA7蛋白表达与胃癌侵袭性生长、淋巴结转移的关系
EphA7蛋白在癌组织中的表达水平与恶性肿瘤的侵袭性及预后有关[1~6,8~10]。肿瘤血管生成是肿瘤生长和转移的形态学基础,是促进肿瘤转移的重要外部因素,它不仅为肿瘤提供充足的营养,而且为转移的肿瘤细胞提供了通道。大量的生物化学和遗传学证据提示了Eph/Ephrin信号传导通道在血管发生、发育过程中起着关键作用[11]。本研究中,EphA7蛋白高表达于肿瘤细胞和血管内皮细胞中,同时显示与胃癌淋巴结转移呈正相关。由此可见,EphA7蛋白主要影响胃癌的浸润及转移,通过检测胃癌细胞EphA7蛋白表达水平,可初步判断胃癌生物学行为的恶性程度。
3.3 EphA7蛋白表达水平与术前血浆肿瘤标志物的相关性
CA19-9是诊断和检测消化道恶性肿瘤的有效肿瘤标志物之一,而且CA19-9水平进行性升高在临床症状出现之前,可作为术后判断肿瘤复发的指标[12]。目前,尚未见EphA7蛋白表达与血清CA19-9关系的详细报道。本研究显示,EphA7蛋白阳性表达组术前血清CA19-9浓度高于阴性表达组,血清CEA浓度也高于阴性表达组,但两组间差异无统计学意义;EphA7蛋白表达与血清CA19-9、CEA浓度呈正相关性。
3.4 EphA7蛋白表达水平与胃癌预后的相关性
EphA7在不同肿瘤中发挥的作用有可能不同,而这种可能与EphA7能和不同的Ephrin配体结合后产生的双向信号调节有关,提示EphA7可能主要作为1种致癌蛋白参与了肿瘤细胞的恶性转化过程,参与细胞周期调节及参与血管形成作用[1,8~11]。而肿瘤组织中高水平的EphA7蛋白必然导致肿瘤细胞凋亡的抑制、细胞周期的改变,引起肿瘤细胞增殖过旺,加之E-phA7蛋白高表达引起肿瘤组织新生血管增多,血液供应丰富,更加引起肿瘤细胞增殖过旺,这样就导致肿瘤形成[3,6]。已形成的肿瘤组织因EphA7蛋白进一步表达,使该肿瘤细胞不易凋亡,有恶性繁殖的条件及倾向,故其临床预后较差[13]。研究表明,结肠癌中 E-phA7低表达与患者性别、癌细胞分化程度、肿瘤发生部位等有关,而与患者年龄无关[4,9]。而胃癌中 E-phA7高表达与患者年龄、肿瘤分期有关,术后5年生存率有显著差异,提示EphA7蛋白表达可以影响肿瘤生物学行为,可使其更易发生局部与血行复发转移等恶性行为,是预后不良的指征[3,10,11,13,14]。本组资料显示,EphA7蛋白表达是胃癌患者预后差的标志,EphA7蛋白表达阳性组 1、3、5年生存率分别为67.5%、35.2%和12.3%,显著低于阴性组 1、3、5 年生存率;多因素分析显示,EphA7蛋白表达水平、淋巴结转移和TNM分期为胃癌根治术后独立的预后因素,EphA7蛋白表达阳性提示预后不良。
[1]张水军,张 弓,赵永福,等.原发性肝癌细胞中EphA7蛋白的表达及其临床意义〔J〕.中华外科杂志,2010,48(1):53.
[2]Dawson DW,Hong JS,Meyer S,et al.Global DNA methylation profiling reveals silencing of a secreted form of Epha7in mouse and human germinal center B-cell lymphomas〔J〕.Oncogene,2007,26(3):4243.
[3]王建东,李国立,马恒辉,等.受体酪氨酸激酶EphA7基因在胃癌中的表达及意义〔J〕.医学研究生学报,2009,22(3):260.
[4]Wang J,Kataoka H,Suzuki M,et a1.Downregulation of E-phA7 by hypermethylation in colorectal cancer〔J〕.Oncogene,2005,24(36):5637.
[5]Tsuboi M,Moil H,Burmi T,et a1.Secreted form of EphA7 in lung cancer〔J〕.Int J Oncol,2010,36(3):635.
[6]Guan M,Xu C,Zhang F,et a1.Aberrant methylation of E-phA7 in human prostate cancer and its relation to elinopathologle features〔J〕.Int J Cancer,2009,124(1):88.
[7]Ciossek T,Millauer B,Ullrich A,et al.Identification of alternatively spliced mRNAs encoding variants of MDK1,a novel receptor tyrosine kinase expressed in the murine nervous system〔J〕.Oncogene,1995,10(1):97.
[8]Surawska H,Ma PC,Salgia R.The role of ephrins and eph receptors in cancer〔J〕.Cytokine Growth Factor Rev,2004,15(6):419.
[9]Hafner C,Schmitz G,Meyer S,et al.Differential gene expression of Eph receptors and ephrins in benign human tissues and cancers〔J〕.Clin Chem,2004,50(3):490.
[10]Wang J,Li G,Ma H,et al.Differential expression of EphA7 receptor tyrosine kinase in gastric carcinoma〔J〕.Hum Pathol,2007,38(11):1649.
[11]Yaneopoulos GD,Davis S,Gale NW,et al.Vascular-specific growth factors and blood vessel formation〔J〕.Nature,2008,407(6801):242.
[12]Park IJ,Choi GS,Jun SH.Prognostic value of serum tumor antigen CA19-9 after curative resection of colorectal cancer〔J〕.Anticancer Res,2009,29(10):4303.
[13]Wang LF,Fokas F,Juricko F,et al.Increased expression of EphA7 correlates with adverse outcome in primary and recurrent glioblastoma multiforme patients〔J〕.BMC Cancer,2008,25(1):79.
[14]Brantley DM,Cheng N,Thompson EJ,et al.Soluble EphA receptors inhibit tumor angiogenesis and progression in vivo〔J〕.Oncogene,2002,21(10):7011.

