山葡萄籽中原花青素提取工艺优化
王新伟,赵 滢,沈育杰*
(中国农业科学院特产研究所,吉林 吉林 132109)
山葡萄籽中原花青素提取工艺优化
王新伟,赵 滢,沈育杰*
(中国农业科学院特产研究所,吉林 吉林 132109)
目的:通过单因素与正交试验研究不同的提取温度、料液比、时间、溶剂体积分数等因素对原花青素提取率的影响,确定最佳提取工艺参数。方法:以山葡萄籽为原料,乙醇作为提取剂,通过香草醛-HPLC法测定提取物中原花青素的提取率,香草醛法测定黄烷—3—醇单体与原花青素的总含量,HPLC法测定黄烷—3—醇单体的含量,二者之差为原花青素总含量。结果:最佳工艺参数为乙醇体积分数70%、提取时间120min、提取温度60℃、料液比1:5(g/mL)。结论:在此工艺参数下,原花青素提取率为3.12%。
山葡萄籽;原花青素;提取;香草醛;高效液相色谱法(HPLC)
原花青素为植物中一大类酚类物质的统称[1],广泛存在于各种植物中,因在热酸性条件下能转化成花青素而得名[2],它是由儿茶素或表儿茶素单体以C4-C6或C4-C8连接而成,结构中富含活泼羟基[3],具有很强的抗氧化能力[4],目前原花青素已广泛应用于食品[5]、药品[6]、化妆品[7]和保健品[8]等行业和领域。
山葡萄(Vitis amurensis Rupr),又名东北山葡萄,主产于中国东北,俄罗斯远东和朝鲜等地区[9]山葡萄籽是目前已知原花青素最为丰富的资源[10],其所含的黄酮类物质是欧亚种葡萄的4倍左右[11]。
吉林省是我国山葡萄酒的主产区,年产量在20万吨左右,山葡萄籽作为酿酒副产物主要被当做废弃物,既造成资源浪费又带来环境污染。本实验对从山葡萄籽中提取原花青素的工艺进行研究,具有很大的经济和生态意义。
1 材料与方法
1.1 材料与试剂
山葡萄籽 中国农业科学院特产研究所;原花青素标品、儿茶素标品、表儿茶素标品、没食子酸标品、表儿茶素没食子酸酯标品 天津尖峰天然产物研究开发有限公司;香草醛(分析纯) 天津光复精细化工研究所;乙醇(分析纯)、甲醇(分析纯)、乙酸(分析纯) 北京化工厂;盐酸(分析纯) 烟台双双化工有限公司;乙腈(色谱纯) 美国Honey Well公司。
1.2 仪器与设备
FW80型粉碎机 天津泰斯特仪器有限公司;IOTAVATO12-124型旋转蒸发仪 德国Buchi公司;HWS-24型恒温水浴锅 上海一恒科技有限公司;HZF-211型真空干燥箱 上海弘越实验设备有限公司;UV-2450型紫外分光光度计 日本岛津公司;1200型高效液相色谱仪器(DAD检测器) 美国安捷伦公司。
1.3 原花青素制备与检测
1.3.1 原花青素制备
山葡萄籽粉脱脂,将干燥山葡萄籽粉碎后,按料液比1:3(g/mL)加入石油醚密封,间歇振荡,48h后抽滤,通风脱去残留石油醚。脱脂山葡萄籽粉置于三角瓶中密封,按照一定料液比加入提取剂,水浴加热,间歇振荡一定时间后,抽滤除去残渣,滤液用旋转蒸发仪旋蒸浓缩后置于真空干燥箱中干燥得到原花青素粗品。
1.3.2 原花青素的含量测定方法
采用香草醛-浓盐酸法检测原花青素与黄烷-3-醇单体的总含量,HPLC法测定黄烷-3-醇单体的含量,在实际操作中以没食子酸、儿茶素、表儿茶素、表儿茶素没食子酸酯4种单体来代表黄烷-3-类单体[12]的总含量,二者之差为原花青素含量。

式中:C为吸光度在标准曲线上对应的样品的质量浓度;n为样品溶液的稀释倍数;W为样品定容以后的体积;Tp为脱脂葡萄籽粉末中原花青素的含量。
1.3.2.1 香草醛-浓盐酸法
显色剂配制:精确称量1.00g香草醛,8mL浓盐酸用甲醇定容于200mL容量瓶中,现用现配。将原花青素标准品配制成0.00、0.08、0.16、0.24、0.32、0.40mg/mL的甲醇溶液,取1mL标品溶液与5mL显色剂立即混匀,在30℃避光反应30min,以甲醇做空白对照,于波长500nm处测量吸光度,建立标准曲线:y=1.8839x-0.0223,R2=0.99792。
将原花青素粗品用甲醇稀释1000倍后按上述方法测定原花青素与单体的总含量。
1.3.2.2 HPLC法测定单体含量
色谱条件:色谱柱Angilent ZORBAX SB-C18(4.6mm×250mm,5μm);保护柱:Angilent ZORBAX SB-C18(4.6mm×12.5mm,5μm)。DAD检测器,波长280nm,流速0.8mL/min,柱温30℃。流动相A:1%乙酸;流动相B:乙腈-水-乙酸(80:19:1)。梯度洗脱程序如表1所示。

表1 高效液相色谱梯度洗脱程序Table 1 HPLC elution program
标准曲线制备:分别将没食子酸、儿茶素、表儿茶素、表儿茶素没食子酸酯标品溶解于甲醇中,配制成质量浓度分别为0.50、0.40、0.30、0.20、0.10mg/mL的溶液,用0.45μm微孔滤膜过滤后依次进样,标准曲线如表2所示。

表2 4种单体标准曲线Table 2 Standard curves of 4 mono-phenols
将原花青素粗品甲醇稀释溶液用0.45μ m微孔滤膜过滤后进样,测定4种单体总的含量。
1.4 单因素试验
1.4.1 粉碎度的影响
山葡萄籽分别粉碎成10、20、30、40、50目后脱脂,精确称量5份质量为5.00g的山葡萄籽粉末,1:7的料液比分别加入到60%的乙醇溶液,50℃提取80min,测定提取率。
1.4.2 提取温度的影响
精确称量5份质量为5.00g的脱脂山葡萄籽粉,1:7的料液比加入60%的乙醇溶液中,分别置于温度为40、50、60、70、80℃,的水浴中提取80min,测定提取率。
1.4.3 提取剂体积分数对提取率的影响
精确称量5份质量为5.00g的脱脂山葡萄籽粉末,1:7的料液比分别加入到体积分数为40%、50%、60%、70%、80%的乙醇溶液中,50℃水浴加热80min测定提取率。
1.4.4 料液比对提取率的影响
精确称量5份质量为5.00g的山葡萄籽粉分别加入到料液比为1:4、1:5、1:6、1:7、1:8的60%乙醇溶液,于50℃中反应80min测定提取率。
1.4.5 提取时间对提取率的影响
分别称取5份质量为5.00g脱脂山葡萄籽粉,1:7的料液比加入60%的乙醇溶液,50℃水浴中反应60、80、100、120、140min后测定提取率。
1.5 正交试验
在单因素试验的基础上,选取对原花青素提取率影响最大的4个因素——提取温度、提取时间、乙醇体积分数和料液比,利用正交试验设计确定最优化的提取方案,试验结果用SAS软件进行分析。
2 结果与分析
2.1 单因素试验对山葡萄籽中原花青素提取率的影响
2.1.1 粉碎度对提取率的影响
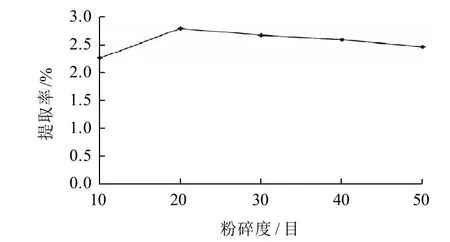
图1 粉碎度对提取率的影响Fig.1 Effect of particle size of crushed Amur grape seeds on extraction rate of proanthicyanidins
由图1可知,山葡萄籽的粉碎度在20目时提取率最高,随着粉碎度的进一步增大,提取率呈下降的趋势,这是因为在粉碎过程中产生大量的热将部分原花青素氧化分解,另一方面粉碎度越高山葡萄籽中所含多糖,蛋白质等杂质成分析出也越多[13],造成提取物的纯度下降的同时还会导致溶液黏稠度上升,给后续的抽滤带来很大困难,加大了后续工作的难度,综上所述,山葡萄籽最适宜粉碎度为20目。
2.1.2 提取温度对提取率的影响
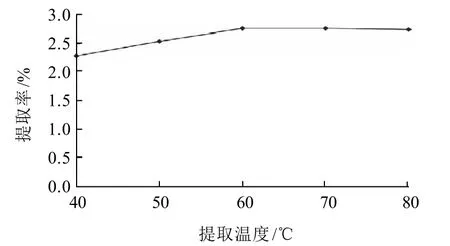
图2 提取温度对提取率的影响Fig.2 Effect of extraction temperature on extraction rate of proanthicyanidins
由图2可知,随着温度的上升,提取率也随之增大,在60℃达到最大值且趋于平衡,随着温度进一步升高,提取率呈下降趋势,这因为原花青素在高温易被氧化,温度越高原花青素的结构越容易被破坏,活性成分损失很大,还会造成杂质析出过多影响产品纯度[14],因此提取温度不宜超过70℃。
2.1.3 乙醇体积分数对提取率的影响
由图3可知,随着乙醇体积分数的增大,原花青素的提取率也逐渐升高,在乙醇体积分数为60%时达到最大值,随后随着乙醇体积分数的增大提取率呈下降趋势,这是因为水在溶剂中起到穿透细胞壁的作用,在提取过程中有利于原花青素的析出,若溶剂中含水量过低时溶剂对细胞壁的穿透作用下降导致提取率下降,因此最佳体积分数为60%。

图3 乙醇体积分数对提取率的影响Fig.3 Effect of ethanol concentration on extraction rate of proanthicyanidins
2.1.4 料液比对提取率的影响

图4 料液比对提取率的影响Fig.4 Effect of material/liquid ratio on extraction rate of proanthicyanidins
由图4可知,随着料液比的减小原花青素提取率逐渐增加,在料液比为1:6时达到最大值,随后提取率呈稳定的趋势,说明此时原花青素已经接近析出完全,继续减小料液比会造成后续步骤加压蒸馏时间的延长和溶剂的浪费,因此最佳料液比为1:6。
2.1.5 提取时间对提取率的影响

图5 提取时间对提取率的影响Fig.5 Effect of extraction time on extraction rate of proanthicyanidins
由图5可知,提取率随时间的延长逐渐增加,在100min时原花青素浸出率达到最大值,以后趋于稳定并逐渐下降,原因是随着反应时间的延长,原花青素被空气中的氧气氧化从而导致结构发生改变。
2.2 正交试验结果
经过分析极差(表3、4)得知,各因素对原花青素提取率大小的影响分别为C>B>A>D,最佳提取方案为温度60℃、乙醇体积分数70%、时间为120min、料液比为1:5。
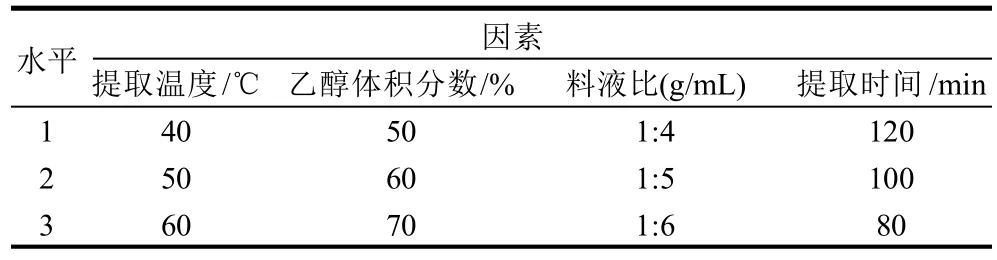
表3 山葡萄籽中提取原花青素提取工艺正交试验因素水平表Table 3 Factors and levels in orthogonal tests for optimizing the extraction process of proanthicyanidins

表4 山葡萄籽中提取原花青素提取工艺正交试验设计及结果Table 4 Results of orthogonal tests for optimizing the extraction process of proanthicyanidins
通过方差分析(表5)可知,4个因素的差异性非常显著,证明结果可靠,确定最佳提取工艺为温度60℃、体积分数70%、时间120min、料液比1:5。

表5 正交试验结果方差分析Table 5 Variance analysis

图6 样品色谱图Fig.6 HPLC chromatograms of proanthicyanidins extract from Amur grape seeds
精确称取3份质量为5.00g的脱脂山葡萄籽粉末,按照上述优化条件进行提取,原花青素提取率为3.12%,4种单体的总含量为0.52%,样品色谱图如图6所示。
其中没食子酸与表儿茶素没食子酸酯的含量为4种单体总含量的3.8%,葡萄籽提取物中,没食子酸与表儿茶素没食子酸酯的含量为4%~5%[15]。
3 结 论
对山葡萄种子提取物中黄烷-3-醇单体的色谱洗脱程序进行了优化选择,摸索出的流动相条件可以在短时间内实现单体物质的完全分离,为从山葡萄籽中进一步分离其他单体活性成分提供了基础。
通过正交试验确定山葡萄籽中原花青素的最佳提取工艺为提取温度60℃、乙醇体积分数70%、料液比1:5(g/mL)、提取时间120min,原花青素提取率为3.12%,单体提取率为0.52%。
葡萄籽中提取纯化原花青素的工艺技术已经成熟,山葡萄籽的开发和利用目前处于起步阶段,下一步的研究的方向应集中于对山葡萄籽提取物种的原花青素成分进行进一步的纯化研究以提高产品的纯度。
[1] 李凤英, 李润丰. 葡萄籽中主要化学成分及其开发应用[J]. 河北职业技术师范学院学报, 2002, 16(2): 65-17.
[2] DELLA-CASA C, FRALEONI A, COSTA-BIZZARRI P, et al. Synthesis and characterization of poly (3-alkylthiophenes) with NLO chromophoric groups in side chains[J]. Macromolecular Symposia, 2002,180(1): 217-221.
[3] 周素娟. 葡萄籽提取物原花青素的研究概况及其在我国保健食品中的应用[J]. 中国食品卫生杂志, 2007, 19(3): 284-286.
[4] 王军, 葛玉香, 包怡红. 东北山葡萄品种特性比较[J]. 东北林业大学学报, 2004, 32(1): 29-31.
[5] 高军涛, TANG Huiru, 侯京武, 等. 葡萄籽中多酚类物质对氧自由基清除作用的ESR研究[J]. 波谱学杂志, 1999, 16(5): 409-415.
[6] 赵晓英, 姚小曼. 葡萄籽提取物原花青素的营养保健作用[J]. 中国食品卫生杂志, 2000, 12(6): 38-41.
[7] BLAZSO G, GABOR M, ROHDEWALD P. Antiinflammatory activities of procyanidin-containing extract from Pinus rinaster Ait. after oral andcutaneousappoication[J]. Pharmazie, 1997, 52(5): 380-382.
[8] TAKAHASHI T, KAMIMURA A, YOKOO Y. Procyanidin B-2 and the hair-growing activity of proanthocyanidins[J]. Cosmetics and Toiletries,2001, 116(12): 61-72.
[9] 王军, 葛玉香, 包怡红. 东北山葡萄品种特性比较[J]. 东北林业大学学报, 2004, 32(1): 29-31.
[10] 王军. 我国山葡萄产业的发展与对策[J]. 特种经济动植物, 2000, 3(4): 2-3.
[11] 文君, 晓言. 山葡萄: 抗氧化天然保健食材新贵[N]. 中国食品报, 2004-02-09.
[12] 肖付才. 葡萄籽原花青素检测方法的研究[D]. 杨凌: 西北农林科技大学, 2007.
[13] 吕国红, 傅星. 葡萄籽中原花青素提取方法优化处理[J]. 生态学杂志, 2004, 23(5): 241-244.
[14] 魏富祥, 韩菊, 王改珍. 低聚原花青素提取技术研究[J]. 食品工业科技, 2003(9): 54-55.
[15] 郑俊霞, 肖付才, 李华. 香草醛-HPLC结合法测定葡萄籽超微粉中的原花青素[J]. 食品科技, 2010, 34(11): 304-308.
Optimization of Extraction Process for Proanthicyanidins from Amur Grape Seeds
WANG Xin-wei,ZHAO Ying,SHEN Yu-jie*
(Institute of Special Wild Economic Animal and Plant Science, Chinese Academy of Agricultural Sciences, Jinlin 132109, China)
Objective: To investigate the effects of temperature, time and ethanol concentration and material/liquid ratio on proanthicyanidins extraction from Amur grape seeds through single-factor and orthogonal tests and to explore the optimal extraction process. Methods: Ethanol was used for the extraction of proanthicyanidins. The total content of flavan-3-ol monomers and proanthicyanidins (both of them can be simultaneously extracted by ethanol) was determined by vanillin method,and the method used to determine the content of flavan-3-ol monomers was HPLC. Thus, the content of proanthicyanidins could be calculated as the difference between the two determined values. Results: The optimal extraction process conditions were extraction temperature of 60 ℃, ethanol concentration of 70%, extraction time of 120 min and material/liquid ratio of 1:5 (g/mL).Conclusion: Under the optimal extraction conditions, the extraction rate of proanthicyanidins from Amur grape seeds was up to 3.12%.
Amur grape seeds;proanthocyanidins;extraction;vanillin;HPLC
S663.1
A
1002-6630(2011)10-0021-04
2010-08-13
农业部作物种质资源保护项目(NB2010-2130135-36);国家现代农业产业技术体系建设专项(nycytx-30-01)
王新伟(1983—),男,硕士研究生,研究方向为经济植物种质资源评价与利用。E-mail:nhkswxw@126.com
*通信作者:沈育杰(1951—),男,研究员,本科,研究方向为抗寒葡萄育种和种质资源收集保护。E-mail:tcssyj@126.com

