啤酒中嘌呤的纯化及反相离子对色谱法测定的研究
何 炘,陈静波,刘绘景,刘 华
(浙江省饮用水质量检验中心,浙江杭州311700)
啤酒中嘌呤的纯化及反相离子对色谱法测定的研究
何 炘,陈静波,刘绘景,刘 华
(浙江省饮用水质量检验中心,浙江杭州311700)
利用反相离子对色谱法研究了啤酒中的鸟嘌呤、腺嘌呤、黄嘌呤和次黄嘌呤的测定方法。结果表明,当检测波长为254nm,流动相为0.02mol/L磷酸二氢钾缓冲液中加入1mmol/L的己烷磺酸钠,用磷酸调节流动相pH至3.6,用四元泵调节甲醇含量为3%(v/v),流速为1.0mL/min时,分离良好,方法精密度为1.21%~2.04%,测得四种嘌呤物质的回收率在95.97%~101.74%之间。对存在离子和非离子化合物的嘌呤而言,该方法较普通反相色谱法更具可行性。利用沉淀法纯化啤酒中的嘌呤后,所得色谱图几乎无干扰峰,使定量和定性工作简单、准确。
啤酒,嘌呤,反相离子对色谱,纯化
啤酒营养丰富,口感独特,为人们所喜欢。但啤酒中含有较高的嘌呤类物质,摄入太多容易引起嘌呤的代谢紊乱,从而引发痛风、血毒症等疾病。随着人们健康意识的提高,啤酒中的嘌呤含量也逐渐受到重视。啤酒中嘌呤类物质水解产物主要有鸟嘌呤、腺嘌呤、黄嘌呤和次黄嘌呤。目前啤酒中四种嘌呤含量的检测大都采用反相高效液相色谱法[1-2],而利用反相离子对色谱(RP-IPC)法检测啤酒中嘌呤含量的研究至今都鲜见报道。嘌呤类物质是两性弱电解质,其离解基团较多,这些基团在适当的pH下离解为阴离子或阳离子。在酸性溶液中,鸟嘌呤、腺嘌呤的氨基基团为弱阳离子,能与烷基磺酸类阴离子形成离子对[3]。本研究拟采用己烷磺酸钠作为离子对试剂分析酸性条件下嘌呤分离的色谱条件。在样品分析中,前处理是一个重要的组成部分。理想的样品处理方法应该简单、快速、回收率高,并能消除干扰。目前国内对于啤酒嘌呤检测的样品前处理都停留在嘌呤的提取步骤上,即酸水解,样品纯化步骤的研究未见报道。但是实际上,啤酒本身是一种发酵产物,成分复杂,酸水解后的一些小分子物质(如无机离子、糖、磷酸糖类、氨基酸、嘧啶)对嘌呤的分离有不同程度的干扰,直接进样对检测结果影响很大。从结构上看,嘌呤是含氮丰富的有机化合物,嘌呤环上的氮原子带有孤电子对,银离子有空的s轨道,可以接受氮原子上的孤对电子形成嘌呤银配离子。假设嘌呤用 P表示,该配离子可表示为[Ag(P)x]+,若溶液中有 OH-存在的话,它势必与OH-结合形成[Ag(P)x]OH,该化合物在碱性条件下易形成白色絮状沉淀,而在酸性条件下沉淀又会重新解离到溶液中[4]。本研究拟利用嘌呤的特异性沉淀反应,参照 N.E.Obispo[5]的方法,加以改进,从而纯化啤酒样品。
1 材料与方法
1.1 材料与仪器
鸟嘌呤(Gua)、腺嘌呤(Ade)、黄嘌呤(Xan)、次黄嘌呤(Hyp)标准样品 Sigma公司;甲醇 色谱纯;磷酸、磷酸二氢钾、己烷磺酸钠 优级纯;高氯酸、盐酸、硝酸银、磷酸二氢铵、氢氧化钠 分析纯;啤酒 当地市售;沉淀剂 100mL沉淀剂含0.6mL高氯酸,4.4mL 0.0285mol/L磷酸二氢铵,5mL 0.4mol/L硝酸银和90mL 0.2mol/L磷酸二氢铵。
LC1200高效液相色谱 包括Agilent1200系列在线真空脱气机、四元泵、紫外可变波长检测器、手动进样器和 LC系统化学工作站,Agilent公司;TDL-5-A离心机 上海安科仪器厂;HH-4数显恒温水浴锅 江苏江南仪器厂。
1.2 实验方法
1.2.1 嘌呤标样的制备 准确称取鸟嘌呤、腺嘌呤、黄嘌呤、次黄嘌呤100mg,用超纯水溶解后定容于100mL容量瓶中,制成1g/L的储备液(嘌呤不易溶于水可加入氢氧化钠或盐酸助溶),置于2~4℃冰箱中冷藏保存。
1.2.2 啤酒样品的提取 取200mL啤酒滴加1滴消泡剂进行消泡。取2mL消泡后的啤酒样品,加2mL 70%高氯酸,95℃恒温水浴水解1h。
1.2.3 啤酒样品的纯化 将啤酒水解液转移到25mL离心管中,加入1mL 0.4mol/L硝酸银和18mL 0.2mol/L磷酸二氢铵,振荡混匀,滴加40%(w/v)的氢氧化钠直至沉淀出现。将离心管置于离心机中,3000r/min下离心25min,小心吸掉上清液,离心管中沉淀加入10mL沉淀剂,混匀后3000r/min再次离心25min,小心吸掉上清液,离心管中沉淀加入8mL 0.5mol/L盐酸,充分混合,95℃恒温水浴 30min,3000r/min下离心25min,上清液定容至10mL容量瓶中,用0.45μm膜过滤,滤液进行高效液相色谱分析。
1.2.4 色谱条件 色谱柱:Waters Atlantis C18(4.6mm×250mm,5μm);流动相:0.02mol/L磷酸二氢钾缓冲液,加入1mmol/L己烷磺酸钠作为离子对试剂,用磷酸调节pH至3.6,用四元泵调节甲醇含量为3%(v/v),使用前用0.45μm膜过滤,并用超声波脱气15min;流量1.0mL/min,检测波长254nm,进样体积20μL,柱温25℃。
1.2.5 分析方法 用反相离子对色谱法检测啤酒中的嘌呤类物质,采用保留时间定性,峰面积外标法定量。啤酒中总嘌呤类物质含量=CGua+CAde+CXan+CHyp。
2 结果与讨论
2.1 色谱条件的选择
2.1.1 pH的影响 嘌呤类物质是两性弱电解质,在酸性溶液中,鸟嘌呤、腺嘌呤的氨基基团为阳离子,其pKa值分别为3.2和4.1。本研究中流动相采用0.02mol/L磷酸二氢钾缓冲液中加入5mmol/L己烷磺酸钠,以磷酸调节pH至3.4~6.4,所检出的三种嘌呤的保留时间见图1,腺嘌呤由于保留时间过长(大于60min)未做研究。如图1所示,在pH3.4~6.4间,黄嘌呤和次黄嘌呤的保留时间变化不大,鸟嘌呤的保留时间在pH小于4.2时快速增加,pH越低,保留时间越长。该结果表明,在pH4.2时鸟嘌呤部分氨基基团已转为阳离子,与己烷磺酸离子形成离子对而增大了保留时间,pH越低,越多的鸟嘌呤氨基基团转化为阳离子,从而保留时间越长。可以推测腺嘌呤具有相同的趋势。因此流动相的pH小于4.2比较合适。
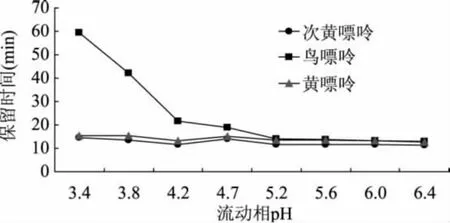
图1 流动相pH对保留时间的影响
2.1.2 有机溶剂的影响 由于pH小于4.2时,鸟嘌呤和腺嘌呤与己烷磺酸离子在流动相中形成离子对,其疏水性强,保留时间过长(见图1),有必要加入有机溶剂缩短保留时间。本研究中流动相采用
0.02 mol/L磷酸二氢钾缓冲液中加入1mmol/L己烷磺酸钠,用磷酸调节流动相pH至3.8,用四元泵调节甲醇含量,所检出的四种嘌呤的保留时间见图2。如图2所示,随着甲醇含量的增加,四种嘌呤的保留时间都缩短了,其中腺嘌呤最为明显。流动相中甲醇的含量太高,四种嘌呤的分离会变差,甲醇加入量在3%(v/v)比较合适。
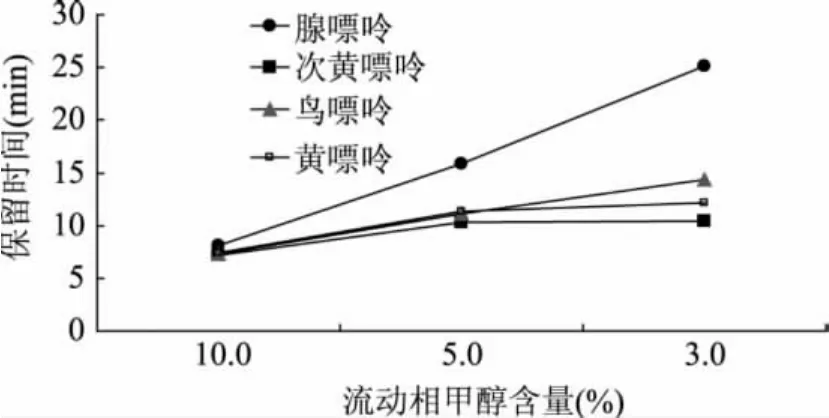
图2 甲醇浓度对保留时间的影响
2.1.3 己烷磺酸钠浓度对保留时间的影响 在烷基磺酸类离子对试剂中,己烷磺酸钠的疏水性居中。本研究中流动相采用0.02mol/L磷酸二氢钾缓冲液中加入不同浓度的己烷磺酸钠,用磷酸调节流动相pH至3.8,用四元泵调节甲醇含量为3%(v/v)。如图3所示,随着己烷磺酸钠浓度的增加,鸟嘌呤和腺嘌呤的保留时间增加,其中腺嘌呤最为明显,次黄嘌呤和黄嘌呤的保留时间变化不大。而且,己烷磺酸钠浓度太高,会造成分析时间过长,而浓度太低,也会造成鸟嘌呤的分离变差。因此采用1mmol/L的己烷磺酸钠比较合适。
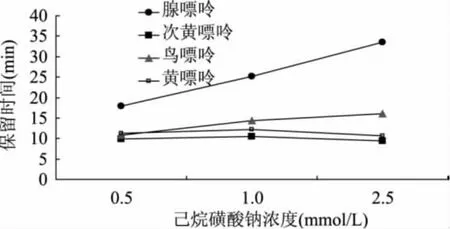
图3 己烷磺酸钠浓度对保留时间的影响
以下实验采用的流动相均为0.02mol/L磷酸二氢钾缓冲液中加入1mmol/L的己烷磺酸钠,用磷酸调节流动相pH到3.6,用四元泵调节甲醇含量为3%(v/v),四种嘌呤标样的液相色谱图见图4。
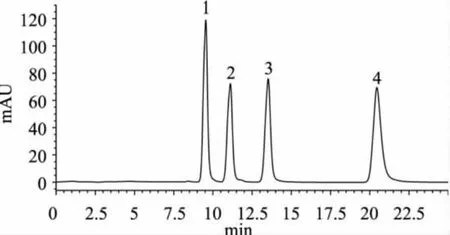
图4 四种嘌呤混合物标准样品色谱图
2.2 嘌吟标样的线性关系、线性范围和检出限
将四种嘌呤标样储备液进行梯度稀释,配制成50、25、10、5、1、0.5、0.1mg/L 不同质量浓度的样品标准溶液,在上述色谱条件下进行分析,以峰面积与样品浓度作线性回归,结果见表1。按信噪比3∶1计算检出限,由表1可以看出,在0.1~50mg/L范围内,浓度和峰面积呈很好的线性关系。
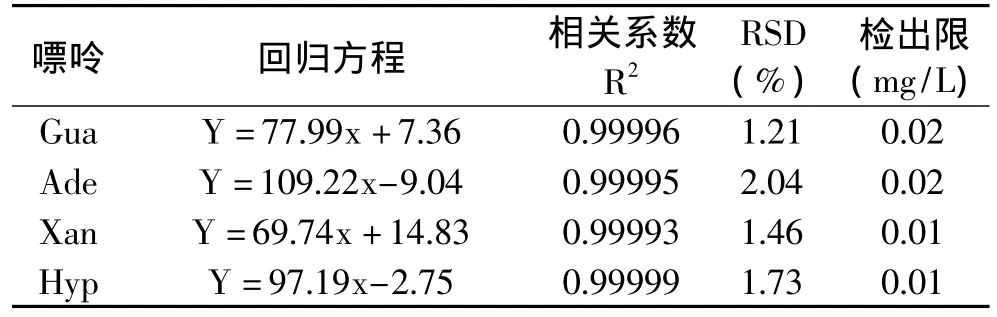
表1 RP-IPC法测定嘌呤的回归方程、相关系数和精密度(n=10)
2.3 精密度测定
取同一浓度的四种嘌呤混合标样,同一天连续进样10次测定精密度,结果用相对标准偏差(RSD)来表示,见表1。由表1可以看出,采用RP-IPC法测定该四种嘌呤重复性好,精密度高(RSD<3%)。
2.4 啤酒样品中嘌呤的纯化
N.E.Obispo纯化方法中磷酸二氢铵试剂的加入一方面是用于中和多余的银离子,形成黄色沉淀Ag3PO4;另一方面,沉淀量的增加有助于离心过程中[Ag(P)x]OH的全部沉淀。盐酸的选择主要是由于酸的加入使[Ag(P)x]OH中的银变为银离子,盐酸中的氯离子可与其反应生成白色沉淀将其从溶液中去除。但因其方法取样量小(0.1~0.5g),稀释倍数高(约100倍),方法限高,不利检测。本研究改进了该方法,加大了取样量(2mL),减少了稀释,并调整了相关的试剂量和步骤。啤酒样品纯化前后液相色谱图见图5、图6。比较图5和图6可以看出,啤酒样品纯化前每个嘌呤峰都有干扰峰,次黄嘌呤与一个大的干扰峰重叠,很容易造成误判,其他嘌呤峰定量也都非常困难。啤酒样品纯化后,除四种嘌呤峰外几乎无干扰峰,使定量和定性简单、准确。
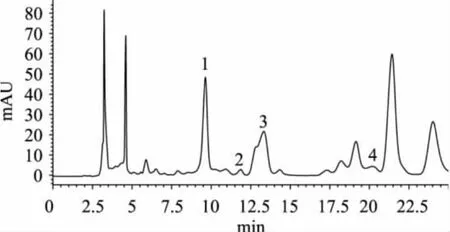
图5 啤酒样品纯化前色谱图
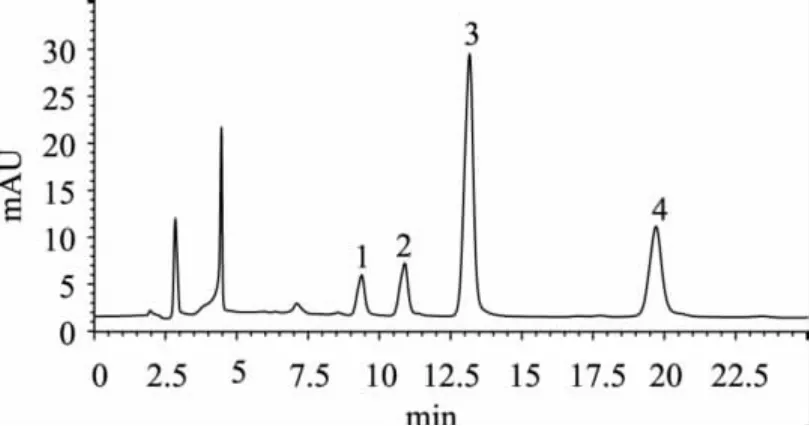
图6 啤酒样品纯化后色谱图
2.5 加标回收率实验
在已知含量的样品中加入不同质量浓度的四种嘌呤标样溶液,混合均匀,按上述方法和条件各测定10次,求回收率的平均值。
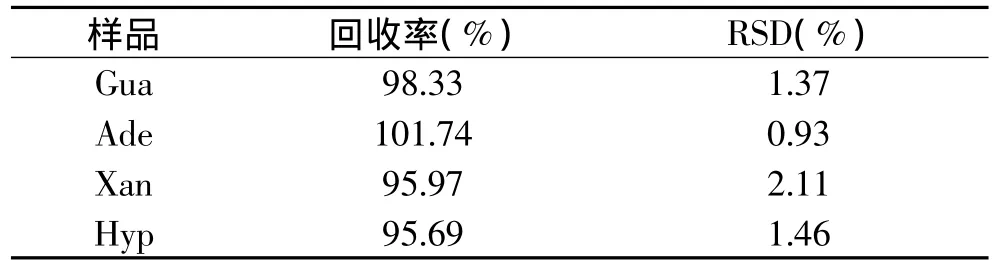
表2 回收率测定结果(n=10)
3 结论
在酸性条件下,利用反相离子对色谱法测定啤酒中的鸟嘌呤、腺嘌呤、黄嘌呤和次黄嘌呤。在该分离方法中,己烷磺酸钠是合适的离子对试剂,它可使嘌呤分离良好,方法精密度高。而利用嘌呤的特异性沉淀纯化啤酒中的嘌呤,消除了绝大多数啤酒基质成分的干扰,回收率高。
[1]李志良,张五九.高效液相色谱法测定麦汁、发酵液和啤酒中的嘌呤含量[J].分析与检测,2006,32(3):73-75.
[2]钟晓盈,陆幼兰.利用 HPLC测定啤酒嘌呤含量方法的研究[J].啤酒科技,2007(3):23-25.
[3]朱彭龄,云自厚,谢光华.现代液相色谱[M].兰州:兰州大学出版社,1989:150-160.
[4]侯志敏,刘玉杰,刘洪波.关于嘌呤碱鉴定实验异常现象的探讨[J].河北理科教学研究,2005(2):54-55.
[5]N E Obispo,B A Dehority.Feasibility of using total purines as a marker for ruminal bacteria[J].J Anim Sci,1999,77:3084-3095.
Study on purification of purines in beer and determination of purines compounds by reversed-phase ion pair chromatography
HE Xin,CHEN Jing-bo,LIU Hui-jing,LIU Hua
(Zhejiang Quality Testing Center for Drinking Water,Hangzhou 311700,China)
Four purines(Gua,Ade,Xan and Hyp)were separated and determined by reversed-phase ion pair chromatography.The optimized chromatography conditions were as following:254nm by UV detector with 0.02mol/L of KH2PO4buffer solution added 1mmol/L 1-Hexanesulfonic acid sodium(pH=3.6 regulated by H3PO4and methanol concentration=3%(v/v)regulated by quaternary pump)as mobile phase,and flow rate at 1.0mL/min.The average recoveries of four purines were 95.97%~101.74%,with the accuracy of the method as RSD of all four purines were 1.21%~2.04%.This method provided more feasibility than normal reversed-phase chromatography as to the purines including ion and non-ionic compound.The chromatography of beer sample was without interfering peak almost after beer sample purified by precipitation method,because of that determine the chemical composition and amount became simple and accurate.
beer;purine;reversed-phase ion pair chromatography;purification
TS207.3
A
1002-0306(2011)09-0420-03
2010-09-10
何炘(1980-),男,硕士研究生,主要从事食品化学分析工作。
浙江省质监系统科研计划项目(20090310)。

