高游离脂肪酸通过FOXO1途径抑制内皮祖细胞增殖并促进其凋亡*
陈 莉, 王红祥, 赵 湜, 李 娜, 张文静, 丁 胜
(武汉市中心医院内分泌科,湖北 武汉 430014)
高游离脂肪酸通过FOXO1途径抑制内皮祖细胞增殖并促进其凋亡*
陈 莉, 王红祥△, 赵 湜, 李 娜, 张文静, 丁 胜
(武汉市中心医院内分泌科,湖北 武汉 430014)
目的研究高游离脂肪酸(FFA)对糖尿病患者内皮祖细胞(EPCs)增殖及凋亡的影响,评价FFA在糖尿病血管并发症中的可能作用。方法分离培养2型糖尿病患者EPCs(DM组)和正常对照组EPCs(对照组),加入不同浓度(0、10和50 mmol/L)的FFA。MTT法检测EPCs增殖,Annexin-V/PI法检测其凋亡。RT-PCR法和Western blotting法检测核转录因子FOXO1的表达水平。结果随着FFA浓度的增加,DM组和对照组EPCs增殖率明显下降,而凋亡率明显增加,差异均显著(P<0.05)。相同FFA浓度下,DM组增殖率低于对照组(P<0.05)。随着FFA浓度的增加,DM组和对照组FOXO1的mRNA表达逐渐降低,差异显著(P<0.05)。结论高FFA可能通过FOXO1途径抑制EPCs增殖并诱导其凋亡,可能在糖尿病血管并发症的发生中发挥作用。
游离脂肪酸; 内皮祖细胞; 细胞增殖; 细胞凋亡; 叉头框O1蛋白
糖尿病是一种以高血糖为主要特征的代谢综合征。血管并发症是糖尿病的主要并发症之一,严重影响了糖尿病患者的生活质量,其发生与血管内皮细胞及其前体细胞内皮祖细胞(endothelial progenitor cells, EPCs)相关。高游离脂肪酸(free fatty acid,FFA)作为糖尿病血管并发症发生中的重要环节,对血管内皮细胞的作用已经有较多研究,但其对EPCs的影响及其机制均不清楚。为此,本研究将FFA作用于EPCs,观察其增殖及凋亡的变化,并检测核转录因子叉头框O1(forkhead box O1,FOXO1)蛋白的表达,以进一步了解糖尿病血管并发症中FFA所起的作用,为其防治提供实验依据。
材 料 和 方 法
1材料
M199培养基和胎牛血清购自Gibco。牛血清白蛋白(bouvine serum albumin, BSA)和叠氮化钠购自Sigma。25 cm2培养瓶及各种培养板、离心管均购自Corning。MTT购自华美生物工程公司。胰蛋白酶购自上海生工生物工程公司。淋巴细胞分离液购自上海生化试剂二厂(比重1.077)。人纤维连接蛋白(human fibronectin, HFN)购自Chemicon。血管内皮生长因子(vascular endothelial growth factor, VEGF)和碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)购自Peprotech。FITC标记抗CD34抗体和抗CD133抗体购自BD。Trizol购自Invitrogen,cDNA第1链合成试剂盒、TaqDNA聚合酶和dNTP购自Fermentas。引物由北京奥科公司合成。
2对象与分组
32例2型糖尿病患者(DM组)均符合1999年WHO糖尿病诊断及分型标准,男21例,女11例,平均年龄(45.1±11.7)岁,体重指数(26.3±12.5)kg/m2,糖尿病病程平均(14.8±8.4)年,糖化血红蛋白(8.2%±2.5%),其中吸烟13例。对照组20例为来院体检的健康人,男14例,女6例,平均年龄(44.4±10.2)岁,体重指数(24.2±8.7)kg/m2。2组年龄和体重指数经t检验,差异无显著(P>0.05)。2组均排除了各种感染、溃疡或近期手术等可能影响EPCs和导致周围血管并发症的情况[1]。
3FFA的配制
取棕榈酸,用乙醇配制成100 mmol/L的浓度;取牛血清白蛋白,用蒸馏水配制成10% BSA溶液;取50 μL 100 mmol/L棕榈酸溶液,加入上述10%BSA溶液中,在55 ℃水浴中静置15 min,直至溶液澄清,-20 ℃保存。临用前在55 ℃水浴放置至澄清。
4EPCs的培养
EPCs的培养及鉴定参照文献[2]。简述如下。取空腹外周静脉血15 mL,常规密度梯度离心法获取单个核细胞,并悬浮于5 mL M199 培养基(含20%胎牛血清、VEGF 10 μg/L、bFGF 2 μg/L、EGF 5 μg/L、青霉素1×105μ/L、链霉素100 mg/L)中,将其铺在纤维连接蛋白包被20 min的培养瓶内,37 ℃、饱和湿度、5%CO2温箱中培养4 d。然后以M199培养基轻轻洗去未贴壁细胞,继续以上述完全培养基培养至第7 d。将DiI-acLDL(2.4 mg/L)加入EPCs培养体系中,37 ℃孵育1 h。PBS洗涤3次后,加入FITC标记的UEA-I(10 mg/L),37 ℃继续孵育1 h。4%多聚甲醛固定10 min后于荧光显微镜下观察。FITC-UEA-I和DiI-acLDL双染色阳性细胞为正在分化的EPCs。
5EPCs增殖能力检测
分别收集对照组和糖尿病组的EPCs,调整细胞浓度后将等量EPCs接种到包被有HFN的96孔培养板中,加入FFA,使其浓度分别为0、10和50 mmol/L。以丝裂霉素C处理30min的相同来源的EPCs作为对照,培养20 h,然后每孔加10 μL MTT(5 g/L),孵育4 h后吸弃上清,每孔加入二甲基亚砜150 μL,振荡10 min,选择490 nm波长,在自动酶联检测仪上测定各孔的吸光度(absorbance,A)值,并计算增殖率。增殖率(%)=(A实验/A对照-1)×100%
6EPCs凋亡的检测
分别收集对照组和糖尿病组EPCs,与不同浓度FFA共培养48 h后,用PBS充分洗涤,胰酶消化后分别加入FITC标记的Annexin-V和PI溶液(操作按说明书进行),流式细胞仪检测,Cell Quest软件进行数据分析。Annexin-V阳性同时PI阴性的细胞计为早期凋亡细胞,将AnnexinV和PI均为阳性的细胞计为晚期凋亡细胞。计算细胞凋亡率。
7RT-PCR法检测FOXO1mRNA表达
Trizol一步法提取EPC总RNA,操作按说明书进行。紫外分光光度仪测定RNA的A260/A280值。逆转录反应体系为20 μL,其中5×逆转录缓冲液4 μL,核糖核酸酶抑制剂1 μL,10 mmol/L dNTPs 2 μL,寡聚T引物1 μL,细胞总RNA 2 μL,M-MLV(逆转录酶)1 μL,用焦碳酸二乙酯(DEPC)三蒸水补充至20 μL。反应条件为42 ℃ 1 h,然后70 ℃10 min以灭活逆转录酶。引物参照GenBank库中的cDNA序列进行设计。FOXO1:上游引物5'- GCAACGCGTGGGGCAACCTGT-3',下游引物5'- GGGCACGCTCTTCACCATCCACTC-3',扩增片段116 bp。β-actin:上游引物5'- GTGGGGCGCCCCAGGCACCA -3',下游引物5'- CTCCTTAATGTCACGCACGATTTC -3',扩增片段540 bp。反应体系25 μL,其中10×PCR缓冲液2.5 μL,cDNA2 μL,TaqDNA 聚合酶1 μL(1 U),10 mmol/L dNTP 0.5 μL,0.2 μmol/L FOXO1及β-actin上游及下游引物各1 μL,25 μmol/L MgCl2溶液2 μL。扩增条件:首次94 ℃预变性5 min,94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1 min,循环33次,最后72 ℃ 10 min。取扩增产物5 μL,用2%的琼脂糖凝胶(溴化乙啶浓度为0.5 mg/L)电泳,100 bp DNA为分子量标准,在300 nm紫外光下摄影。
8Westernblotting法检测FOXO1蛋白表达
应用TriPure提取蛋白法提取DM组和对照组EPCs蛋白,定量为2 g/L,每泳道点样20 μg提取蛋白,经10% SDS-聚丙烯酰胺凝胶电泳1 h,转膜,经脱脂奶粉封闭后,分别加入小鼠抗人FOXO1单克隆抗体(1∶100)和小鼠抗人β-actin抗体(1∶2 000),4 ℃孵育过夜,再加入兔抗小鼠IgG(1∶5 000)孵育1 h,最后经ECL系统曝光显影,通过凝胶分析系统分析蛋白的表达。
9统计学处理
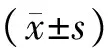
结 果
1EPCs增殖率的检测
与未加FFA组相比,随着FFA浓度的增加,DM组和对照组EPCs增殖率均明显下降,差异显著(P<0.05)。而相同FFA浓度下,DM组增殖率低于对照组(P<0.05),见表1。
表1不同浓度的FFA对DM组和对照组EPCs增殖率的影响


GroupnFFA(mmol/L)01050Control2017.8±3.214.3±3.7∗∗9.4±2.6∗∗DM3215.2±3.110.4±3.5∗∗△△5.5±2.4∗∗△△
**P<0.01vsFFA 0 mmol/L;△△P<0.01vscontrol.
2EPCs凋亡的检测
随着FFA浓度的增加,DM组和对照组EPCs早期和晚期凋亡率均增加,差异显著(P<0.05)。而相同FFA浓度下,DM组早期和晚期凋亡率亦高于对照组,差异显著(P<0.05),见表2。
表2不同浓度的FFA对DM组和对照组EPCs凋亡率的影响


GroupnApoptotictypeFFA(mmol/L)01050Control20Early3.6±1.65.5±3.0∗∗11.3±6.1∗∗Late4.7±2.46.3±3.6∗∗10.2±3.2∗∗DM32Early4.1±2.06.5±2.8∗∗14.5±5.4∗∗△Late3.2±1.18.8±3.4∗∗△12.3±5.0∗∗△
**P<0.01vsFFA 0 mmol/L;△P<0.05vscontrol.
3FOXO1的mRNA和蛋白表达
RT-PCR法检测发现,随着FFA浓度的增加,DM组和对照组FOXO1的mRNA表达逐渐降低,差异显著(P<0.05),见表3、图1。Western blotting法检测发现,随着FFA浓度的增加,FOXO1蛋白表达逐渐下降,见表4、图2。
表3不同浓度的FFA对DM组和对照组EPCs中FOXO1mRNA表达的影响


GroupnFFA(mmol/L)01050Control200.90±0.110.65±0.09∗∗0.41±0.14∗∗DM320.80±0.130.52±0.11∗∗0.31±0.20∗∗
**P<0.01vsFFA 0 mmol/L.

Figure 1. Expression of FOXO1 mRNA in EPCs treated with various concentrations of FFA (Lane 1, 4: 0 mmol/L; Lane 2, 5: 10 mmol/L; Lane 3, 6: 50 mmol/L) in control group (Lane 1-3) and DM group (Lane 4-6). M: 100 bp DNA marker from 100 to 600 bp.
图1不同浓度的FFA对EPCs中FOXO1mRNA表达的影响
表4不同浓度的FFA对DM组EPCs中FOXO1蛋白表达的影响


FFA(mmol/L)FOXO1/β-actin00.85±0.17100.47±0.15∗500.22±0.12∗
*P<0.05vsFFA 0 mmol/L.

Figure 2. Expression of FOXO1 protein in EPCs treated with various concentrations of FFA in DM group.
图2不同浓度的FFA对DM组EPCs中FOXO1蛋白表达的影响
讨 论
本研究将FFA作用于糖尿病患者EPCs,观察对其增殖、凋亡的影响,结果发现,FFA可抑制EPCs增殖,促进其凋亡,且这些作用具有剂量依赖性。FFA是细胞膜脂质结构和前列腺素合成的供体,也是脂肪代谢的中间产物。许多研究表明高脂饮食诱导的胰岛素抵抗在糖尿病的发生中起到重要作用[3],但FFA与糖尿病周围血管病的关系研究较少。而糖尿病周围血管病作为糖尿病的一种慢性并发症,其发生与EPCs关系密切[4]。本研究结果显示,FFA可抑制EPCs的增殖,在糖尿病周围血管病的发生发展中起到一定作用。
在脂肪和肌肉组织中,过氧化物酶增殖体激活受体(peroxisome proliferator-activated receptors,PPAR)家族和FOXO家族是维持血糖稳定和胰岛素敏感性的2个关键转录因子家族[5]。FOXO转录因子位于细胞核内,在没有胰岛素存在情况下能够促进细胞内葡萄糖合成关键酶的合成,而在胰岛素的作用下,通过磷脂酰肌醇3-激酶/蛋白激酶B (phosphatidylinositol 3-kinase/protein kinase B,PI3K/Akt)途径,磷酸化后移出细胞核,阻断其促进葡萄糖生成酶的作用,从而中止葡萄糖的合成[6]。FOXO转录因子还在氧化应激[7-9]和清除自由基方面发挥作用[10,11],其下游基因包括保护细胞免受过氧化的锰超氧化物歧化酶(manganese superoxide dismutase,MnSOD)等[12]。2型糖尿病患者体内一般存在高FFA,这种状态对糖尿病患者的心肌细胞功能可造成不良影响[13],还有报道高FFA可抑制脂肪细胞表达FOXO1[14],但对EPCs的作用尚未见报道。
为此,我们研究了在高FFA作用下EPCs表达FOXO1的情况,结果发现,随着FFA浓度的增加,EPCs中FOXO1的表达逐渐减低。FFA增加,线粒体内游离自由基的合成也随之增加,氧化应激增强;同时FOXO1表达减弱,下游清除自由基的分子如MnSOD合成减少,两方面综合作用,可能损害EPCs。还有研究发现,FOXO的功能与周围血管功能密切相关。当缺乏FOXO时,血管内皮细胞失去了对VEGF的反应性[15],且血管平滑肌细胞持续增殖,使血管压力增高,从而导致血管内皮受损[16]。本研究结果还提示,高FFA情况下,EPCs的凋亡也增加,因此FOXO表达减弱是由于EPCs凋亡增加引起,还是由于FFA的直接作用,尚待进一步探讨。
[1] Ishikawa M, Asahara T. Endothelial progenitor cell culture for vascular regeneration[J]. Stem Cells Dev, 2004, 13(4):344-349.
[2] 王红祥, 赵 湜, 李宾公, 等. 高糖对糖尿病患者内皮祖细胞增殖凋亡的影响及其机制探讨[J]. 中国病理生理杂志, 2007, 23(11): 2210-2213.
[3] Ohmura E, Hosaka D, Yazawa M, et al. Association of free fatty acids (FFA) and tumor necrosis factor-α(TNF-α) and insulin-resistant metabolic disorder[J]. Horm Metab Res, 2007, 39(3): 212-217.
[4] Loomans CJ, de Koning EJ, Staal FJ, et al. Endothelial progenitor cell dysfunction: a novel concept in the pathogenesis of vascular complications of type 1 diabetes[J]. Diabetes, 2004, 53(1): 195-199.
[5] Armoni M, Harel C, Karnieli E. Transcriptional regulation of theGLUT4 gene: from PPAR-γ and FOXO1 to FFA and inflammation[J]. Trends Endocrinol Metab, 2007, 18(3): 100-107.
[6] Gross DN, Wan M, Birnbaum MJ. The role of FOXO in the regulation of metabolism[J]. Curr Diab Rep, 2009, 9(3):208-214.
[7] Furukawa-Hibi Y, Yoshida-Araki K, Ohta T, et al. FOXO forkhead transcription factors induce G2-M checkpoint in response to oxidative stress[J]. J Biol Chem, 2002, 277(30): 26729-26732.
[8] Kops GJ, Dansen TB, Polderman PE, et al. Forkhead transcription factor FOXO3a protects quiescent cells from oxidative stress[J]. Nature, 2002, 419(6904): 316-321.
[9] Salih DA, Brunet A. FoxO transcription factors in the maintenance of cellular homeostasis during aging[J]. Curr Opin Cell Biol, 2008, 20(2):126-136.
[10]Nemoto S, Fergusson MM, Finkel T. Nutrient availability regulates SIRT1 through a forkhead-dependent pathway[J]. Science, 2004, 306(5704): 2105-2108.
[11]Furuyama T, Kitayama K, Yamashita H, et al. Forkhead transcription factor FOXO1 (FKHR)-dependent induction ofPDK4 gene expression in skeletal muscle during energy deprivation[J]. Biochem J, 2003, 375(Pt 2): 365-371.
[12]Schuur ER,Loktev AV,Sharma M,et al.Ligand-dependent interaction of estrogen receptor-α with members of the forkhead transcription factor family[J].J Biol Chem, 2001,276(36):33554-33560.
[13]Boudina S, Abel ED. Diabetic cardiomyopathy, causes and effects[J]. Rev Endocr Metab Disord, 2010, 11(1):31-39.
[14]Subauste AR, Burant CF. Role of FoxO1 in FFA-induced oxidative stress in adipocytes[J]. Am J Physiol Endocrinol Metab, 2007, 293(1): E159-E164.
[15]Furuyama T, Kitayama K, Shimoda Y, et al. Abnormal angiogenesis inFoxo1 (Fkhr)-deficient mice[J]. J Biol,Chem, 2004, 279(33):34741-34749.
[16]Goettsch W, Gryczka C, Korff T, et al. Flow-dependent regulation of angiopoietin-2[J]. J Cell Physiol, 2008, 214(2): 491-503.
FreefattyacidinhibitsproliferationandpromotesapoptosisofendothelialprogenitorcellsviaFOXO1pathway
CHEN Li, WANG Hong-xiang, ZHAO Shi, LI Na, ZHANG Wen-jing, DING Sheng
(DepartmentofEndocrinology,WuhanCentralHospital,Wuhan430014,China.E-mail:whitely1972@sina.com)
AIM: To investigate the effect of free fatty acid (FFA) on endothelial progenitor cells (EPCs), and to elucidate the role of FFA in the pathogenesis of diabetic peripheral vascular disease.METHODSEPCs were isolated from the patients with type 2 diabetes mellitus (DM group) and normal healthy persons (control group). Various concentrations of FFA were added to the culturing system. MTT assay was used to detect the proliferative rate. Apoptotic rate of EPCs was measured by Annexin V/PI assay. The expression of FOXO1 was determined by RT-PCR and Western blotting.RESULTSIn a dose-dependent manner, FFA attenuated the proliferative activity of EPCs in both control group and DM group, while increased the apoptotic rates (P<0.05). The expression of FOXO1 decreased under the condition of FFA exposure and the difference was significant (P<0.05).CONCLUSIONFFA may be a new factor in the pathogenesis of diabetic peripheral vascular disease through FOXO1 pathway.
Free fatty acids; Endothelial progenitor Cells; cell proliferation; Apoptosis; Forkhead box O1 protein
R363
A
1000-4718(2011)08-1615-04
2010-12-16
2011-06-20
湖北省卫生厅科研资助项目(No. JX3A24)
△通讯作者Tel:027-82211474;E-mail: whitely1972@sina.com
10.3969/j.issn.1000-4718.2011.08.029

