胆红素和内毒素联合作用对NRK52E细胞缝隙连接功能的影响
田 野, 庞红宇, 孙国亮, 李晓芸, 位 静, 黑子清△
(1中山市人民医院麻醉科,广东中山528403;2中山大学附属第三医院麻醉科,广东广州510630)
肝移植术后早期急性肾功能衰竭(acute renal failure,ARF)发生率为 8.3% - 87.0%[1-5],病死率可高达12.3% -72.2%[6-8],是肝移植术后早期死亡的主要原因之一[9]。肝移植术后发生ARF的患者术前均有不同程度的内毒素血症和高胆红素血症病史。现有研究证实,内毒素血症与ARF的发生密切相关[10]。我们的研究证实胆红素增高是引起肝移植ARF危险因素之一。然而在肝移植ARF的发生过程中,胆红素(bilirubin,BR)和内毒素(lipopolysaccharide,LPS)的相互关系尚不清楚。
缝隙连接(gap junction,GJ)广泛存在于实质性脏器(如心脏、肝脏、肾脏等)组织中,GJ沟通相邻细胞的胞浆,细胞浆中分子量<1 kD的物质(如离子、细胞信号分子和代谢物质等)可通过GJ扩散、转运到与其毗邻的细胞浆。GJ具有传导快、阻抗低的特点,参与细胞活动的协调及信息的传递,参与机体多种重要生理机能的调节。肾小管上皮细胞之间存在着广泛的 GJ[11]。
在急性肾损伤过程中肾小管上皮细胞是主要受损的肾实质细胞[12]。我们的前期研究已证实胆红素的肾小管上皮细胞毒性与GJ有关[13],在此基础上,本研究拟通过培养肾小管上皮细胞形成高密度集落,观察BR和LPS联合作用下肾小管上皮细胞的生长活性及细胞间GJ功能改变,有助于了解BR和LPS通过GJ途径参与肝移植ARF的发生机制。
材料和方法
1 试剂
胎牛血清和 DMEM-F12培养基(Gibco),0.25%胰酶(Gibco),双抗(Gibco),LPS(Sigma),oleamide(Invitrogen),MTT(Amresco),荧光试剂calcine-AM和DiI-CM(Invitrogen),二甲基亚砜(dimethyl sulfoxide,DMSO)(Invitrogen),结晶紫(Sigma),NaOH(Sigma)。
2 主要试剂的配制
BR试剂配制:避光称取晶体 BR 100 mg,用1 mL 1 mol/L NaOH溶解,加入9 mL超纯水,1 mol/L HCl调至pH 7.4。根据要求配制成对照组、BR组(17.1 μmol/L、85.5 μmol/L、171 μmol/L、342 μmol/L、513 μmol/L、684 μmol/L、855 μmol/L、1 026 μmol/L)。
LPS储存液(100 mg/L):0.1 mg溶于1 mL超纯水中,分装100 μL于EP管 内,-20℃冻存。根据要求配成 10 μg/L、50 μg/L、100 μg/L、500 μg/L、1 000 μg/L。
3 实验分组
(1)正常对照组(control组):用含10%FBS的培养基培养细胞;(2)胆红素组(BR组):分为:17.1 μmol/L、85.5 μmol/L、171 μmol/L、342 μmol/L、513 μmol/L、684 μmol/L、855 μmol/L 和1 026 μmol/L共8个亚组;(3)内毒素组(LPS组):分为:10 μg/L、50 μg/L、100 μg/L、500 μg/L、1 000 μg/L 5 个亚组;(4)胆红素+内毒素组(BR+LPS组):分为:100 μg/L LPS+17.1 μmol/L BR;100 μg/L LPS+513 μmol/L BR;100 μg/L LPS+684 μmol/L BR 3 个亚组。
4 方法
4.1 大鼠近端肾小管上皮细胞(NRK52E cells)的培养 NRK52E细胞由中山大学附属第一医院余学清教授惠赠,NRK52E细胞具有正常人类肾小管上皮细胞的特性。NRK52E细胞用含10%胎牛血清的青-链霉素的DMEM-F12培养液中,并置于37℃、5%CO2培养箱中传代培养。
4.2 MTT法测生长活性 用含10%胎牛血清的培养液将NRK52E细胞配成单个细胞悬液,以每孔10 000个细胞的密度接种到96孔板,每孔体积200 μL,每组设5个复孔。NRK52E细胞在96孔板中贴壁(24 h)后加入不同浓度BR及LPS,于37℃、5%CO2培养箱中常规培养24 h,每孔避光加入MTT溶液[5 g/L,用 PBS(pH 7.4)配制]20 μL,继续孵育 4 h,终止培养,小心吸弃孔内培养上清液,每孔加150 μL DMSO,振荡10 min,使结晶物充分融解。在酶联免疫监测仪上测定各孔光吸收值,选择490 nm波长,同时设置空白孔(含培养基、MTT、DMSO),记录每孔

4.3 NRK52E细胞的集落形成率 采用Glazer报道的“标准细胞集落形成分析法”[7]测定BR及LPS对NRK52E细胞集落形成的作用,用不同密度接种细胞的方法获得生长融合的细胞(已形成GJ)和生长未融合的细胞(无形成GJ)。该实验反映单个细胞的增殖潜力,能较灵敏地测定BR及LPS对细胞增殖能力的影响。
NRK52E细胞用0.25%胰酶消化后以8×108cells/L接种于6孔板,培养48 h后换为无血清培养基培养,24 h后吸弃培养基,PBS冲洗1次。每孔细胞加入2 mL培养液,分别加入25 μmol/L oleamide不同剂量BR、LPS,置于培养箱中24 h后吸弃药液,PBS洗2次。将每孔细胞用胰酶消化,做成单个细胞悬液,用细胞培养液中止消化,细胞计数,分别稀释成5×105cells/L的细胞悬浮液。按2 mL/well接种到6孔培养板,置于5%CO2,37℃培养箱中培养。3-5 d后计数细胞集落数(>50个细胞/集落)。

4.4 NRK52E细胞间GJ的荧光传递 用细胞接种荧光示踪法,将NRK52E细胞与荧光指示剂calcine-AM和DiI-CM共同孵育,使calcine-AM和DiI-CM进入细胞。该细胞被称为“供体细胞”(donor cell)。将“供体细胞”接种到已生长融合的细胞(“接受细胞”,receiver cells)上,培养4 h。待形成稳定的GJ后,用显微荧光系统观察,记录GJ功能。小分子的calcine(发绿色荧光)可以通过GJ进入相邻的“接受细胞”;但大分子的DiI(发红色荧光)不能自由通过GJ而留在“供体细胞”内,使之易于识别。计数1个“供体细胞”周围含有calcine的“接受细胞”作为GJ功能指标。通过此方法可以直接测定信号传递情况。
将NRK52E细胞按1.0×108cells/L的密度接种到6孔板,置于5%CO2、37℃培养箱中培养48 h后进行如下实验。在calcein-AM 50 μg/支和CM- DiI 50 μg/支中分别加入 DMSO 10 μL 溶解,分别取5 μL calcein- AM 和 10 μL CM - DiI加入 1 mL的无血清培养基混匀,calcein-AM的终浓度为25 μmol/L,CM -DiI的终浓度为 50 μmol/L ,作为负载液。取1孔细胞,吸去培养液,PBS洗1次。加入上述负载液1 mL。置于5%CO2,37℃培养箱中培养30 min。吸去负载液,PBS冲洗 5 min×3次。用0.25%胰酶消化,加入无血清培养基中止消化。稀释至8×105cells/L,制成“供体细胞”液 。在“供体细胞”液中加入实验药物,制备成不同浓度的药液。在显微镜下挑选已融合(有GJ形成)的细胞作为接受细胞,移去培养液,PBS冲洗1次。分别加入已配制好的不同药物浓度的“供体细胞”液,1 mL/well。置于5%CO2、37℃培养箱中培养4 h。形成稳定的GJ后,用荧光显微镜观察。
5 统计学处理
结 果
1 LPS对NRK52E细胞生长的作用
结果显示,LPS(10 -1 000 μg/L)作用于NRK52E细胞24 h能浓度依赖性地降低NRK52E细胞的生存率,见图1,与对照组相比,当 LPS从10 μg/L增加至1 000 μg/L时,使NRK52E细胞生存率降低27%-60%。说明随着LPS浓度增加,其细胞毒性逐渐增强。

Figure 1.The survival rate of NRK52E cells after treated with LPS for 24 h.±s.n=3.*P<0.05 vs LPS 10 μg/L.图1 LPS作用于NRK52E细胞24 h细胞存活率的变化
2 BR对NRK52E细胞生长的作用
不同浓度的 BR(17.1-1 026 μmol/L)作用NRK52E细胞24 h后,MTT法测定的细胞生长结果见图2。BR浓度从17.1 μmol/L增加至513 μmol/L时,可浓度依赖性地增加细胞生长。BR 513 μmol/L的细胞存活率为110%,与对照组相比增加46%。当浓度继续增加时,BR增加细胞生长的作用减弱;BR 1 026 μmol/L的细胞存活率为57%,与对照组相比降低24%,显著差异(P<0.05)。
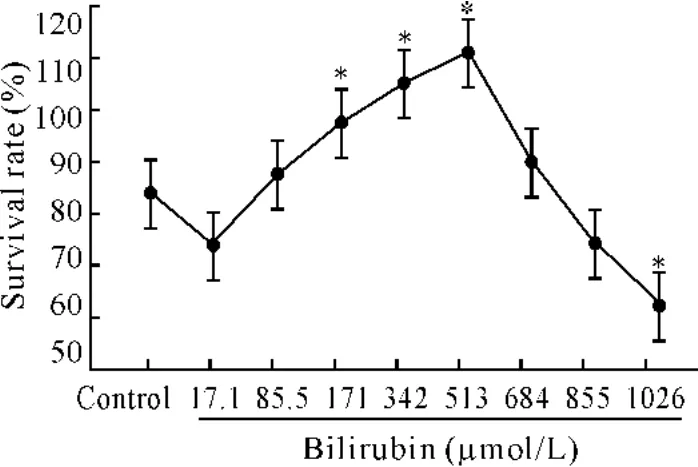
Figure 2.The survival rate of NRK52E cells after treated with BR for 24 h.±s.n=3.*P<0.05 vs control.图2 BR作用于NRK52E细胞24 h细胞存活率的变化
3 BR和LPS联用对NRK52E细胞生长的作用
与单纯 LPS组相比,17.1 μmol/L BR不影响100 μg/L LPS 对细胞生长的作用,513 μmol/L BR 增加100 μg/L LPS作用下的细胞生长(P<0.05);684 μmol/L BR降低 100 μg/L LPS作用下的细胞生长(P<0.05)。结果表明 BR在一定范围内(<513 μmol/L)可以降低LPS的细胞毒性,BR超过这一范围时却增加了LPS的细胞毒性,见图3。
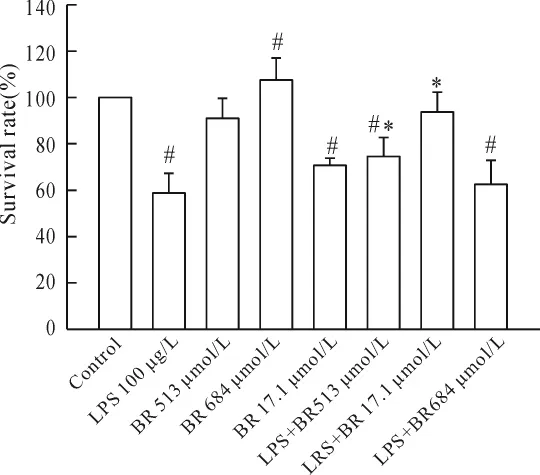
Figure 3.The survival rate of NRK52E cells after treated with LPS and BR for 24h.*P <0.05 vs LPS 100 μg/L;#P<0.05 vs control.图3 LPS和BR联合作用于NRK52E细胞24 h细胞存活率变化
4 BR和LPS对NRK52E细胞集落形成的影响
生长融合的细胞经100 μg/L LPS处理后细胞集落形成率均显著低于生长未融合的细胞,513 μmol/L BR处理后生长融合细胞集落形成率高于生长未融合的细胞,684 μmol/L BR处理后细胞集落形成率低于生长未融合的细胞,见图4。以上结果显示生长融合的细胞和生长未融合的细胞集落形成率有显著差异,说明生长融合的细胞形成GJ后,通过GJ信号传递影响了LPS和BR对细胞生长的作用。
5 BR和LPS联合作用对NRK52E集落形成率的影响
在生长融合的细胞,513 μmol/L BR显著增加100 μg/L LPS作用下的细胞集落形成率,684 μmol/L BR降低了100 μg/L LPS作用下的细胞集落形成率,P <0.05,见图4。
6 BR和LPS对NRK52E细胞缝隙连接荧光传递的影响
与对照组相比,100 μg/L LPS能够显著降低calcine通过GJ在细胞之间的传递(P<0.05);17.1 μmol/LBR对LPS作用下的GJ传递影响不大,BR在513 μmol/L通过GJ在细胞荧光传递有明显增加(P<0.05),684 μmol/L BR明显降低LPS作用下的荧光传递,见图5、6。结果说明,BR在一定范围内(<513 μmol/L)可以增加LPS作用下的细胞荧光传递,BR超过这一范围时,降低了LPS作用下的NRK52E细胞荧光传递。
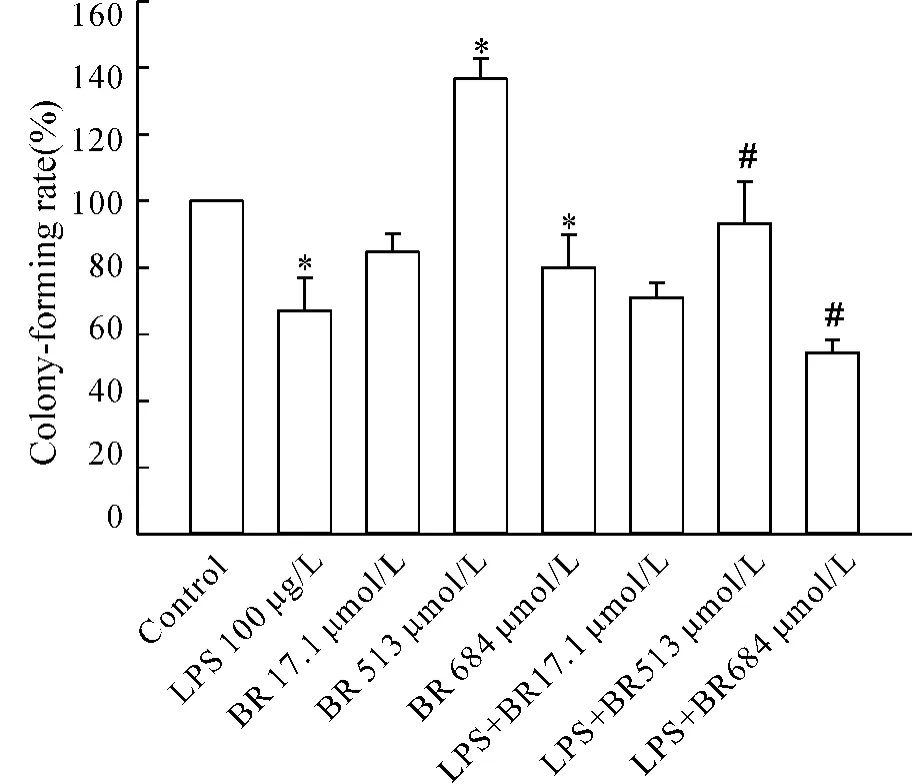
Figure 4.The colong-forming rate of NRK52E cells after treated with LPS and BR.±s.n=3.#P<0.05 vs LPS 100 μg/L;*P < 0.05 vs control.图4 LPS加BR对NRK52E细胞集落形成率的影响
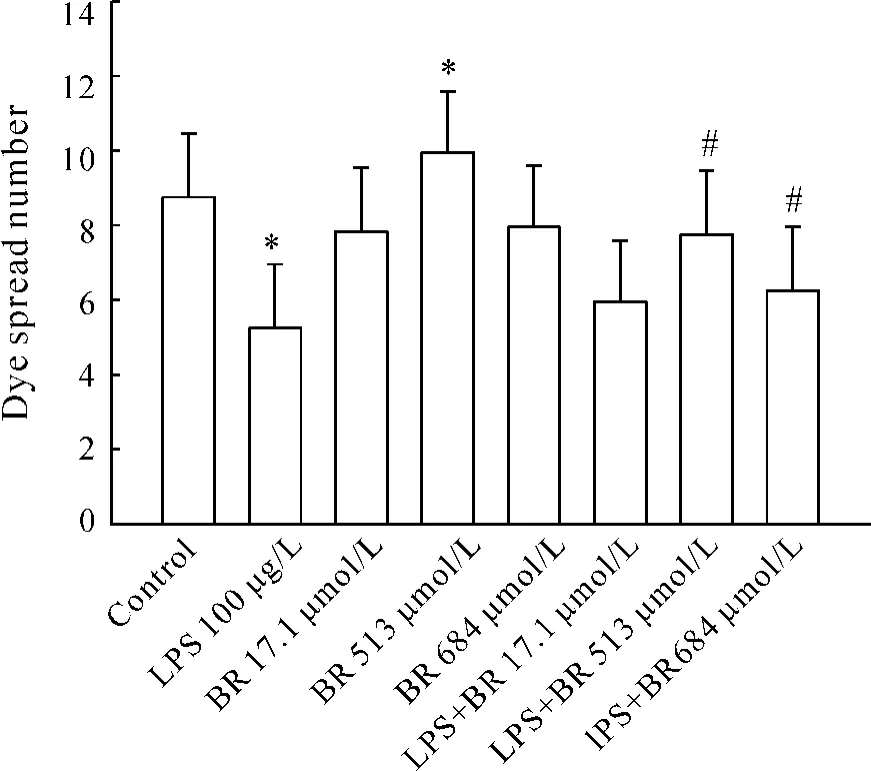
Figure 5.The number of dye spread through gap junction between NRK52E cells.#P <0.05 vs LPS 100 μg/L;*P<0.05 vs control.图5 染料通过NRK52E细胞间隙的数量
讨 论
肝移植术后急性肾功能衰竭是影响肝移植手术预后的严重并发症之一,许多研究已证实单纯内毒素血症对肾小管上皮细胞的毒性作用,同时高胆红素血症对肾小管上皮细胞有保护和损伤的双重作用,而肝移植手术患者BR及LPS均有不同程度的升高,观察BR及LPS联合作用下对肾小管上皮细胞的影响对于临床如何调控BR及LPS从而减少肝移植术后肾功能损伤有重要意义。

Figure 6.The dye coupling through GJ between NRK52E cells after treated with LPS and BR for 24 h,as shown by parachute dye coupling assay(× 200).A:control group;B:100 μg/L LPS;C:513 μmol/L BR;D:513 μmol/L BR+100 μg/L LPS.图6 LPS和BR作用于NRK52E细胞24 h对染料通过细胞间隙的影响
本研究发现,BR在一定范围内(17.1-513 μmol/L)对NRK52E细胞生长呈促进作用,随着浓度增加作用增强;BR超过513 μmol/L抑制了NRK52E细胞的生长,呈现为细胞毒性。这一结果表明BR对细胞有保护或损伤的双重作用,BR的浓度是决定因素。随着 LPS浓度的增加(10-1 000 μg/L),NRK52E细胞的生长逐渐降低,表明LPS对NRK52E细胞的毒性作用随着浓度增加而增加。
根据BR和LPS对NRK52E细胞生长的观察,我们选择17.1 μmol/L 、513 μmol/L 和684 μmol/L BR分别与100 μg/L LPS联合应用,观察联合应用后对细胞生长的影响,结果发现513 μmol/L BR降低了LPS的细胞毒性,更高浓度BR(684 μmol/L)增强了LPS的细胞毒性。这些结果进一步证实,BR在一定浓度范围能减轻LPS的细胞毒性,呈现肾保护效应。动物实验、体外和人体实验均已证实BR能够抑制脂质氧化及氧自由基的形成,清除氧自由基,抑制免疫反应及炎症反应[14]。BR对脏器的作用与自身浓度有关,研究报道5 μmol/L的BR溶液可以完全抑制500 μmol/L 的 H2O2对肾造成的损伤[15];这些结果能帮助我们解释低于513 μmol/L BR促进细胞生长及减轻内毒素肾小管上皮细胞毒性的原因。
GJ是细胞间主要的联系方式,直接参与细胞生命活动,对调节机体组织的内稳态起重要的作用。研究证明[11],肾小管细胞有丰富的GJ;其中肾小管上皮细胞表达 Cx43[16]。Yaoita 等[17]使用氨基核苷嘌呤霉素注射6 h造成肾损害,Cx43表达增强,提示GJ参与了肾损伤。GJ是否同样参与了BR和LPS引起的NRK52E细胞的细胞毒性,我们将从这一途径阐述这一问题。
生长融合细胞(细胞形成紧密连接,已形成GJ)和生长未融合的细胞(因细胞无接触,细胞间无法形成GJ),研究集落形成率的差异可以帮助分析细胞间相互影响。我们的结果表明,BR和LPS作用下,生长融合的细胞与生长未融合细胞集落形成率存在差异,提示GJ的形成与BR和LPS作用下的细胞活性有关,说明生长融合细胞间产生相互影响;513 μmol/L BR增加了LPS作用下高密度集落形成率,684 μmol/L BR降低了LPS作用下高密度集落形成率,提示BR有可能通过GJ信号传递影响LPS的细胞毒性作用。
细胞接种荧光示踪法是检测GJ功能的特异方法,可以直接观察到生长融合细胞间的信号传递情况。我们的结果显示,LPS降低了细胞荧光传递数目,513 μmol/L BR增加细胞荧光传递,能增加LPS作用下的荧光数目。684 μmol/L BR降低了细胞荧光传递数目,能协同降低LPS作用下的荧光传递。这些结果为 BR和 LPS通过 GJ信号传递影响NRK52E细胞活性提供了直接证据,两者间的相互作用可能与细胞间GJ功能有关。
我们根据临床肝移植术后病人BR升高的程度进行分段,BR和LPS联合作用时,513 μmol/L BR降低了LPS的肾小管上皮细胞毒性,684 μmol/L BR增加了LPS的肾小管上皮细胞毒性,肝移植手术病人应降低LPS的水平,而BR水平在一定范围内对肾小管上皮细胞有保护作用,超过这一范围呈现损伤作用,提示临床肝移植手术后对于BR过高的患者,注意分清增高的程度,分级别对待,防止片面的一味降低BR水平。
我们的研究发现,BR和LPS对NRK52E细胞的作用可能通过细胞间GJ发挥作用,随着我们研究的深入,相信可以通过调控细胞间GJ从而减少BR和LPS对NRK52E细胞的损伤作用,为临床减少肝移植术后肾功能损伤提供良好的理论基础。
[1]Junge G,Schewior LV,Kohler S,et al.Acute renal failure after liver transplantation:incidence,etiology,therapy,and outcome[J].Transplant Proc,2006,38(3):723-724.
[2]Zhu FX,Liu CJ,Zhu JY,et al.Risk factors of renal failure in the early post- liver transplantation period[J].Chin J Hepatol,2005,13(3):168 - 170.
[3]Lima EQ,Zanetta DM,Castro I,et al.Risk factors for development of acute renal failure after liver transplantation[J].Ren Fail,2003,25(4):553 -560.
[4]Bilbao I,Charco R,Balsells J,et al.Risk factors for acute renal failure requiring dialysis after liver transplantation[J].Clin Transplant,1998,12(2):123 -129.
[5]Chuang FR ,Lin CC ,Wang PH ,et al.Acute renal failure after cadaveric related liver transplantation[J].Transplant Proc,2004,36(8):2328 -2330.
[6]刑同海,彭志海,张 政,等.急性肝功能衰竭患者肝移植术后急性肾功能衰竭的病因分析及综合治疗[J].中华普通外科杂志,2008,23(7):496 -499.
[7]史颖弘,樊 嘉,周 俭,等.肝移植术后早期急性肾功能衰竭处理及危险因素分析[J].中华肝胆外科杂志,2007,13(2):98 -100.
[8]Álvares-da- Silva MR,Waechter FL,Francisconi CF,et al.Risk factors for postoperative acute renal failure at a new orthotopic liver transplantation program [J].Transplant Proc,1999,31(7):3050 -3052.
[9]Nemes B,Kobori L,Galffy Z,et al.Clinical factors influencing the complications and survival of liver transplantation in Hungary[J].Orv Hetil,2005,146(30):1567 -1574.
[10]周立夫,吴建国.内毒素介导动物急性肾功能衰竭机理的试验研究[J].畜牧兽医学报,2005,36(3):283-287.
[11]Tao L,Harris AL.2-aminoethoxydiphenyl borate directly inhibits channels composed of connexin26 and/or connexin32[J].Mol Pharmacol,2007,71(2):570 -579.
[12]Harris AL.Connexin specificity of second messenger permeation:real numbers at last[J].Gen Physiol,2008,131(4):287-292.
[13]位 静,甘小亮,罗晨芳,等.内毒素对NRK52E细胞生长及细胞间缝隙连接功能的影响[J].中山大学学报(医学科学版),2010,31(2):249 -252.
[14]Clark JE,Foresti R,Sarathchandra P,et al.Heme oxygenase-1-derived bilirubin ameliorates postischemic myocardial dysfunction[J].Am J Physiol Heart Circ Physiol,2000,278(2):H643 - H651.
[15]Lanone S,Bloc S,Foresti R,et al.Bilirubin decreases NOS2 expression via inhibition of NAD(P)H oxidase:implications for protection against endotoxic shock in rats[J].FASEB J,2005,19(13):1890 -1892.
[16]Risek B,Pozzi A,Gilula NB.Modulation of gap junction expression during transient hyperplasia of rat epidermis.[J].J Cell Sci,1998,11(Pt 10):1395 -1404.
[17]Yaoita E,Yao J,Yoshida Y.Up - regulation of connexin43 in glomerular podocytes in response to injury[J].Am J Pathol,2002 ,161(5):1597 -1606.

