桑黄发酵产物的抑菌作用
孟庆龙,潘景芝,陈 丽,王 琦,
(1.吉林农业大学 食药用菌教育部工程研究中心,吉林 长春 130118;2.长春市传染病医院,吉林 长春 130123)
桑黄发酵产物的抑菌作用
孟庆龙1,潘景芝2,陈 丽1,王 琦1,*
(1.吉林农业大学 食药用菌教育部工程研究中心,吉林 长春 130118;2.长春市传染病医院,吉林 长春 130123)
采用滤纸片法和二倍稀释法对桑黄发酵产物中菌丝体不同溶剂提取物和发酵液的抑菌作用及热稳定性进行初步研究。结果表明:桑黄菌丝体甲醇、正丁醇提取物和发酵液对金黄色葡萄球菌、大肠杆菌、肠炎沙门氏菌、鼠伤寒沙门氏菌均有一定的抑制作用,且对金黄色葡萄球菌的抑菌活性表现出较好的热稳定性。与此同时,桑黄菌丝体正丁醇提取物对4种指示菌的抑菌率均最高,且最低抑菌质量浓度仅为0.1563~0.3125mg/mL,从而说明桑黄菌丝体正丁醇提取物具有较强的抑菌能力。
桑黄;发酵产物;提取物;发酵液;抑菌作用
桑黄(Phellinus igniarius (linnearus: fries) quelet)是一种多年生珍稀药用真菌,属担子菌亚门(Basidiomycotina)、层菌纲(Hymenomycetes)、多孔菌科(Polyporaceae)、针层孔菌属(Phellinus),又名桑臣、胡孙眼、桑黄菇[1]。主要分布于中国、日本、韩国等国家。其子实体入药,味微苦,能利五脏、软坚、排毒、止血、活血等[2]。桑黄的药用价值最早记载于李时珍《本草纲目》中,是目前国际公认的抗癌疗效最好的药用真菌之一[3]。
近年来,由于桑黄特有的药理活性,使其成为国内外学者研究的热点。桑黄除了具有传统的治疗淋病、崩漏、带下、排毒和胃止泻等功效外,还具有抗癌、免疫调节、保肝、抗肝硬化、抗脂质过氧化和抗诱变等药用功能[4-8]。由于野生资源的稀少以及人工栽培难度较大,使桑黄从来源上受到了制约[9-10]。因此,应用液体深层发酵技术已成为获得桑黄活性成分的重要途径之一。
目前,对桑黄的研究大多集中在抗肿瘤和提高机体免疫能力等方面[11],而关于桑黄发酵产物抑菌作用的研究尚未见报道。由于合成防腐剂可能存在毒性和致癌的问题,使得天然防腐剂的研究日趋受到人们的重视。因此,本实验旨在探讨桑黄发酵产物中菌丝体不同溶剂提取物和发酵液的抑菌活性,并通过食品加工中常见的热处理操作,初步研究桑黄发酵产物抑菌作用的热稳定性,为桑黄发酵产物的进一步综合开发和利用提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
桑黄(Phellinus igniarius)子实体采自吉林省长白山地区,由吉林农业大学食药用菌教育部工程研究中心分离、纯化菌种并保存。
金黄色葡萄球菌(Staphylococcus aureus)、肠炎沙门氏菌(Salmonellae enteritidis)、大肠杆菌 (Escherichia coli)、鼠伤寒沙门氏菌(Salmonella typhimurium)均由中国检验检疫局惠赠。
1.1.2 培养基[12]
牛肉膏蛋白胨液体培养基、牛肉膏蛋白胨固体培养基以及综合液体培养基。
本文调查了河北省各设区市新型城镇化发展水平及信息化发展水平的变化。指标体系中的定量指标数据主要来源于2017年的《中国城市统计年鉴》《河北省经济年鉴》《河北省各设区市国民经济和社会发展公报》。
1.1.3 试剂
牛肉膏和蛋白胨为生化试剂;二甲基亚砜(20080602)上海生工生物工程有限公司;链霉素(20071205) 华北制药股份有限公司;甲醇、正丁醇、石油醚等均为国产分析纯。
1.1.4 仪器与设备
XS-213型生物显微镜、HG303-4K型电热恒温培养箱 南京电器三厂;DHG-9140A型电热恒温鼓风干燥箱上海精宏实验设备有限公司;BCN-1360型生物洁净工作台 北京东联哈尔仪器制造有限公司;XB-K-25型血细胞计数板 上海求精生化试剂仪器有限公司;ZHWY-111C型恒温培养振荡器 上海智城分析仪器制造有限公司。
1.2 方法
1.2.1 桑黄液体深层发酵培养[13]
在无菌条件下,将桑黄试管菌种菌丝接种于含有100mL综合培养基的三角瓶(250mL)中,置于26℃、130r/min的摇床中培养5~7d;将三角瓶(250mL)中生长较好的菌丝转入含有400mL综合培养基的三角瓶(1000mL)中,置于26℃、130r/min的摇床中继续培养7~10d[9]。对桑黄发酵产物进行抽滤,分离菌丝体和发酵液备用。
1.2.2 桑黄发酵产物的制备[14]
1.2.3 测试菌平板的制备[15]
将湿热灭菌过的牛肉膏蛋白胨固体培养基置于超净工作台中紫外灭菌20min,待培养基冷却后,分别用一次性无菌注射器吸取相应量的指示菌悬液(约2.3×106CFU/mL)注入培养基中,并用无菌三角涂布棒将其涂布均匀后备用。
1.2.4 抑菌活性的测定[16]
在超净工作台中,使用三点接种法用镊子分别将浸有20mg/mL桑黄发酵产物抑菌原液、2mg/mL链霉素水溶液和二甲基亚矾水溶液的滤纸片,放到测试菌平板上,每个实验设置3次重复。将以上平板均倒置于37℃恒温培养箱中培养24h后,测量抑菌圈直径,并求平均值作为实验结果。
抑菌率/% =(D1-D2)/D3
式中:D1为供试品抑菌圈直径;D2为阴性对照品抑菌圈直径;D3为阳性对照品抑菌圈直径。
1.2.5 最低抑菌质量浓度(MIC)的测定[17]
将桑黄发酵产物抑菌原液用相应溶剂依次稀释成20、10、5、2.5、1.25、0.625、0.3125、0.1563、0mg/mL的溶液,并倒入已溶化的40℃左右的牛肉膏蛋白胨固体培养基中,摇匀,倒板,待其冷凝后分别加入相应量的菌悬液,涂抹均匀,37℃恒温培养24h,每个质量浓度设置3次重复。观察结果,菌落被完全抑制的最低抑菌液质量浓度即为最低抑菌质量浓度MIC。
1.2.6 热稳定性测定[18]
将桑黄发酵产物抑菌原液用相应溶剂稀释成20mg/mL的溶液,并取部分溶液分别置于40、60、80、100、121℃条件下处理30min,对照溶液置于30℃,以金黄色葡萄球菌为指示菌,用抑菌圈直径法测定处理前后样品的抑菌活性,每个温度设置3次重复。
2 结果与分析
2.1 桑黄菌丝体不同溶剂提取物和发酵液对4种指示菌的抑制作用
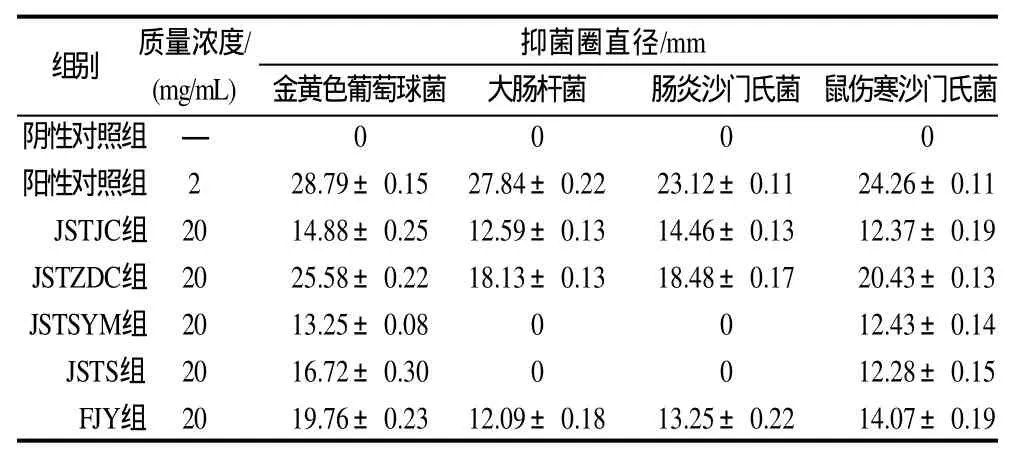
表1 桑黄菌丝体不同溶剂提取物和发酵液对4种指示菌的抑菌圈直径Table1 Diameters of inhibition zone of different extracts of mycelium and fermentation broth of Phellinus igniarius against the four indicator bacteria

图1 桑黄菌丝体不同溶剂提取物和发酵液对4种指示菌的抑菌率Fig.1 Inhibition rate of different extracts of mycelium and fermentation broth of Phellinus igniarius against the four indicator bacteria
由表1、图1可知,20mg/mL的桑黄菌丝体甲醇提取物(JSTJC)、正丁醇提取物(JSTZDC)、石油醚提取物(JSTSYM)、水提取物(JSTS)和发酵液(FJY)对金黄色葡萄球菌、大肠杆菌、肠炎沙门氏菌、鼠伤寒沙门氏菌具有一定的抑制作用。其中桑黄菌丝体甲醇提取物(JSTJC)、正丁醇提取物(JSTZDC)和发酵液(FJY)对4种指示菌均表现出明显的抑制作用,且广谱抑菌效果较强。
2.2 桑黄菌丝体不同溶剂提取物和发酵液对4种指示菌的最低抑菌质量浓度(MIC)
桑黄菌丝体甲醇提取物(JSTJC)、正丁醇提取物(JSTZDC)和发酵液(FJY)在不同质量浓度下对4种指示菌的最低抑菌质量浓度(MIC)为0.1563~0.625mg/mL。其中桑黄菌丝体正丁醇提取物(JSTZDC)对金黄色葡萄球菌、肠炎沙门氏菌、大肠杆菌、鼠伤寒沙门氏菌的最低抑菌质量浓度均小于桑黄菌丝体甲醇提取物(JSTJC)和发酵液(FJY),分别为0.1563、0.3125、0.1563、0.1563mg/mL,抑菌活性最强,结果见表2~4。

表4 桑黄发酵液最低抑菌质量浓度Table4 MICs of fermentation broth of Phellinus igniarius

表2 桑黄菌丝体甲醇提取物最低抑菌质量浓度Table2 MICs of methanol extract from mycelium of Phellinus igniarius

表3 桑黄菌丝体正丁醇提取物最低抑菌质量浓度Table3 MICs of n-butanol extract from mycelium of Phellinus igniarius
2.3 桑黄菌丝体不同溶剂提取物和发酵液抑菌活性的热稳定性
桑黄菌丝体甲醇提取物(JSTJC)、正丁醇提取物(JSTZDC)、石油醚提取物(JSTSYM)、水提取物(JSTS)和发酵液(FJY)对敏感型菌株金黄色葡萄球菌均具有抑制作用。如图2所示,经过不同温度加热处理后,其抑菌活性未呈现出较大变化,与原有的抑菌活性基本保持一致,从而表明桑黄菌丝体不同溶剂提取物和发酵液的抑菌活性具有较好的热稳定性。

图2 桑黄菌丝体不同溶剂提取物和发酵液抑菌活性的热稳定性Fig.2 Thermal stability of antibacterial activity of different extracts of mycelium and fermentation broth of Phellinus igniarius
3 讨 论
长久以来,从植物中寻找天然活性物质一直是新药研究的重要内容,但过度采挖会造成物种的枯竭,而液体深层培养具有生产周期短、成本低、产量高的特点,可在短时间内获得大量培养物[19-20]。因此,通过人工发酵来获得活性物质无疑为新型药物的开发提供了新的途径,本实验利用液体深层发酵技术获得桑黄菌丝体和发酵液,为研究桑黄的药理活性奠定了物质基础。
到目前为止,对桑黄的研究大多集中在抗肿瘤和提高机体免疫能力方面[21-22]。而关于桑黄发酵产物的抑菌活性尚无相关报道。已有研究证实,桑黄子实体的甲醇、氯仿、正丁醇和水提取物均具有抑菌活性,其正丁醇浸提取物抗耐甲氧基西林金黄色葡萄球菌效果最好,最低抑菌质量浓度为63~125μg/mL[23]。本实验研究表明,桑黄菌丝体不同溶剂提取物及发酵液对4种指示菌的抑制作用不同:菌丝体甲醇、正丁醇提取物和发酵液对4种指示菌均表现出较强的抑菌作用,最低抑菌质量浓度为0.1563~0.625mg/mL,具有广谱的抑菌活性,且对金黄色葡萄球菌的抑菌活性不随温度的升高而发生剧烈变化,表现出较好的热稳定性,由此推断,桑黄抑菌活性物质的主要存在部位为菌丝体甲醇、正丁醇提取物及发酵液;与此同时,菌丝体正丁醇提取物对4种指示菌的抑菌率均最高,且最低抑菌质量浓度仅为0.1563~0.3125mg/mL,从而说明桑黄菌丝体正丁醇提取物的抑菌能力最强。
通过对活性成分的初步检测,桑黄菌丝体甲醇、正丁醇提取物中主要含有黄酮类物质。因此,桑黄菌丝体中所含的黄酮类物质可能具有较高的抑菌活性。而发酵液所表现出来的抑菌作用可能与发酵过程中产生的酶类活性物质有关,也可能是由于液体发酵时菌丝断裂而产生抗生素或释放出了抗生素物质,对于桑黄发酵产物的抑菌作用机制有待于进一步研究。
[1] 刘波. 中国药用真菌[M]. 太原: 山西人民出版社, 1974: 71-73.
[2] 卯晓岚. 中国大型真菌[M]. 郑州: 河南科技出版社, 2000: 465-468;477.
[3] 吕英华, 王建芳, 李玉平, 等. 药用真菌桑黄的研究进展[J]. 蚕业科学, 2009, 35 (1): 204-210.
[4] IKEKAWA T, NAKANISHI M, UEHARA N, et al. Antitumor action of some basidiomycetes, especially Phellinus linteus[J]. Gann, 1968, 59(9):155-157.
[5] AJITH T A, JANARDHANAN K K. Cytotoxic and antitumor activities of a polypore macrofungus, Phellinus rimosus (Berk) Pilat[J]. J Ethnopharmacol, 2003, 84(2): 157-162.
[6] BAE J S, JANG K H, PARK S C, et al. Inhibitory effects of polysaccharides isolated from Phellinus gilvus on benzo (a) pyrene-induced forestomach carcinogenesis in mice[J]. World J Gastroenterol, 2005, 11(4):577-579.
[7] KIM G Y, CHOI G S, LEE S H,et al. Acidic polysaccharide isolated from Phellinus linteus enhances through the up-regulation of nitric oxide and tumor necrosis factor-alpha from peritoneal macrophages[J]. J Ethnopharmacol, 2004, 95(1): 69-76.
[8] 宋力, 孙培龙, 郭彬彬, 等. 桑黄的研究进展[J]. 中国食用菌, 2005,24(3): 7-15.
[9] 胡文彬, 马海乐, 周存山. 桑黄菌液体发酵培养基及发酵条件研究[J]. 中国食用菌, 2006, 25(3): 49-52.
[10] 雷萍, 孙悦迎, 张文隽, 等. 野生桑黄菌种分离与培养特性研究初报[J]. 食用菌学报, 2007, 14(2): 71-75.
[11] 孙培龙, 徐双阳, 杨开, 等. 珍稀药用真菌桑黄的国内外研究进展[J].微生物学通报, 2006, 33(2): 119-132.
[12] 章海燕, 王立, 张晖. 乌饭树树叶不同提取物抑菌作用的初步研究[J]. 食品科技, 2010, 17(1): 34-37.
[13] 杨全, 胡旭光, 王琦, 等. 药用真菌桑黄菌丝体多糖抗肿瘤作用的研究[J]. 中国中药杂志, 2006, 31 (20): 1713-1715.
[14] 姜宁, 刘晓鹏, 吴红江, 等. 金针菇菌丝体多糖超声提取工艺的研究[J]. 食品科学, 2008, 29(8): 289-292.
[15] 沈萍, 范秀容, 李广武, 等. 微生物学试验[M]. 北京: 高等教育出版社, 1999: 69-72.
[16] 马利华, 秦卫东, 陈学红, 等. 牛蒡提取物抑菌活性的研究[J]. 食品科学, 2009, 30(21): 24-27.
[17] 吐尔逊娜依·迪力夏提, 穆拉丁·库热西, 阿不都拉·阿巴斯.菊苣茎乙醇提取物抑菌活性研究[J]. 食品科学, 2009, 30(11): 80-82.
[18] 侯美珍, 韦红群, 潘英明. 紫草不同溶剂提取物抑菌活性研究[J]. 食品工业科技, 2006, 27(11): 52-55.
[19] 杨全, 李艳辉, 王琦, 等. 药用真菌桑黄液体发酵工艺的研究[J]. 广东药学院学报, 2005, 20(3): 212-215.
[20] 傅海庆, 陈绍军, 骆文灿, 等. 桑黄菌液体发酵培养基研究[J]. 中国食品学报, 2007, 7 (3): 58-63.
[21] HAN S B, LEE C W, KANG J S, et al. Acidic polysaccharide from Phellinus linteus inhibits melanoma a cell metastasis by blocking cell adhesion and invasion[J]. Int Immunopharm Acol, 2006, 6(4): 697-702.
[22] OH G S, LEE M S, PAE H O, et al. Effects of oral administration of Phellinus linteus on the production of Th1 and Th2 type cytokines in mice[J]. Immunopharmacol Immunot, 2006, 28(2): 281-293.
[23] JONG M H, CHUN H Y, SEUNG H H, et al. Antibacterial effect of Phellinus linteus against methicillin-resistant Staphylococcus aureus[J]. Fitoterapia, 2004, 75(6): 603-605.
Antibacterial Activity Evaluation of Fermentation Supernatant and Mycelia of Phellinus igniarius
MENG Qing-long1,PAN Jing-zhi2,CHEN Li1,WANG Qi1,*
(1. Engineering Research Center of Edible and Medicinal Fungi, Ministry of Education, Jilin Agricultural University, Changchun 130118, China;2. Changchun City Hospital for Infectious Disease, Changchun 130123, China)
Paper disk and double dilution methods were used to study the inhibition activities and thermal stability of different extracts from mycelia and fermentation broth of Phellinus igniarius. The results showed that the inhibition effects of its methanol,n-butanol extracts of mycelia and fermentation broth on Staphylococcus aureus, Escherichia coli, Salmonellae enteritidis, and Salmonella typhimurium existed, and the extracts were heat stable to Staphylococcus aureus. Meanwhile, the highest rate on inhibition against 4 indicator bacteria was n-butanol extracts from mycelia of P. igniarius, and the minimal inhibitory concentration was 0.1563-0.3125 mg/mL, which showed that its n-butanol extracts had strong antimicrobial activity.
Phellinys igniarius;fermentation products;extract;fermentation broth;antibacterial activity
R285.5
A
1002-6630(2011)03-0056-04
2010-05-20
长春净月经济开发区资助项目(20060529)
孟庆龙(1985—),男,硕士研究生,研究方向为药用菌物学。E-mail:mengqinglong1985@sina.com
*通信作者:王琦(1963—),女,教授,博士,研究方向为药用菌物学。E-mail:qwang2003@hotmail.com

