氯化血红素对CdS量子点荧光的猝灭研究及分析应用
张文龙,张俊生,周丽萍,陈莉华
(吉首大学化学化工学院,湖南 吉首 416000)
氯化血红素对CdS量子点荧光的猝灭研究及分析应用
张文龙,张俊生,周丽萍,陈莉华*
(吉首大学化学化工学院,湖南 吉首 416000)
以巯基乙酸为稳定剂及表面修饰剂,在水溶液中合成了平均粒径为2.9nm左右的CdS 量子点,该量子点在512.4nm波长处有强的源于表面阱的空穴电子重组形成的表面态发射峰,加入的氯化血红素通过扩散和碰撞作用可将电子转移至CdS 量子点的空穴中导致量子点荧光发生动态猝灭,并在此基础上建立了测定氯化血红素的新型荧光分析法。在最佳测定条件下,当氯化血红素的质量浓度为5.0×10-6~25.0×10-6g/mL时,体系的相对荧光强度(F)与氯化血红素的质量浓度(ρ)呈线性关系,线性回归方程为:F=719.09-14.01×10-6ρ,检出限为3.35×10-8g/mL。测定血清样品基底中氯化血红素的含量并获得满意结果。
CdS量子点;氯化血红素;电子转移;荧光猝灭
量子点由于其量子尺寸效应所带来的特殊光学效应使其在DNA及蛋白质标记、活体细胞染色、生物芯片等领域获得广泛应用[1]。CdS是其中研究得最深入、应用也最为广泛的量子点,在探讨其作为荧光探针标记蛋白质[2]测定牛血清白蛋白[3]及与多肽[4]、半胱氨酸[5]的相互作用时,大多涉及到量子点与生物分子间的能量转移、表面吸附或修饰等作用机理,而对于量子点与生物分子之间的电子转移的研究报道较少。
从动物血中提取出来的氯化血红素( hemin)作为一种优良的天然色素、铁强化剂及抗贫血药,广泛应用于食品、医药和精细化工方面。它既是过氧化物模拟酶也是氧化还原蛋白,对氯化血红素的分析研究包括其作为过氧化物模拟酶与电极[6]或其他生物分子之间的电子转移[7-8]以及应用分光光度法、荧光分析[9]和化学发光法等方法对其分析测定,但对于氯化血红素与量子点特别是CdS量子点在溶液中的荧光行为研究甚少。
本实验合成了水溶性CdS量子点,使之与氯化血红素作用,发现氯化血红素将猝灭CdS量子点产生的源于表面阱的空穴电子重组形成的表面态发射,深入探讨了氯化血红素与量子点之间的猝灭机理,证明了其猝灭机理为电子转移引起的动态猝灭,并建立了相应的荧光分析方法。
1 材料与方法
1.1 材料、试剂与仪器
患者的血清从湘西自治州康复医院取样。
Cd(NO3)2苏州市振兴化工厂;硫代乙酰胺、巯基乙酸 湖南师范大学试剂厂;氯化血红素(溶解于0.01mol/L NaOH溶液,工作液质量浓度为100mg/L) 中国科学院上海生物化学研究所;B-R缓冲溶液;高纯N2气;实验中所用超纯水在25℃的电阻率为10~16MΩ·cm,电导率小于0.1μs/cm;其他试剂均为分析纯。
RF-5000荧光分光光度计 日本岛津公司;JEM3010高倍透射电镜 日本JEOL电子公司。
1.2 方法
1.2.1 CdS量子点的制备
[10-11]的方法,采用硫代乙酰胺作为反应剂,CdCl2提供镉源,经改进后用下述方法制备CdS量子点。配制40mL 含1.5×10-2mol/L CdCl2及4mL 巯基乙酸的混和溶液,用NaOH调节至透明无浑浊,此时pH值约为11左右。通N2除氧约10min,倒入三颈烧瓶内,放在恒温磁力搅拌器中,隔绝空气条件下缓慢升高温度,向其中滴加 40mL 1.0×10-2mol/L的硫代乙酰胺溶液([Cd2+]:[S2-]为1.5:1)。将溶液加热到96℃,在N2保护下搅拌 2.5h,回流3h,过滤,得淡黄色表面富含Cd2+的 CdS量子点溶胶。将该溶胶状液体与100mL 甲醇超声搅拌均匀,静置5h,离心分离大粒径 CdS,溶液经超声振荡,得到颗粒较为均匀的 CdS量子点。
1.2.2 巯基乙酸表面修饰CdS量子点
在PBS缓冲液中,将CdS量子点与一定量的巯基乙酸(1:1),在室温下于超声波中振荡反应6h,取上层可溶功能性量子点备用。
1.2.3 CdS量子点测定氯化血红素
在15mL 比色管中,准确加入pH值为11. 20的B-R缓冲液2.0mL,0.6mL CdS纳米粒子溶液,加入不同质量浓度的氯化血红素溶液(标准曲线)或一定量的样品溶液(样品分析),定容后放置 10min。在 380nm 激发波长下记录512.4nm波长处荧光强度 F,CdS量子点溶液的荧光强度为F0,加入氯化血红素后溶液的荧光强度为F。
2 结果与分析
2.1 电镜分析

图1 巯基乙酸透射电镜(TEM)图Fig.1 TEM image of CdS-TGA
由图1可见,所得巯基乙酸修饰的 CdS量子点粒径均匀,分散性好,可计算粒径在5 nm以下。
2.2 荧光光谱分析

图2 氯化血红素质量浓度对CdS荧光光谱的影响Fig.2 Effect of hemin concentration on fluorescence spectra of CdS
由图2可知,通常CdS有两种典型的特征发射峰,一个在520~570nm,另一个在410~490nm。410~490nm的峰是源于晶体本体的激发态重组的发射峰,520~570nm的峰是源于表面阱的空穴电子重组形成的表面态发射峰,其中表面态发光与纳米粒子的生长环境有关,受周围介质的影响强烈。以波长为380nm的光激发时,CdS 量子点在512.4nm波长处出现强的荧光峰,半高峰宽(full width at half maximum,FWHM)为49. 8nm,此发射带应为表面阱的空穴电子重组形成的表面态发射峰。
纳米粒子的尺寸D与其荧光峰λe之间有如下关系[12]:D=2.6786×1-4.9348×+3.4222×-1.0511 λe+127.74。
以此计算512.4nm波长处的荧光发射,可知合成的CdS 量子点粒径为2.9nm,该粒径计算结果与高倍透射电镜(TEM)表征互为佐证。加入氯化血红素后,体系的荧光峰强度逐渐减弱,最大荧光峰波长不变,说明氯化血红素的加入使CdS 量子点的荧光发生猝灭。
2.3 CdS-氯化血红素体系的吸收光谱
测定了CdS 量子点溶液、氯化血红素溶液及含等物质的量的CdS、氯化血红素混合溶液的紫外-可见吸收光谱,结果如图3所示。

图3 CdS-氯化血红素体系中各物质的吸收光谱图Fig.3 Absorption spectra of CdS-hemin (1), hemin (2) and CdS (3)
由图3可知,CdS-氯化血红素体系的紫外光谱相当于CdS和氯化血红素紫外光谱的叠加,没有新的谱峰出现,说明CdS和氯化血红素没有结合生成新的物质。
2.4 温度对氯化血红素猝灭CdS量子点荧光的影响

图4 温度对氯化血红素猝灭CdS荧光强度的影响Fig.4 Effect of temperature on CdS fluorescence quenching by hemin
用ΔF=F0-F为衡量指标,实验了不同温度下氯化血红素猝灭CdS量子点荧光的对应效果,由图4可知,在35℃时,体系的荧光强度下降最大,其后随着温度的上升,体系的ΔF变化不大,5 0℃时,体系的荧光强度下降又减小。因此本实验选择测定温度为35℃。
2.5 pH 值对氯化血红素猝灭CdS量子点荧光的影响
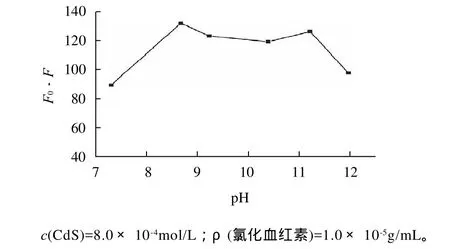
图5 pH值对氯化血红素猝灭CdS荧光强度的影响Fig.5 Effect of pH on CdS fluorescence quenching by hemin
pH值对量子点CdS及CdS-hemin体系的荧光峰位没有影响,但对相应的荧光强度有较大影响。本体系以B-R缓冲液调节溶液的pH值,考察不同pH 值对体系荧光猝灭程度ΔF的影响。由图5可知,在pH8.66时,体系的ΔF最大,但荧光强度F0较小。在pH 11.20时,荧光强度F0最大,这时ΔF也较大。综合考虑F0和ΔF的因素,本实验选择pH11.20的B-R缓冲溶液调节体系的p H值。
2.6 干扰离子对氯化血红素猝灭CdS量子点荧光的影响
在最佳实验条件下,按照氨基酸、糖类等主要生命元素实验共存物质对1.0×10-5g/mL氯化血红素猝灭CdS量子点荧光的影响,结果见表1。

表1 干扰离子对氯化血红素猝灭CdS量子点荧光的影响Table1 Effects of coexisting ions for CdS fluorescence quenching by hemin
由表1可知,大部分干扰离子没有干扰。
2.7 基于猝灭CdS量子点荧光的氯化血红素定量关系
微量氯化血红素可猝灭CdS量子点荧光,且随氯化血红素质量浓度增大猝灭程度加剧,基于此,可建立氯化血红素的分析方法,在选定的最佳条件下绘制标准曲线,在5.0×10-6~25.0×10-6g/mL 范围内,氯化血红素质量浓度(c)与体系相对荧光强度(F)有良好的线性关系,其线性回归方程为:F=719.09-14.01×10-6ρ(R2= 0.9995)。根据 IUPAC规定,检出限按3δ/K(δ为空白多次测得信号的标准偏差,K为方法的灵敏度,即校准曲线的斜率)计算为3.35×10-8g/mL。
2.8 样品分析
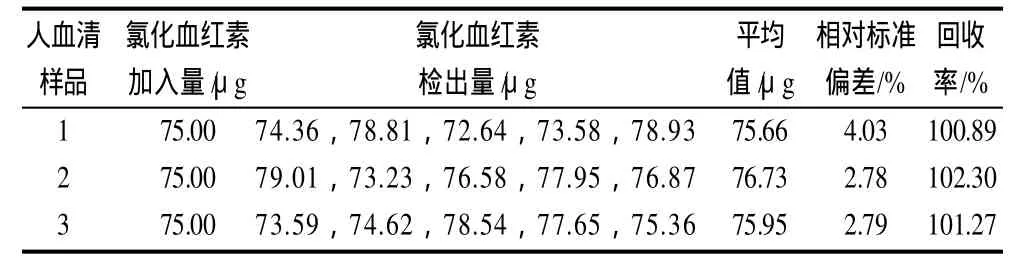
表2 氯化血红素样品含量测定结果Table2 Analytical results of hemin in human blood serum
以不同患者的血清作为基底加入氯化血红素按实验方法测定含量,表2的结果表明,血清中其他物质对氯化血红素测定没有干扰,可用于实际样品分析。
2.9 猝灭机理探讨
荧光猝灭过程通常分为动态猝灭和静态猝灭,常通过以下办法来区分是动态猝灭还是静态猝灭:1) 因动态猝灭依赖于分子间的扩散,升高温度会加速扩散,因而动态猝灭常数应随温度升高而增大;但升高温度将导致配合物的稳定性降低,因而静态猝灭常数应随温度升高而减小;2)由于动态猝灭只影响荧光分子的激发态,因而并不改变荧光物质的吸收光谱;而静态猝灭中,基态配合物的生成往往会导致荧光物质荧光吸收光谱的改变,即最大吸收波长发生红移或蓝移,或有新的谱峰出现;3)猝灭过程常数的不同。
下面从上述三方面进行猝灭方式的认定。
1)温度对猝灭的影响
其他条件不变,分别测定15、25、35、45℃温度各自的猝灭常数,结果如图6和表3所示,由此看出猝灭常数KSV随温度升高而增大,初步判断反应为动态猝灭。

图6 氯化血红素质量浓度对CdS量子点荧光猝灭的Stern-Volmer图Fig.6 Stern-Volmer curvers of CdS fluorescence quenching by hemin

表3 线性方程和相关系数Table3 Regression equations and correlation coefficients
2)紫外光谱与荧光光谱分析
作为荧光体的CdS 量子点在512.4nm波长处出现强的荧光峰,在200~450nm之间没有荧光发射,作为猝灭剂的氯化血红素的紫外吸收光谱最大峰出现在350nm和390nm波长处,390nm的吸收峰应是血红素的Soret 谱带特征峰。由氯化血红素的紫外光谱与CdS量子点荧光光谱的拟合图(图7)看出,CdS量子点的荧光发射光谱与氯化血红素的紫外吸收光谱交叠很少,即荧光体CdS和猝灭剂氯化血红素之间没有发生能量转移。

图7 氯化血红素的紫外光谱与CdS量子点荧光光谱的拟合图Fig.7 Overlap of hemin absorption spectrum (1) with CdS fluorscence spectrum (2)
3)假如该过程为动态猝灭过程,则有:Ksv=Kqτ0。式中:Kq为双分子猝灭过程速率常数;τ0为猝灭剂不存在时荧光体的平均寿命,一般半导体量子点的平均寿命为20~50ns。
假设本实验合成的巯基乙酸功能化的CdS量子点荧光寿命τ0= 30ns的话,用25℃的KSV值为2.48×104计算,可知其Kq为8.3×1010L/(mol·s),该值与各类猝灭剂对生物分子的最大碰撞猝灭过程速率常数2.0×1010L/(mol·s)的值均在同一个数量级,进一步说明氯化血红素对CdS的猝灭属于动态猝灭。

图8 荧光猝灭机理推测图Fig.8 Speculative fluorescence quenching mechanism between hemin and CdS
大量研究表明,纳米粒子的猝灭机制可以通过能量转移[13]、电荷转移[14]及表面吸附分子[15]对表面态能级的改变等各种形式而改变整个体系的发光。对CdS纳米粒子来说,400~600nm范围的荧光发射光谱与氯化血红素分子400~600nm范围的吸收光谱交叠很少,因而可以忽略能量转移机制;氯化血红素与CdS进行碰撞后,CdS的荧光峰强度下降但最大吸收光谱没有蓝移或红移,说明没有发生表面吸附分子或氯化血红素取代巯基乙酸使CdS纳米粒子的化学环境和表面态能级发生改变,由此推测氯化血红素通过扩散和碰撞与CdS量子点发生氧化还原反应而进行电荷转移,氯化血红素提供的电子跃迁到量子点的空穴中导致CdS量子点的荧光发生动态猝灭,其动态猝灭常数随温度升高而增大,猝灭效果随猝灭剂质量浓度增大而加强,如图8所示。
参考文献:
[1] XU Huan, WU Jien, CHEN Chihhsin, et al. Detecting hydrogen sulfide by using transparent polymer with embedded CdSe/CdS quantum dots[J].Sensors and Actuators B: Chemical, 2010, 143(2): 535-538.
[2] 曾庆辉, 张友林, 杜创, 等. CdTe/CdS核壳量子点与蛋白质荧光标记[J]. 高等学校化学学报, 2009, 30(6): 1158-1161.
[3] 陈红旗, 梁阿妮, 许轶, 等. CdS/PPA纳米溶胶荧光探针同步荧光光度法测定水溶液中牛血清白蛋白[J]. 应用化学, 2008, 25(12): 1484-1486.
[4] 陈旭东, 王新波, 范莉, 等. CdS纳米晶与多肽相互作用研究[J]. 化学学报, 2005, 63(17): 1600-1606.
[5] 刘辉, 李文友, 尹洪宗, 等. CdS纳米粒子与半胱氨酸相互作用的研究[J].高等学校化学学报, 2005, 26 (9):1618-1622.
[6] BRUSOVA Z, MAGNER E. Kinetics of oxidation of hydrogen peroxide at hemin-modified electrodes in nonaqueous solvents[J].Bioelectrochemistry, 2009, 76(1): 63-69.
[7] ZHANG Yafen, YAN Rui, ZHAO Faqiong, et al. Polyvinyl alcoholionic liquid composition for promoting the direct electron transfer and electrocatalysis of hemoglobin[J]. Colloids and Surfaces B: Biointerfaces,2009, 71(2): 288-292.
[8] REEDER B J, CUTRUZZOLA F, BIGOTTI M G, et al. Tyrosine as a redox-active center in electron transfer to ferryl heme in globins[J]. Free Radical Biology and Medicine, 2008, 44 (3): 274-283.
[9] SANTOS W, LIMA PR, TARLEY C R T, et al. Synthesis and application of a peroxidase-like molecularly imprinted polymer based on hemin for selective determination of serotonin in blood serum[J]. Analytica Chimica Acta, 2009, 631(2): 170-176.
[10] UNNI C, PHILIP D, SMITHA S L, et al. Aqueous synthesis and characterization of CdS, CdS:Zn2+and CdS:Cu2+quantum dots[J].Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy,2009, 72(4): 827-832.
[11] ZHANG Laijun, SHEN Xingcan, LIANG Hong, et al. Hot-injection synthesis of highly luminescent and monodisperse CdS nanocrystals using thioacetamide and cadmium source with proper reactivity[J]. Journal of Colloid and Interface Science, 2010, 342(2): 236-242.
[12] WU D G, MARTIN E K, van PATTEN P G. A new class of capping ligands for CdSe nanocrystal synthesis[J]. Chem Mater, 2005, 17: 6436-6441.
[13] 吴峰, 蔡继业. 基于量子点的荧光共振能量转移的应用[J]. 化学与生物工程, 2007, 24(1): 58-61.
[14] 庄严, 周全法. 纳米粒子与吸附分子之间电荷转移的影响因素研究[J]. 稀有金属材料与工程, 2008, 37(4): 637-640.
[15] 陈莉华, 覃事栋, 李朝阳. 胃蛋白酶对CdTe纳米粒子的表面修饰及分析应用[J]. 高等学校化学学报, 2008, 29 (2): 277-282.
Fluorescence Quenching Mechanism of CdS Quantum Dots by Hemin and Its Application
ZHANG Wen-long,ZHANGF Jun-sheng,ZHOU Li-ping,CHEN Li-hua*
(College of Chemistry and Chemical Engineering, Jishou University, Jishou 416000, China)
CdS quantum dots were synthesized in aqueous solution by using mercaptoethylic acid as the stabilizer and surface-modification reagent. The 512.4 nm fluorescence emission which was caused by the cavity-electron recombination on surface trap of CdS quantum dots was quenched in the presence of hemin. The quenching mechanism was a dynamic process based on electron transfer between Fe2+of hemin and cavity of CdS quantum dots. Under optimal conditions, a concentration of 5.0×10-6-25.0×10-6g/mL of hemin could be determined on the basis of the decrease ratio of fluorescence intensity of CdS quantum dots,with a detection limit of 3.35×10-8g/mL. The proposed method was utilized to analyze the blood serum sample in which hemin was added with satisfactory results.
CdS quantum dots;hemin;electron transfer;fluorescence quenching
TS264.4
A
1002-6630(2011)03-0051-05
2010-03-15
湖南省教育厅自科基金重点项目(05A009);湖南大学化学生物传感与计量学国家重点实验室开放课题(2005019);吉首大学回校博士基金资助项目(JD05001)
张文龙(1987—),男,硕士研究生,研究方向为纳米粒子荧光特性及分析应用。E-mail:wlaoxi@163.com
*通信作者:陈莉华(1961—),女,教授,博士,研究方向为天然产物。E-mail:chenlihua99@163.com

