CMC与CMC-Na改性鸡蛋清蛋白溶胶-凝胶性质研究
徐保立,李 斌,朱 波,夏 莹,范劲松,郑晓东,蔡 杰,马美湖
(华中农业大学食品科学技术学院,湖北 武汉 430070)
CMC与CMC-Na改性鸡蛋清蛋白溶胶-凝胶性质研究
徐保立,李 斌*,朱 波,夏 莹,范劲松,郑晓东,蔡 杰,马美湖
(华中农业大学食品科学技术学院,湖北 武汉 430070)
将一定质量分数的离子型多糖羧甲基纤维素(CMC)与羧甲基纤维素钠(CMC-Na)分别溶于蛋清中,冷冻干燥后,将得到的样品置于相对湿度为75%的环境中干热反应一定时间后,通过质构分析、色度分析、SDS-PAGE、差示扫描量热分析、扫描电子显微镜研究鸡蛋清蛋白与CMC及CMC-Na交联改性后性质的变化。结果表明:反应温度60℃、反应时间2d时,各样品的凝胶强度显著增大,凝胶的微观网络更为均匀致密,蛋清粉中的小分子质量蛋白质减少。证明适度的反应可增强蛋清粉的凝胶强度,但随时间延长,过度反应则会造成分子质量过大、溶解度下降,色泽显著加深。起泡性的分析表明:各反应2d后样品的起泡性均明显增强,其中以60℃,添加0.25%的CMC和CMC-Na的起泡力最强,分别增大了0.6倍和0.5倍,泡沫稳定性亦明显增强。证明在此反应条件下,可获得同时兼顾较高凝胶性和较高起泡性的新型蛋白粉。
蛋清蛋白;羧甲基纤维素;交联反应;凝胶强度
蛋白质-糖类糖基化反应,是以共价键的形式将碳水化合物与蛋白质分子上的α-或ε-氨基连接而生成糖基化蛋白质的反应。但低分子质量还原糖与蛋清蛋白发生的糖基化反应容易发生褐变[1]。而多糖与蛋白质发生的麦拉德反应条件温和,且提高蛋白质凝胶性更为明显,所以目前利用多糖对蛋白质糖基化是该领域的研究重点,如在蛋清中添加硫酸葡聚糖和半乳甘露聚糖,通过糖基化修饰后蛋清蛋白质的凝胶性、透明性、持水性均有提高。将大豆分离蛋白或蛋清粉与多糖(或多糖水解物)干热反应数天,用于改善凝胶性、乳化性或起泡性效果显著,且产物色泽、溶解性均可接受[2-4]。研究发现,将乳清蛋白或大豆分离蛋白与羧甲基纤维素(CMC)在60℃反应数天后,其乳化稳定性明显提高[5-6]。
利用碳水化合物与蛋清粉蛋白的麦拉德反应,制备高凝胶性蛋清粉已有较多研究。但采用具有强亲水性的离子型多糖,如CMC对蛋清粉进行改性的研究尚未见报道,然而由于CMC具备一定取代度的羧基及其可能参与的酯化、缩合反应,必然对改性产物的性能产生影响,特别是对表面活性产生影响。本实验采用CMC和CMC-Na与蛋清粉热改性后,对其凝胶性和起泡性进行研究,并对其机理进行初步探讨,以开发可能会同时兼备高凝胶性和高起泡性的蛋白粉。
1 材料与方法
1.1 材料与试剂
鲜鸡蛋 市售;葡萄糖氧化酶(生化试剂) 上海晶纯试剂有限公司;溴化钾(分析纯) 国药集团化学试剂有限公司;羧甲基纤维素(分析纯) 天津市科密欧化学试剂有限公司;羧甲基纤维素钠(化学纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
HH-4数显恒温水浴锅、JJ-1精密增力电动搅拌器常州国华电器有限公司;5000S扫描仪 BenQ公司;NDJ-83数字显示黏度计测定 上海精密科学仪器有限公司;Beta2-8LD真空冷冻干燥机 德国Christ公司;204-F1差示扫描量热仪 德国Netzsch公司;DYY-12电泳仪 北京市六一仪器厂;BCD-175冰箱 合肥美菱股份有限公司;FG04高速分散机 江阴精细化工机械厂;TA.XT.PLUS质构仪 英国Stable Micro Sys公司;JSM-6390LV扫描电子显微镜 日本NTC公司。
1.3 方法
1.3.1 原料的制备
将鲜鸡蛋的蛋清手工分离,用高速分散机35r/s搅拌20min,静置1h弃除底层脐带等杂质,用1mol/L的HCl溶液将其pH值调至6.7~7.2,按100mg/kg蛋清的比例加入葡萄糖氧化酶(GOD),30℃水浴3h,按表1所示加入7%的双氧水脱糖[7]。
脱糖完毕后,将其配制成含CMC和CMC-Na的质量分数分别为0.25%、0.5%、1%的溶液,冷冻干燥得到不同CMC与CMC-Na含量的蛋清粉样品,分别记为0.25%CMC、0.5% CMC、1% CMC和0.25%CMC-Na、0.5% CMC-Na、1%CMC-Na。将冷冻干燥得到的样品置于相对湿度75%(底部放置KBr饱和溶液)的干燥器中,分别在60℃和70℃反应数天,每隔一定时间取样检测[8]。

表1 葡萄糖氧化酶脱糖方法Table1 Elimination of glucose in egg white using glucose oxidase
1.3.2 色度的测定
将样品用5000SBenQ扫描仪扫描所得图片用Vision.Builder AI 6.3分析得出L*、a*及 b*[9]。L*:亮度;a*:红(+)或绿(-);b*:黄(+)或蓝(-)。
1.3.3 凝胶制备及凝胶强度的测定
将样品配制成固含量为10%的溶液在凝胶温度90℃、凝胶时间30min的条件下制备凝胶,于4℃冰箱中放置14h,利用物性测试仪的P0.5探头,测定鸡蛋清的凝胶强度(用测定所得硬度表示,平行样n=6)[10]测定条件如下:测前速度:5mm/s;测试速度:1mm/s;测后速度:5 mm/s;压缩比:5 0%;触发力:5 g。
1.3.4 起泡性的测定
室温下将各样品配成固含量为5%的溶液后,各取70mL于直径为40mm的圆柱形玻璃瓶中,使用JJ-1精密增力电动搅拌器在2000r/min条件下搅打 2min,测定泡沫体积(V0),将其静置30min后,测定泡沫体积(V1)。起泡力(FAI)和泡沫稳定性(FS)的计算方法分别如下[11]:

1.3.5 SDS-PAGE分析
十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)8%分离胶,5%浓缩胶。样品质量浓度为1mg/mL、上样量为10μL、浓缩胶电泳电压60V、电流50mA、分离胶电压110V、电流50mA。染色液采用质量分数为0.25%的考马斯亮蓝R-250染色液(取1.25g考马斯亮兰R-250,加甲醇227mL、冰醋酸46mL、蒸馏水227mL、溶解混匀后过滤备用),脱色用0.5mol/L的NaCl脱色液[12]。
1.3.6 差示扫描量热分析
利用Netzsch DSC 204 F1型差示扫描量热仪研究样品热特性。利用纯金属铟(99.99%)校正仪器的温度和热焓。准确称取5mg样品样品放入盖子中心带孔的铝坩埚中,密封,用相同的空坩埚作参比。以5℃/min从25℃加热到200℃。整个过程均在干燥N2下进行,吹扫气20mL/min,保护气60mL/min。
1.3.7 凝胶扫描电镜分析
将所需样品制备成凝胶后切片,用0.2%戊二醛溶液固定12h后,漂洗,然后经体积分数为50%、70%、90%、100%的乙醇梯度脱水,用醋酸异戊酯置换出乙醇,临界点干燥,经离子溅射仪喷金后,于扫描电子显微镜下观察其网络结构、拍照[13]。
2 结果与分析
2.1 凝胶强度分析

图1 反应时间对CMC蛋清粉凝胶强度影响Fig.1 Effect of reaction time on gel strength of egg white powder(60 ℃, CMC)
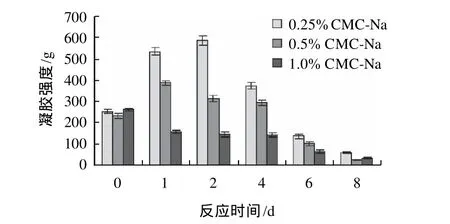
图2 反应时间对CMC-Na蛋清粉凝胶强度的影响Fig.2 Effect of reaction time on gel strength of egg white powder(60 ℃, CMC-Na)
由图1、2可知,当反应温度为60℃时,CMC与CMC-Na的质量分数为0.25%和0.5%的样品的凝胶强度均随反应时间的延长先增大后降低,在反应时间为2d时,凝胶强度均达到最大值,此时含量分别为0.25%和0.5%的CMC凝胶强度分别增大104%和79%,0.25%和0.5%的CMC-Na凝胶强度分别增大111%和67%而后随反应时间的延长而逐步降低。CMC与CMC-Na的质量分数为1%的样品的凝胶强度均随反应时间的延长而降低。
由图3、4可知,当反应温度为70℃时,0.25%CMC与0.25%CMC-Na的凝胶强度均随反应时间的延长先增大后降低,在反应时间为1d时,凝胶强度最大,此时其凝胶强度分别增大86%和67% 。CMC与CMC-Na的质量分数为0.5%和1%的样品的凝胶强度均随反应时间的延长而降低,反应时间为4d时其形成的凝胶强度已十分微弱。

图3 反应时间对CMC蛋清粉凝胶强度影响Fig.3 Effect of reaction time on gel strength of egg white powder(70 ℃, CMC)

图4 反应时间对CMC-Na蛋清粉凝胶强度的影响Fig.4 Effect of reaction time on gel strength of egg white powder(70 ℃, CMC-Na)
2.2 样品色度分析

表2 反应过程中CMC和CMC-Na蛋清粉色度的变化Table2 Chromaticity change of egg white powder during reaction

续表2
实验所用蛋清粉虽经脱糖处理,但脱糖不可能将所含葡萄糖完全脱除,故高温下易于发生美拉德反应,产生褐变、不良风味,影响产品的感官品质[14-15]。由表2可知,各样品在反应过程中均发生了不同程度的褐变反应。反应温度为60℃时,L*随反应时间的延长而不断变小;70℃时,反应2d后,各样品L*趋于稳定。含CMC的样品的a*均在反应时间为1d时出现一个最小值,而后逐渐增大。反应温度为60℃时,含CMC-Na的样品的a*在反应时间为4d前随时间的延长而逐渐增大,4d后a*趋于稳定;而反应温度为70℃时,2d后a*即趋于稳定。反应1d后各样品的b*明显增大,而后基本趋于稳定值。由上述结果可知,蛋清粉在反应过程中均发生了不同程度的褐变,反应温度为60℃时的褐变程度要比70℃小。
2.3 起泡性分析

图5 改性前后蛋清粉的起泡力比较Fig.5 Change of FAI of egg white powder after modification (2 d)

图6 改性前后蛋清粉的泡沫稳定性比较Fig.6 Change of FS of egg white powder after modification (2 d)
由于反应2d后样品的凝胶强度较高,本实验取反应2d的样品测定其起泡力(FAI)和泡沫稳定(FS),结果如图5和图6所示。由图5可知,各反应2d后样品的起泡力均明显增强,并且CMC和CMC-Na的质量分数越小,起泡力越好,其中以0.25%的CMC和CMC-Na的起泡力最强,分别增大0.6和0.5倍。70℃反应2d后样品的起泡力比60℃反应得到的样品略小。由图6可看出,各组的泡沫稳定性分别随CMC和CMC-Na含量的增大而降低。反应温度为60℃时比70℃得到样品的起泡力和泡沫稳定性好。
2.4 SDS-PAGE分析
为了研究鸡蛋清蛋白与CMC及CMC-Na改性后其蛋白质分子交联程度的变化,利用SDS-PAGE对脱糖蛋清粉及交联反应后的蛋清粉进行分子质量分析,结果如图7所示。

图7 改性前后蛋清粉的SDS-PAGE照片Fig.7 SDS-PAGE of egg white powder before and after modification
由图7可知,与脱糖蛋清粉相比,各交联后样品的蛋白质分子质量均明显增大,蛋白质溶解度降低,小分子质量蛋白减少,且反应时间的延长和反应温度的升高可加剧小分子质量蛋白质减少的程度,故各样品的交联度亦随反应时间的延长和反应温度的升高而变大。电泳图谱中条带颜色的深浅亦可反映出蛋清粉溶解度的变化。结果表明,蛋清粉的溶解度亦随反应时间和反应温度的升高而逐渐降低,其中样品在70℃反应6d后图中只能看出微弱的条带,溶解度非常低,而60℃反应2d的样品溶解度与改性前相比无明显变化。
2.5 差示扫描量热分析
将改性2d与未改性的蛋清粉进行DSC分析结果如图8、9所示。结果表明,6个样品均在50~100℃之间出现一个明显的吸热宽峰,蛋清蛋白的主要变性温度在60~90℃之间,然而由于改性后的样品分别在60℃和70℃下反应了2d,故其变性温度应分别在60℃和70℃以上。由于CMC、CMC-Na及蛋清蛋白均具有较好的亲水性,样品中含有一定量的水分,因此升温过程中水分不断散失吸热。样品与水的相互作用弱,则加热过程中更快、更容易散失,吸热峰出现的早结束的早;相反,与水的相互作用力强,吸热峰出现的晚结束的晚。未改性的0.25%CMC-Na及0.25%CMC的峰值分别为46.94℃和56.97℃,而各样品改性后的峰值均在55℃左右,热焓值明显增大。这可能是由于CMC-Na 及CMC的加入影响了蛋清蛋白的热力学性质。

图8 改性前蛋清粉和改性后CMC-Na蛋清粉DSC图谱Fig.8 DSC curves of egg white powder before and after modification(CMC-Na)
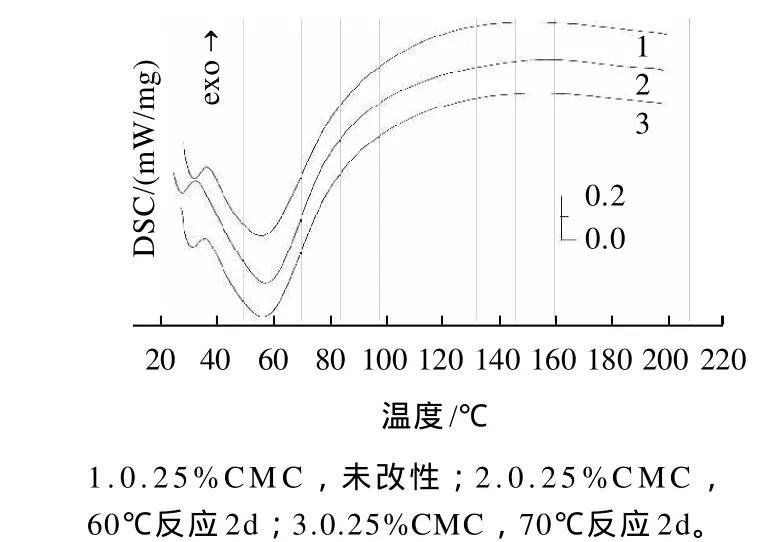
图9 改性前蛋清粉和改性后CMC蛋清粉DSC图谱Fig.9 DSC curves of egg white powder before and after modification(CMC)
2.6 凝胶扫描电镜分析
为了从微观结构上对改性后蛋清粉凝胶强度增加的机理进行分析探讨,对改性前后CMC和CMC-Na含量均为0.25%的样品凝胶进行SEM分析,结果如图10所示。结果表明,样品反应2d后其凝胶网络结构变得更为均匀紧密,而以60℃反应2d后的样品凝胶网络结构最为紧密均匀。各组样品中含0.25%CMC-Na的样品凝胶网络结构均比含0.25%CMC的样品凝胶网络结构均匀紧密。这与2.1节得出的凝胶强度60℃反应2d后的样品凝胶强度最强的结论相符合。

图10 改性前后蛋清粉凝胶的SEM照片(×1000)Fig.10 SEM of egg white gel before and after modification (×1000)
3 讨 论
脱糖蛋清粉经与CMC和CMC-Na的改性后,发生了交联聚合反应[16],凝胶强度、表观黏度等均发生变化,反应温度为60℃、反应时间为2d时各样品的凝胶强度达到最大值,且60℃反应温度下得到的样品的凝胶强度比70℃强,褐变程度较低,可以被用于食品工业中。起泡性的分析表明,各反应2d后样品的起泡性均明显增强,其中以60℃,添加0.25%的CMC和CMC-Na的起泡力最强,分别增大 0.6和0.5倍,泡沫稳定性亦明显增强。通过SDS-PAGE凝胶电泳和SEM分析得出,小分子质量蛋白含量明显降低,说明蛋白质分子与CMC或CMC-Na之间,或者蛋白质分子之间发生了交联反应[16]。结果表明,适度的交联反应可以增大蛋清粉的凝胶强度,提高起泡力和泡沫稳定性,而过度交联则会造成分子质量过大、溶解度降低等,进而影响蛋清粉的各种功能性质[17]。因此,在生产中可根据对产品的不同需求,调整生产工艺,制备高凝胶性或高起泡性等专用蛋清粉。
利用碳水化合物与蛋清粉蛋白的美拉德反应,制备高凝胶性蛋白粉已有较多研究。但采用具有强亲水性的离子型多糖羧甲基纤维素及羧甲基纤维素钠对蛋清粉进行改性的研究尚未见报道,然而由于CMC具备一定取代度的羧基及其可能参与的酯化、缩合反应,必然对改性产物的性能产生影响,特别是对表面活性产生影响。对于蛋清粉与CMC和CMC-Na改性后功能性质和结构变化仍需进一步研究。
[1] BIN MD YASIR S, SUTTON K H, NEWBERRY M P, et al. The impact of Maillard cross-linking on soy proteins and tofu texture[J].Food Chemistry, 2007, 104: 1502-1508.
[2] GU Xin, CAMPBELL L J, EUSTON S R. Influence of sugars on the characteristics of glucono-α-lactone-induced soy protein isolate gels[J].Food Hydrocolloids, 2009, 23: 314-326.
[3] EINHORN-STOLL U, ULBRICH M, SEVER S, et al. Formation of milk protein-pectin conjugates with improved emulsifying properties by controlled dry heating[J]. Food Hydrocolloids, 2005, 19: 329-340.
[4] CAMPBELL L, RAIKOS V, EUSTON S R. Modification of functional properties of egg-white proteins [J]. Nahrung/Food, 2003, 47(6): 369-376.
[5] KIKA K, KORLOS F, KIOSSEOGLOU V. Improvement, by dry-heating,of the emulsion-stabilizing properties of a whey protein concentrate obtained through carboxymethylcellulose complexation[J]. Food Chemistry, 2007, 104: 1153-1159.
[6] DIFTIS N, KIOSSEOGLOU V. Improvement of emulsifying properties of soybean protein isolate by conjugation with carboxymethyl cellulose[J]. Food Chemistry, 2003, 81: 1-6.
[7] 张胜善. 蛋品加工学[M]. 台北: 华香园出版社, 1999: 467-476.
[8] DIFTIS N, KIOSSEOGLOU V. Stability against heat-induced aggregation of emulsions prepared with a dry-heated soy protein isolate-dextran mixture[J]. Food Hydrocolloids, 2006, 20: 787-792.
[9] ABILO-MUNIZAGA G, BARBOSA-CANOVAS G V. Color and textural parameters of pressurized and heat-treated surimi gels as affected by potato egg white-starch blending gel[J]. Food Research International,2004, 37: 767-775.
[10] LECHEVALIER V, JEANTET R, ARHALIASS A, et al. Egg white drying: Influence of industrial processing steps on protein structure and functionalities[J]. Journal of Food Engineering, 2007, 83: 404-413.
[11] LIANG Y, KRISTINSSON H G. Structural and foaming properties of egg albumen subjectedto different pH-treatments in the presence of calcium ions[J]. Food Research International, 2007, 40: 668-678.
[12] KIKA K, KORLOS F, KIOSSEOGLOU V. Improvement, by dry-heating,of the emulsion-stabilizing properties of a whey protein concentrate obtained through carboxymethylcellulose complexation[J]. Food Chemistry, 2007, 104: 1153-1159.
[13] TABILO-MUNIZAGA G, BARBOSA-CANOVAS G V. Pressurized and heat-treated surimi gels as affected by potato starchand egg white:microstructure and water-holding capacity[J]. Lebensm Wiss u Technol,2005, 38(1): 47-57.
[14] MORALES F J, van BOEKEL M A J S. A study on advanced Maillard reaction in heated casein/sugar solutions: colour formation[J]. Int Dairy Journal, 1998, 8: 907-915.
[15] ACQUISTUCCI R. Influence of maillard reaction on protein modification and colour development in pasta-comparison of different drying conditions[J]. Lebensm Wiss u Technol, 2000, 33(1): 48-52.
[16] GERRARD J A, BROWN P K, FAYLE S E. Maillard crosslinking of food proteins II: the reactions of glutaraldehyde, formaldehyde and glyceraldehyde with wheat proteins in vitro and in situ[J]. Food Chemistry,2003, 80: 35-43.
[17] CAMPBELL L, RAIKOS V, EUSTON S R. Modification of functional properties of egg-white proteins [J]. Nahrung/Food, 2003, 47(6): 369-376.
Properties Improvement of Egg Albumen by Conjugation with CMC or CMC-Na
XU Bao-li,LI Bin*,ZHU Bo,XIA Ying,FAN Jin-song,ZHENG Xiao-dong,CAI Jie,MA Mei-hu
(College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
Egg white was blended with sodium carboxymethyl cellulose (CMC-Na) or carboxymethyl cellulose (CMC) of certain concentration respectively, and the dry-heated products were obtained at relative humidity (75%) after freeze drying. The products were analyzed on gel strength, color scale, scanning electron microscope observation, SDS-PAGE, and Differential Scanning Calorimetric (DSC) at intervals. The results showed that a significant increase in the gel strength of egg white, more uniform and compact gel network structure and a significant reduction in the content of proteins with small molecular weight were found after 2 days of reaction at 60 ℃. The foaming capacity of egg albumen was found to be enhanced significantly by 2-day-long reaction, but the excessive cross-linking might lead to a large molecular weight, decrease the solubility of egg white powder and darken its color. Adding CMC or CMC-Na at a concentration of 0.25% resulted in the best foaming capacity at 60 ℃, with 0.6-fold and 0.5-fold increases in comparison with a blank sample, respectively and meanwhile, a significant improvement was observed for foam stability. It was proved that a novel egg white powder with both higher gel property and foaming capacity can be obtained under the reaction conditions.
egg albumen;carboxymethyl cellulose;crosslinking reaction;gel strength
TS253.1
A
1002-6630(2011)03-0040-06
2010-05-23
国家“863”计划项目(2007AA10Z310;2007AA100408);教育部新世纪优秀人才项目(NECT-2007073);湖北省杰出青年人才基金项目(2007ABB016)
徐保立(1984—),男,硕士研究生,研究方向为肉类蛋品化学。E-mail:baoli84@163.com
*通信作者:李斌(1972—),男,教授,博士,研究方向为食物大分子化学与工艺学。E-mail:libinfood@mail.hzau.edu.cn

