纺锤体检查点蛋白Cenp-E过低表达与肝癌细胞染色体异常的关系
蔡 勇,彭爱红
(1.湖南博雅眼科医院检验科,湖南 长沙 410007;2.湖南省临床检验中心,湖南 长沙 410007)
早在1914年,德国科学家Theodor Boveri就认为恶性细胞有不稳定的染色体,这些不稳定染色体能导致癌症的发生。1998年,Peter等提出了非整倍体导致癌症发生的假说,他们的实验表明非整倍体是独立于基因突变外导致癌症发生的机制[1]。SCP的功能就是监测细胞染色体分离。检查点功能丧失的一个后果是遗传不稳定性,促使细胞更容易恶变[2]。本试验通过间接免疫荧光和RNAi技术在HepG-2和LO2细胞中研究Cenp-E在HepG-2细胞染色体数目异常发生过程的作用,以期能够发现Cenp-E在肿瘤细胞染色体数目异常中所起作用。
1 材料与方法
1.1 材料
HepG-2细胞和LO2细胞购自中国科学院上海生命科学研究院细胞库,CENP-E兔一抗,罗丹明标记Cenp-E红色荧光二抗购自Santa-Cruz公司。Alexa flour 350 Tubule蓝色二抗购自AB公司。DMEM培养基,胎牛血清购自美国GIBICO公司。DIPA染料购自Sigma公司。Trizol试剂购自Invitroge公司,PrimeScript RT试剂盒购自 TaKaRa公司,质粒抽提试剂盒购自上海华舜公司。Lipofectamine 200购自Invitrogen公司。
1.2 shRNA设计及质粒的构建
用Invitrogen公司在线设计软件,设计以Gen-Bank中CENP-E基因(编号NM.001813)的编码区(CDS)为靶向的shRNA引物:正义链5'-GATCCCG-cACCG- ATGCTGGTGACCTCCAACAGAGAGCTCACCACCATCCGTGCTA-3',反义链5'-AGCTYAAAAAAGCACGCATGCTGGTGACCTCTCTCT FGAAGAGGTCACCAGCATCCGTGCGG-3'。
用BLAST软件进行同源性分析证实为靶基因高度保守区段后,送上海Invitrogen公司采用化学合成方法合成单链寡核苷酸;退火形成双链DNA,插入线性载体pGenesil.1质粒中;转化至感受态大肠埃希菌DH5a后,挑选单克隆,经扩增,抽提质粒,双酶切鉴定和DNA测序分析。
1.3 转染质粒DNA及实验分组
转染的前一天将LO2细胞传代到24孔板内,细胞密度为 1×105~2×105/孔,培养 12 h 以上,当细胞密度达80%左右时即可进行转染。
将细胞分为实验组:pshRNA-Cenp-E-1+lipofectamine2000; 对照组:pgenesil-1+lipofectamine2000;空白组:ddH2O+lipofectamine2000。
1.4 实时荧光定量PCR检测Cenp-E mRNA表达
分别收集未转染和转染48 h后的细胞,提取RNA,反转录为cDNA。用已经制备好的Cenp-E和内参GAPDH标准品及定量检测的引物和探针,在ABI7000定量PCR仪上进行RFQ-PCR扩增。计算目的基因的mRNA拷贝数/内参 GAPDH基因的mRNA拷贝数的比值,比较各组细胞内Cenp-E mRNA的水平,以此来评价RNA干扰质粒载体对目的基因表达的抑制作用。
1.5 间接免疫荧光检测
首先在24孔板中制备细胞爬片,以每孔(1~2)×105个细胞接种到24孔板中继续培养。培养12~18 h后弃培养孔中培养液,用预温到37℃的PBS清洗细胞表面3次。用预冷到-20℃甲醇,-20℃固定20 min。PBS洗3次。10%羊血清封闭30 min。弃培养液,不洗,直接加入兔抗人Cenp-E 37℃孵育120 min。PBS洗3次。于暗室中加入羊抗兔二抗,37℃孵育60 min。PBS洗3次。加入DAPI37℃孵育5 min。50%甘油封片做激光共聚焦。
1.6 细胞周期分析
用100 ng/mL Nocodazole同时处理HepG-2和LO2细胞 6 h~12 h,0.25%胰蛋白酶消化细胞,DMEM重悬后移至1.5 mL离心管中,PBS离心清洗3遍后,加入PBS配制的 75%冰乙醇,4℃过夜,送重庆医科大学儿科医学研究所做细胞周期分析。
1.7 染色体分析
对已长满80%LO2和HepG-2放入4℃冰箱中6~12 h,然后加入秋水仙素,37℃孵箱继续培养6~10 h,以获得更多的中期分裂相细胞。收集细胞2500 r/min,离心5 min,加预温到37℃的0.075 mol/L KCl 8mL,37℃水浴 15min;加 300μL 固定液(甲醇:冰醋酸=3:1),充分混匀,2500 r/min 离心 5 min。 .重悬细胞,室温放置30 min(或4℃过夜),2000 r/min离心5 min,此步骤重复2次。去上清,加500 μL固定液,混匀,吸2~3滴在垂直距玻片约30~50 cm高度的位置滴在预冷的干净玻片上,晾干,用Giemsa染色5~10min镜检。
2 结果
2.1 质粒鉴定
将双酶切筛选出的阳性克隆送公司测序,结果显示与设计的DNA片段序列完全一致,证实shRNA载体构建成功。
2.2 RFQ-PCR结果
2.2.1 Nocodazole处理前后LO2细胞和HepG-2细胞荧光定量结果
从表1可见,用荧光定量PCR检测Cenp-E基因在两种细胞处理前后mRNA水平,以对照组与实验组样品Cenp-E基因mRNA拷贝数/GAPDH基因mRNA拷贝数的均值作为该样品中Cenp-E基因表达水平,结果显示处理前两种细胞中Cenp-E基因mRNA水平用成组t检验P>0.05,差异无统计学意义;处理后LO2细胞 Cenp-E基因 mRNA水平明显高于 HepG-2细胞(P<0.05)。

表1 LO2细胞和HepG-2细胞用Nocodazole处理前后荧光定量结果(Mean±SD)
2.2.2 LO2细胞干扰前后CENP-E mRNA表达RFQ-PCR检测结果
Cenp-E mRNA表达RFQ-PCR检测结果显示,LO2/shRNA-Cenp-E组的Cenp-E基因mRNA拷贝数/GAPDH基因mRNA拷贝数的比值为(1.2±0.1)×10-2, 与未转染 LO2组 (8.8±0.1)×10-2和 LO2/pGenesil-1 空载对照组(9.8±0.1)×10-2比较,差异有统计学意义(P<0.05)。提示shRNA-Cenp-E质粒载体能在mRNA水平上特异性地抑制LO2细胞中Cenp-E基因的表达。
2.3 细胞周期分析的流式结果

图1 HepG-2和LO2细胞用Nocodazole处理前后的流式细胞仪检测结果
因为Cenp-E基因在分裂期高表达,在间期基本不表达,我们用Nocodazole处理使HepG-2细胞和LO2细胞同步在分裂期的细胞基本一样多,便于在同一水平来分析Cenp-E基因在两者之间的差异。流式细胞仪测定处理前后的HepG-2细胞和LO2细胞。结果显示,处理前两种细胞G2-M期的比例差异不显著 (LO2处理前中期细胞比例是0.0967 ±0.0241,HepG-2 是 0.1250 ±0.0287,P >0.05),结果见图 1-A、C,处理后两种细胞的 G2-M期细胞都大幅增加(图1-B、D)。处理后两组细胞中期细胞比例差异不显著,处理后中期细胞比例LO2为 0.9543±0.275,HepG-2 为 0.9783±0.218,差异无统计学意义(P>0.05)。提示处理后两种细胞同步在分裂期的细胞基本一样多。
2.4 染色体分析结果
统计分析两种细胞各100个以上中期细胞分裂像(图2),图3为两种细胞其中一个分裂像,结果显示HepG-2细胞中染色体数目异常细胞的比例高于 LO2细胞。

图2 HepG-2细胞和LO2细胞异常染色体的结果

图3 部分染色体数目核型
2.5 间接免疫荧光结果
2.5.1 Nocodazole处理后HepG-2和LO2细胞间接免疫荧光结果
从图4,5得知,在异常分裂的细胞核中,Cenp-E蛋白的表达量明显比正常分裂的细胞少,说明Cenp-E的表达量过低可能是促使细胞错误分裂的原因之一。

图4 HepG-2细胞中异常有丝分裂细胞间接免疫荧光图
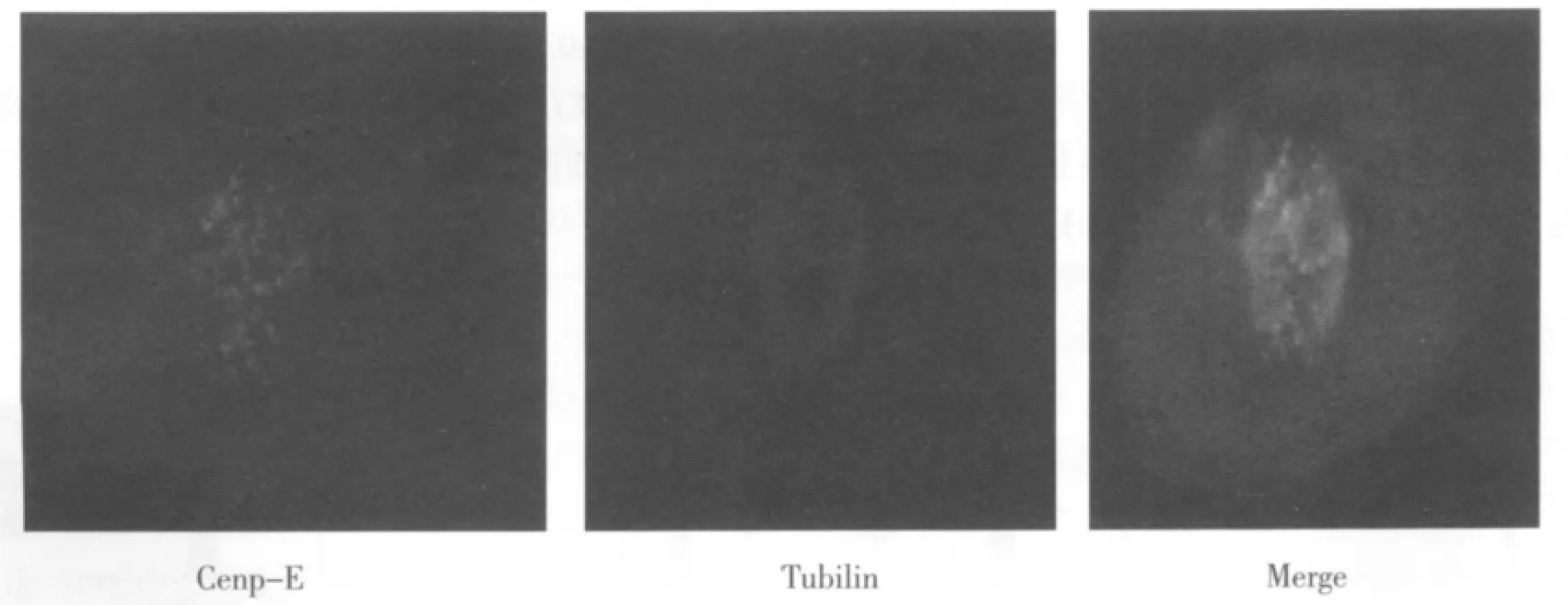
图5 LO2细胞中正常有丝分裂细胞间接免疫荧光图
2.5.2.干扰CENP-E蛋白前后的间接免疫荧光结果
从图 6,7可以观察到 LO2细胞干扰以后,Cenp-E蛋白表达下降(红色亮点减少),与干扰前的细胞比较,干扰后LO2细胞的核分裂明显出现异常。

图6 干扰Cenp-E后LO2细胞间接免疫荧光结果

图7 未干扰Cenp-E的LO2间接免疫荧光图
2.5.3 核异常比例
从图8可以看出干扰后LO2细胞的细胞核出现卫星核(大箭头所示),还有些核出现不规则的变化(小箭头所示)。而在正常的LO2细胞核大致正常(图9)。把干扰前后的细胞分别分析200个细胞核发现,干扰后LO2细胞核异常比例达到21%。而未干扰的细胞只有9%。差异具有统计学意义(P<0.05)(如图10)。

图8 干扰后LO2细胞核型图

图9 未干扰的LO2细胞核型图

图10 LO2细胞干扰前后核异常比例图
3 讨论
Cenp-E是一种重要着丝粒特异蛋白,它主要定位于着丝粒的外层,现在发现它还是一种着丝粒点与微管有效连接的动力蛋白。Abrieu等发现Cenp-E的细胞内水平和定位皆受到严格控制。现在越来越多的实验证明Cenp-E在研究纺锤体检查点(spindle checkpoint,SCP)机制起着非常重要的作用,现在研究表明,一定量的Cenp-E水平,对SCP的激活是起非常重要的作用[3]。Cenp-E在着丝粒的定位要受到着丝粒组装的上游蛋白质如HsNU F、CENP-H[4]的影响。 在 SCP 机制,Cenp-E主要是通过自身的结构变化影响BubR1的功能来起作用[5]。
而另一方面在许多癌细胞发现有异常的SCP功能。例如,Mad2表达降低见于鼻咽癌、肝细胞癌、人乳腺癌及其一些乳腺癌细胞系和卵巢癌等,并与SCP缺陷切相关[6]。Bubl的mRNA降低也见于结肠癌和急性粒细胞性白血病[7],高水平Bubl、BubR1和Bub3表达也与胃癌细胞增殖能力密切相关[8]。但Cenp-E与肿瘤之间的关系还不明确。本实验发现无论是 LO2细胞 还是HepG-2细胞,在用 Nocodazole处理之前,HepG-2细胞中分裂期细胞的比例(12.5%)略高于 LO2细胞(9.67%),Cenp-E基因的mRNA量也高于LO2细胞,但均无统计学差异。当我们用Nocodazole处理两种细胞,使它们都高度同步在分裂期,同时用荧光定量PCR检测Cenp-E基因的mRNA表达量,处在分裂期的LO2细胞Cenp-E基因表达量明显高于HepG-2细胞。我们推测,在正常培养的细胞中,由于两种细胞分裂期细胞所占的比例均较低,Cenp-E基因表达的差异难以显现,当细胞被高度同步化于中期时这种差异才更为明显。同时通过间接免疫荧光发现在出现错误分裂的细胞中,Cenp-E蛋白表达量明显比正常分裂的细胞少。由此表明LO2细胞在分裂期对Cenp-E基因表达的应激上调能力高于 HepG-2,即肝癌细胞分裂期Cenp-E蛋白表现为相对缺乏,从而引起纺锤体检查点监控功能缺陷,导致分裂中期纺锤丝与染色体着丝粒未全部正常连接时细胞即进入后期,引起细胞染色体数目异常。我们进一步通过构建Cenp-E小干扰RNA载体转染到LO2细胞中。通过间接免疫荧光发现,在Cenp-E蛋白表达在被干扰的细胞中表达明显下降,并且被干扰细胞的核分裂出现异常。通过统计分析发现干扰Cenp-E的LO2细胞中的核异常的比例(21%)明显高于未干扰的细胞(9%)。进一步说明Cenp-E表达降低直接或间接影响着丝粒的正确装配,最终导致染色体数目异常,细胞出现癌前病变[9]。但Cenp-E具体怎样参与细胞染色体异常过程还不是很清楚。本研究从一个侧面反映肝癌细胞分裂期 Cenp-E蛋白表达应激性的增高能力。
明显低于正常肝细胞。提示纺锤体检查点蛋白Cenp-E的相对缺乏可能是肝癌细胞染色体数目异常形成的原因之一,为进一步探明Cenp-E在肿瘤发生中的作用奠定基础,从而对肿瘤患者的治疗更有针对性。
[1]Duesherg P,Rausch C,Rasrdck D,et a1.Genetic instability of cancer cell is proportional to their degree of aneuploidy[J].Proc Natl Acadsci USA,1998,95(23):13692-13697.
[2]丛文铭,吴孟超.肝癌基因组不稳定性的研究现状与展望[J].第二军医大学学报,2002,23(1):5-8.
[3]Pan J,Chen RH.Spindle checkpoint regulates Cdc20p stability in Saccharomyces cerevisiae[J].Genes Dev,2004,18:1439-1451.
[4]Orthaus S,Ohndorf S,Diekmann S.RNAi knockdown of human kinetochore protein CENP-H[J].Biochem Biophys Res Commun.2006,348(1):36-46.
[5]Maia AF,Lopes CS,Sunkel CE.BubR1 and CENP-E have antagonistic effects upon the stability of microtubule-kinetochore attachments in Drosophila S2 cell mitosis[J].Cell Cycle,2007,6(11):1367-1378.
[6]Fraschini R,Beretta A,Sironi L,et al.Bub3 interaction with Mad2,Mad3 and Cdc20 is mediated by WD40 repeats and does not require intact kinetochores[J].EMBO J,2001,20:6648-6659.
[7]Chung E,Chen RH.Phosphorylation of Cdc20 is required for its inhibition by the spindle checkpoint[J].Nat Cell Biol,2003,5:748-753.
[8]Tang Z,Shu H,Oncel D,et al.Phosphorylation of Cdc20 by Bub1 provides a catalytic mechanism for APC/C inhibition by the spindle Checkpoint[J].Mol Cell,2004,16:387-397.
[9]Liu D,Zhang N,Du J,Cai X,Interaction of Skp1 with CENP-E at the midbody is essential for cytokinesis.Biochem Biophys Res Commun[J].2006,345(1):394-402.

