5,7-DMF对MDA-MB-453细胞凋亡和14-3-3σ基因表达的影响
刘胜姿,刘英姿,全梅芳,谭宇婷,周 源
(湖南师范大学医学院,湖南 长沙 410013)
白杨素是从多种植物、蜂胶和蜂蜜中提取的一种具有广泛生物活性的黄酮类化合物,实验证明白杨素具有广谱抗肿瘤活性,但因其在肠道吸收甚少,并且5,7-位羟基在体内易被迅速糖基化代谢以致活性降低,使其临床应用受到限制[1]。有研究显示,无羟基的黄酮结构分子能有效促进HT-29细胞的分化和凋亡[2],证明羟基并不是白杨素抗肿瘤作用所必须的基团。Wen等证明,多酚类化合物甲基化后肠道吸收率更高,肝代谢更稳定,更有利于开发成有效的抗癌药物[3]。我们先前的实验研究也发现,与先导化合物白杨素相比,5,7-二甲氧基白杨素对体外培养的人胃癌SGC-7901细胞和人结肠癌HT-29细胞生长具有更强的抑制作用[4]。
14-3-3σ是14-3-3蛋白家族中的一个成员,作为一个细胞周期负调控因子,14-3-3σ的活化可以引起细胞周期G2/M期阻滞从而发挥抑癌基因的作用[5]。而14-3-3σ基因的缺乏或甲基化失活在乳腺癌的发病中起着重要作用[6]。我们的预实验表明,MDA-MB-453细胞株为一株14-3-3 σ基因甲基化失活的人乳腺癌细胞株。本文旨在研究自主设计合成的新型白杨素类似物5,7-DMF诱导人乳腺癌MDA-MB-453细胞凋亡作用,并探讨其调控过程是否与DMF通过表观遗传学机制抑制14-3-3σ基因甲基化和上调14-3-3σ蛋白表达,复活14-3-3σ基因功能有关。
1 材料与方法
1.1 试剂
5,7-二甲氧基黄酮 (5,7-DMF,Sigma公司;分子量:282,性状:白色粉末,纯度:98%);5-氮杂胞苷(5-Aza-2'-deoxycytidine,5-Aza-CdR,Sigma公司);碘化丙啶(PI,Sigma 公司);TRIzol(美国 Invitrogen公司),基因组提取和逆转录试剂盒 (美国Promega公司),14-3-3σ 和 β-actin 单克隆抗体(美国 Santa Cruz公司)。
1.2 细胞培养
人乳腺癌MDA-MB-453细胞购于中国典型培养物保藏中心(中国武汉市),用含10%小牛血清的DMEM培养基,加100 U/mL青霉素,100 U/mL链霉素,置于37℃,5%CO2及饱和湿度培养箱中培养,取对数生长期细胞用于实验。
1.3 流式细胞术分析
按照先前文献[7]的方法进行,用EPICS XL型流式细胞仪(美国COULTER公司)测定10000个细胞的DNA含量,SYSTEM II软件分析细胞凋亡率。
1.4 基因组DNA提取
按A1120试剂盒说明书操作(美国Promega公司),DNA纯化后,在紫外分光光度A260/280处检测,计算其纯度和含量。样品于-20℃保存。
1.5 甲基化特异性聚合酶链反应(MSP)
按照文献[8]报道合成引物,甲基化引物(M)上游:5'-TGGTAGTTTTTATGAAAGGCGTC-3',下游:5'-CCTCTAACCGCCCACCACG-3',产物片段105 bp,非甲基化引物(U)上游:5'-ATGGTAGTTTTTATGAAAGGTGTT-3', 下 游 :5'-CCCTCTAACCACCCACCACA-3',产物片段107 bp。反应体系及反应条件按文献[8]的方法进行,产物经2%琼脂糖凝胶电泳验证。
1.6 逆转录PCR(RT-PCR)检测
TRlzol提取总RNA和逆转录cDNA的合成按试剂盒说明书操作。
用prime primier 5.0软件自行设计 14-3-3σ引物 (上游:5'-TGCGAAGAGCGAAACCTGC-3',下游:
5'-CTGTTGGCGATCTCGTAGTGG-3',产物片段446 bp)和内参照β-actin引物(上游:5'-CCCTGGACTTCGAGCAAGAGAT-3',下游:5'-GATTTTCTGCGCAAGTTAGG-3',产物片段 520 bp)。反应体系及反应条件按文献[9]的方法进行,产物经1%琼脂糖凝胶电泳验证。
1.7 Western blotting分析
Western blotting分析按照先前文献[7]描述的方法完成。抗人14-3-3σ和β-actin单克隆抗体作为一抗。用增强型ECL蛋白质印迹分析系统进行目的条带信号的检测。
1.8 统计学分析
实验数据录入SPSS 15.0 for windows evaluation软件,建立数据库,各组实验数据均用均数±标准差(mean±SD)表示,用One Way ANOVA行方差分析。P<0.05为统计学意义显著标准。
2 结果
2.1 5,7-DMF对人乳腺癌MDA-MB-453细胞活性的影响
MTT 比色测定结果表明,0.1~30.0 μmol/L 的5,7-DMF显著抑制人乳腺癌MDA-MB-453细胞增殖活性,其抑制作用随浓度的增加而增强。5,7-DMF(10.0 μmol/L)对乳腺癌 MDA-MB-453 细胞的抑制作用较同浓度的去甲基化药物5-Aza-CdR强(表 1)。
2.2 5,7-DMF对人乳腺癌MDA-MB-453与MCF-7细胞凋亡率的影响

表1 5,7-DMF对人乳腺癌MDA-MB-453细胞活性的影响(mean±SD,n=3)
PI染色FCM分析结果显示,5,7-DMF (5、10和20 μmol/L)处理 48 h,以浓度依赖的方式诱导MDAMB-453细胞凋亡率增加 (表2)。其作用效价强度大于5-Aza-CdR。
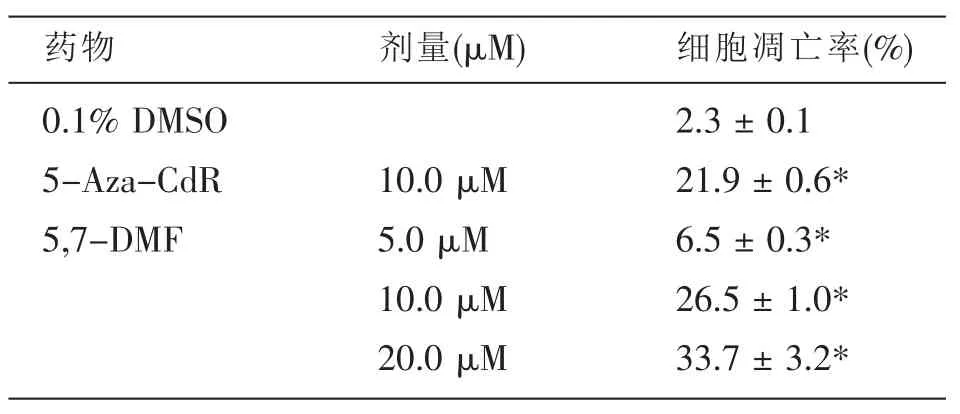
表2 5,7-DMF对人乳腺癌MDA-MB-453细胞凋亡率的影响(mean±SD,n=3)
2.3 5,7-DMF抑制人乳腺癌MDA-MB-453细胞14-3-3σ基因甲基化
如图 1所示,10 μmol/L 5,7-DMF与 5-Aza-CdR分别处理72 h,均能有效抑制MDA-MB-453细胞14-3-3σ基因甲基化。

图1 5,7-DMF抑制人乳腺癌MDA-MB-453细胞14-3-3σ基因甲基化
2.4 5,7-DMF上调人乳腺癌MDA-MB-453细胞14-3-3σ基因mRNA表达水平
如图 2所示,10 μmol/L 5,7-DMF 与 5-Aza-CdR分别处理72 h,均能显著提高MDA-MB-453细胞14-3-3σ基因mRNA表达水平。

图2 5,7-DMF上调人乳腺癌MDA-MB-453细胞14-3-3σ基因mRNA表达
2.5 5,7-DMF上调人乳腺癌MDA-MB-453细胞14-3-3σ蛋白表达水平
如图3所示,5,7-DMF(1,5,10μmol/L)处理72小时,均能提高MDA-MB-453细胞14-3-3σ蛋白表达水平,并呈浓度依赖性,其中10 μmol/L 5,7-DMF作用效果与同浓度5-Aza-CdR相当。

图3 5,7-DMF上调人乳腺癌MDA-MB-453细胞14-3-3 σ 蛋白表达
3 讨论
有资料显示,乳腺癌已成为全球妇女发病率最高的恶性肿瘤[1],我国乳腺癌的发生率也呈逐年上升趋势。目前,治疗乳腺癌的方法主要有:手术、化疗、放疗、内分泌治疗。而化学药物治疗在乳腺癌综合治疗中仍然占主导地位,但因其严重的毒副作用极大地降低了它的临床应用价值。因此,寻找乳腺癌特异性肿瘤分子标志以及高效、低毒的新的分子靶向治疗药物具有重大的社会效益和临床应用前景。
14-3-3σ是人类乳腺上皮的一个特异性标记,它的表达可介导DNA损伤通过p53依赖途径所诱导[10]。当DNA发生损伤后,p53被激活磷酸化,磷酸化的p53可以和14-3-3σ启动子上游长度为1.8kb的转录起始位点结合,从而诱导14-3-3σ的表达,引起细胞周期G2/M期阻滞,抑制细胞的生长。Yang等研究表明,14-3-3σ可以稳定p53的表达并且增加p53的转录活性,提示p53和14-3-3σ之间存在着一个正反馈调节通路[11]。在乳腺癌的发病进程中频繁出现14-3-3σ基因缺乏或其表达下调[10]。可见14-3-3σ基因的低表达在乳腺癌的发病中起着重要作用[6]。
通过本文的研究,我们证明自主设计合成的新型白杨素类似物5,7-DMF以浓度依赖的方式抑制人乳腺癌MDA-MB-453细胞活性并诱导细胞凋亡。为了阐明5,7-DMF诱导凋亡的分子机制,我们分析了5,7-DMF处理24 h的MDA-MB-453细胞中14-3-3σ基因的甲基化、mRNA和蛋白表达水平,证明5,7-DMF通过通过表观遗传学机制即抑制14-3-3σ基因甲基化和上调14-3-3σ mRNA和蛋白表达,复活14-3-3σ基因功能,从而抑制MDA-MB-453细胞系生长和诱导细胞凋亡。总之,5,7-DMF能抑制人乳腺癌MDA-MB-453细胞生长并诱导细胞凋亡,这与其抑制14-3-3σ基因甲基化和上调14-3-3σ蛋白表达有关。
[1]Hadjeri M,Barbier M,Ronot X,et a1.Modulation of P-glycopretein mediated multidrog resistance by flavonoid derivatives and analogues[J].Med Chem,2003,46(11):2125-2131.
[2]Wenzel U,Kuntz S,Brendel MD,Daniel H.Dietary flavone is a potent apoptosis inducer in human colon car-cinoma cells[J].Cancer Res,2000,60(14):3823-3831.
[3]Wen X,Walle T.Methylated flavonoids have greatly improved intestinal absorption and metabolic stability[J].Drug Metab Dispos,2006,34(10):1786-192.
[4]Zheng X,Meng WD,Xu YY,et al.Synthesis and anticancer effect of chrysin derivatives [J].Bioorg Med Chem Lett,2003,13(5):881-884.
[5]Hermeking H,Lengauer C,Polyak K,et al.14-3-3 σ is a p53-regulated inhibitor of G2/M progression [J].Mol Cell,1997,1(1):3-11.
[6]Prasad G L,Valverius E M,McDuffie E,et al.Complementary DNA cloning of a novel epithelial cell marker protein,HME1,that may be down-regulater in neoplastic mammary cells[J].Cell Growth Differ,1992,3(8):507-513.
[7]Xie ZH,Quan MF,Liu F,Cao JG,Zhang JS.5-allyl-7-gen-difluoromethoxychrysin enhances TRAIL-induced apoptosis in human lung carcinoma A549 cells[J].BMC Cancer,2011,11:322.
[8]Ferguson AT,Evron E,Umbricht CB,Pandita TK,Chan TA,Hermeking H,Marks JR,Lambers AR,Futreal PA,Stampfer MR,Sukumar S.High frequency of hypermethylation at the 14-3-3 σ locus leads to gene silencing in breast cancer[J].Proc Natl Acad Sci U S A.2000,97(11):6049-6054.
[9]钟政荣,沈继龙,李兴武,等.乳腺癌 14-3-3σ基因异常甲基化的研究[J].中华检验医学杂志,2007,30(1):41-43.
[10]Horie-Inoue K,Inoue S.Epigenetic and proteolytic inactivation of 14-3-3sigma in breast and prostate cancers[J].Semin Cancer Biol,2006,16(3):235-239.
[11]Yang HY,Wen YY,Chen CH,et al.14-3-3 sigma positively regulates p53 and suppresses tumor growth [J].Mol Cell Biol,2003,23(20):7096-7107.

