DFOG对A549细胞生长及FoxM1表达的影响
魏桂蓉,姜新萍,徐 瑾,刘争鸣
(娄底市中心医院药剂科,湖南 娄底 417000)
肺癌是一种最常见的恶性肿瘤,已成为癌症死亡的首要原因,其发病率和死亡率近年来呈现上升趋势,肺癌的防治是2l世纪全世界面临的严峻人类健康问题[1]。已有研究表明,7-二氟甲氧基-5,4′-二-正辛烷氧基金雀异黄素 (7-difluoromethoxyl-5,4'-di-n-octylgenistein,DFOG)具有较先导化合物金雀异黄素(genistein,GEN)更强抗肿瘤活性[2-4]。本文观察DFOG抑制人肺癌A549细胞生长作用,并探讨其作用机制是否涉及调节转录因子FoxM1表达。
1 材料与方法
1.1 药品与试剂
DFOG按照文献[5]方法制备,分子量544,性状:黄色粉末,纯度98%。GEN(美国Sigma公司)、碘化丙啶 (PI,美国Sigma公司)、DMEM培养基 (Gibco公司)、小鼠抗人FoxM1和β-actin抗体以及辣根过氧化物酶标记山羊抗小鼠IgG抗体 (美国Santa Cruz公司)购自湖南科泰生物技术公司(中国长沙市)。
1.2 细胞培养
人肺癌A549细胞购于中国典型培养物保藏中心(中国武汉市),用含10%小牛血清的DMEM培养基,加100 U/mL青霉素,100 U/mL链霉素,置于37℃,5%CO2及饱和湿度培养箱中培养,取对数生长期细胞用于实验。
1.3 PI染色FCM分析
参照先前文献[6]的方法,取对数生长期A549细胞,以每孔2×106个细胞接种于6孔细胞培养板培养24 h,待细胞贴壁后,加入含1%FCS的培养基,培养24 h(细胞周期同步化处理),溶媒对照组,加入含0.1%DMSO的培养基;先导化合物对照组,加入含40.0 μmol/L GEN的培养基;实验组,加入含2.0、4.0、8.0 μmol/L DFOG 的培养基处理 24 h。 将悬浮和贴壁细胞一并收集于1.5mL EP管中,用4℃的75%乙醇固定24 h后,经碘化丙啶 (PI)染色,用EPICS-XL型流式细胞仪测定细胞DNA含量。
1.4 平皿集落形成法
参照文献[7]描述的方法,取对数生长期A549细胞,制备单细胞悬液,调节浓度为0.5×103个细胞/mL,接种于24孔细胞培养板,每孔1.0mL。溶媒对照组,加入含0.1%DMSO的培养基;先导化合物对照组,加入含40.0μmol/L GEN 的培养基;实验组,加入含 2.0、4.0、8.0 μmol/L DFOG的培养基。置CO2培养箱中培养8天。待集落形成,每孔加入甲醇0.5mL,固定15min,吉姆萨染色10min。以细胞数大于50个或直径大于75μm为一个克隆,倒置显微镜下计数每孔集落数并记录。按下式计算细胞集落抑制率。集落形成抑制率(%)=[1-(处理组集落均数/空白对照组集落均数)]×100%。
1.5 Western blot分析
用2.0 μmol/L的DFOG分别作用A549细胞6 h、12 h和24 h。按照先前文献[8]所述方法提取细胞总蛋白。蛋白质样品(25μg总蛋白/泳道)行100g/L或60g/L的十二烷基硫酸钠聚丙烯酰胺凝胶电泳,转移至PVDF膜上。分别与用FoxM1和β-actin一抗(1:1000稀释)孵育过夜。加入相应的二抗在室温下孵育1小时。目的蛋白用增强型化学发光试剂(美国Amersham Pharmacia Biotech公司)显示。βactin作为加样量对照。
1.6 统计学分析
各组实验数据表示为均数±标准差。用SPSS 15.0软件行单向方差分析和配对Student's t检验。P<0.05认为差异有统计学意义。
2 结果
2.1 DFOG对肺癌A549细胞周期分布的影响
FCM分析发现,与0.1%DMSO处理组比较,DFOG(2.0、4.0、8.0 μmol/L)处理 24 h,肺癌 A549 细胞系G2期细胞百分率随药物浓度增高逐次增加,同时,G1和S期细胞百分率逐次减少(图1)。说明,DFOG使肺癌A549细胞周期阻滞于G2/M期。
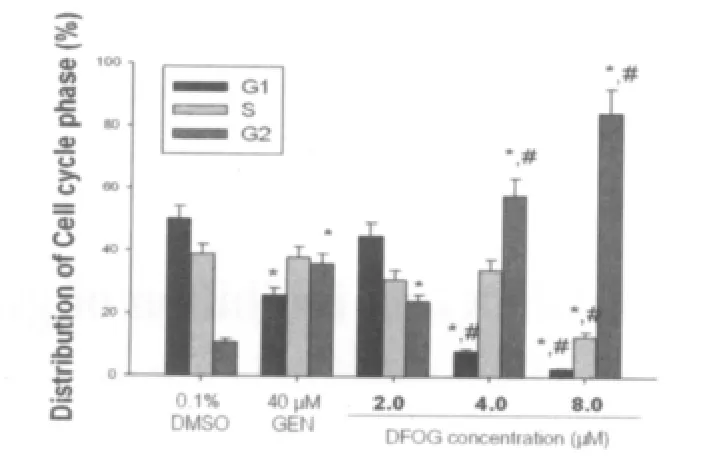
图1 DFOG以浓度依赖方式阻滞A549细胞周期于G2/M期((n=3)
2.2 DFOG对肺癌A549细胞生长的影响
平皿集落形成法的结果表明,与0.1%DMSO处理组比较,40.0 μmol/L GEN 和 DFOG(2.0、4.0、8.0 μmol/L)处理肺癌A549细胞后,每孔细胞集落数明显减少(P<0.05)。说明GEN和DFOG对人肺癌A549细胞锚定依赖性生长能力具有显著抑制作用,呈浓度依赖性(图2)。

图2 DFOG以浓度依赖方式降低A549细胞集落数目(n=3,mean±SD)
2.3 DFOG对肺癌A549细胞FoxM1表达的影响
Western blot分析表明:与孵育0 h比较,2.0 μmol/L的 DFOG 处理 6 h、12 h或24 h,A549细胞的FoxM1表达水平下降,呈时间依赖性(图3)。
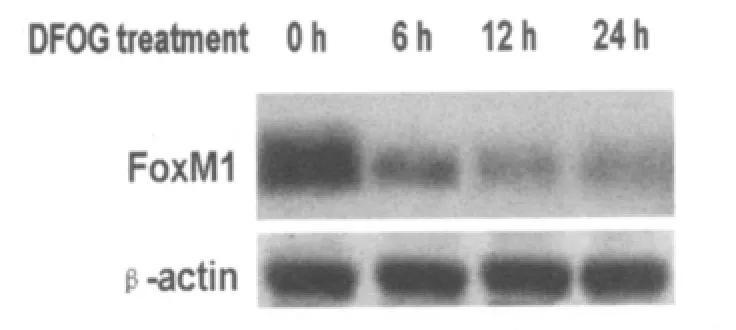
图3 DFOG以时间依赖方式降低A549细胞FoxM1表达
3 讨论
本文首先与先到化合物GEN对照研究DFOG抑制肺癌A549细胞生长作用以及对细胞周期的影响。实验结果证实,DFOG明显抑制肺癌A549细胞锚定依赖性生长,其主要证据是其以剂量依赖性方式减少肺癌A549细胞集落数目。与此相应的是DFOG与先导化合物GEN一样能够导致肺癌A549细胞周期G2/M期阻滞。据此,我们推测:尽管DFOG抑制肺癌A549细胞活性和生长作用的效价强度高于先导化合物GEN,但是,由于其化学结构的母核与GEN类似,因此,有可能存在相类似的作用分子机制,例如,本文的实验结果证实,其对肺癌细胞周期分布的影响方式就与GEN类似。
FoxM1是Fox转录因子家族成员之一[9]。FoxM1已被证明能调控细胞周期G1向S期和G2向M期运转关键基因的转录,包括Cdc25A,Cdc25B,cyclin B,cyclin D1,p21蛋白和p27蛋白[10,11]。还有报道表明,FoxM1信号网络在人类恶性肿瘤中常常被解除管制,在肺癌中存在FoxM1高表达[12]。Wang等的研究提示FoxM1可能是GEN抗胰腺癌的新靶标[13,14]。我们的实验研究结果表明,DFOG亦能以时间依赖的方式抑制FoxM1表达。这些结果说明,GEN的新型类似物DFOG可能通过下调FoxM1表达发挥抑制人肺癌A549细胞生长和诱导细胞周期G2/M期阻滞作用。该新途径的发现可能为找到一种新的具有选择性的治疗肺癌的方法带来新曙光。
[1]Jemal A,Siegel R,Ward E,et al.Cancer Statistics[J].Cancer J Clinicians,2006,56:106-130.
[2]鲁凯莉,姜浩,曹建国.5,4'-二-正辛烷氧基-7-二氟亚甲基异黄酮对人乳腺癌细胞增殖和凋亡的影响[J].现代肿瘤医学,2007,15(4):482-484.
[3]郑芳,向其德,姜浩,等.5,4'-二-正辛烷氧基-7-二氟亚甲基异黄酮抑制人乳腺癌细胞生长和诱导凋亡的作用[J].吉首大学学报(自然科学版),2008,29(2):106-111.
[4]宁映霞,曹建国,谢宛玉.5,4'2二2正辛烷氧基272二氟亚甲基异黄酮体外抗人卵巢癌作用研究.湖南师范大学学报(医学版),2006,4(1),12-16
[5]Fu XH,Wang L,Zhao H,et al.Synthesis of genistein derivatives and determination of their protective effects against vascular endothelial cell damages caused by hydrogen peroxide[J].Bioorg Med Chem Lett.,2008,18(2):513-517.
[6]Cao JG,Peng SP,Sun L,et al.Vascular basement membrane-derived multifunctional peptide,a novel inhibitor of angiogenesis and tumor growth[J].Acta Biochim Biophys Sin(Shanghai),2006,38(7):514-521.
[7]Rodrigues CO,Shehadeh LA,Hoosien M,et al.Heterogeneity in SDF-1 Expression Defines the Vasculogenic Potential of Adult Cardiac Progenitor Cells[J].PLoS One.,2011,6(8):e24013.
[8]Xie ZH,Quan MF,Liu F,et al.5-allyl-7-gen-difluoromethoxychrysin enhances TRAIL-induced apoptosis in human lung carcinoma A549 cells[J].BMC Cancer.,2011,11:322.
[9]Liu M,Dai B,Kang SH,et al.FoxM1B is overexpressed in human glioblastomas and critically regulates the tumorigenicity of glioma cells[J].Cancer Res,2006,66:3593-3602.
[10]Wang X,Krupczak-Hollis K,Tan Y,et al.Increased hepatic Forkhead Box M1B (FoxM1B)levels in old-aged mice stimulated liver regeneration through diminished p27Kip1 protein levels and increased Cdc25B expression[J].J Biol Chem,2002,277:44310-44316.
[11]Wonsey DR,Follettie MT.Loss of the forkhead transcription factor Fox M1 causes centrosome amplification and mitotic catastrophe[J].Cancer Res,2005,65:5181-5189.
[12]Kim IM,Ackerson T,Ramakrishna S,et al.The Forkhead Box m1 transcription factor stimulates the proliferation of tumor cells during development of lung cancer[J].Cancer Res,2006,66:2153-2161.
[13]Wang Z,Banerjee S,Kong D,et al.Down-regulation of Forkhead Box M1 transcription factor leads to the inhibition of invasion and angiogenesis of pancreatic cancer cells[J].Cancer Res.,2007,67(17):8293-9300.
[14]Wang Z,Ahmad A,Li Y,et al.Forkhead box M1 transcription factor:a novel target for cancer therapy[J].Cancer Treat Rev.,2010,36(2):151-156.

