响应面法优化酶法制备酪蛋白糖巨肽的工艺条件
王艳萍,赵运星,张伊然,尚 柯
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457)
响应面法优化酶法制备酪蛋白糖巨肽的工艺条件
王艳萍,赵运星,张伊然,尚 柯
(食品营养与安全教育部重点实验室,天津科技大学食品工程与生物技术学院,天津 300457)
采用M initab方法设计实验,对影响酪蛋白糖巨肽制备的酶解因素进行优化,发现酶解时间、酶解温度、酶解pH、酶与底物比是影响酶解酪蛋白的主要因素.由于唾液酸是酪蛋白糖巨肽的特征性组分,本文以唾液酸的含量表征酶解上清液中酪蛋白糖巨肽的含量.根据M initab分析的结果,采用Design Expert 软件中水平设计和响应面分析法对影响酪蛋白糖巨肽产量的主要因素进行优化,建立唾液酸含量A580对酶解主要条件的二次回归模型,其回归方程的决定系数达到了0.962,9.得到的最佳酶解条件为:酶解时间80,m in,酶解温度42.5,℃,酶解pH 6.28,酶与底物比270,U/g.唾液酸含量A580最高为0.653,此时酪蛋白糖巨肽的得率为17.91 mg/g.
酪蛋白糖巨肽;酶解;条件优化;响应面分析
Abstract:The effect of enzyme hydrolysis conditions on casein glycomacropeptide was selected w ith M initab software. It was showed that the principal factors were hydrolysis time,temperature,pH,and [E]/[S]. The main effect of enzyme hydrolysis conditions was optim ized by Design Expert system. The regression equation was established by expressing relationship between sialic acid and main factors of enzyme hydrolysis conditions. The R-squared in the model of regression equation was 0.962,9,which meant the established equation could predict the A580of sialic acid(under the absorbance at 580 nm by Resorcinol-HCl test)well w ithin the range of conditions. The optimum enzyme hydrolysis conditions were:time 80 m in,temperature 42.5,℃,pH 6.28,[E]/[S] 270,U/g. The A580of sialic acid was 0.653,while the yield of CGMP was 17.91 mg/g casein under the optimal conditions.
Keywords:casein glycomacropeptide;enzyme hydrolysis;optim ize condition;response surface analysis
酪蛋白糖巨肽(casein glycomacropeptide,CGMP)是Delfour 等[1]于1965 年发现的一种含有唾液酸的糖肽,是乳中 κ–酪蛋白(κ-CN)上的一个多肽片段.由于κ–酪蛋白是酪蛋白中唯一含有糖成分的蛋白质,而唾液酸(N–乙酰神经氨酸)主要集中在CGMP上[2],所以可以用测定唾液酸的含量来鉴定样品中是否含有CGMP,同时根据唾液酸含量的多少来表征CGMP的含量.CGMP的化学组成独特,不含有苯环氨基酸且带有含唾液酸的低聚糖糖链,因而具有许多重要的生理活性功能,如结核霍乱毒素和大肠杆菌毒素、抑制细菌和病毒的黏附作用、抑制胃液分泌、促进双歧杆菌增殖、调节免疫系统等,所以CGMP是极具研究价值的[3–4].
目前报道的酪蛋白糖巨肽的制备方法主要有直接提取法、酶解法、基因工程法.酶解法是目前制备活性肽常用的方法[5–7].对于酶解制备酪蛋白糖巨肽的研究中,主要运用单因素实验结合正交实验来确定酶解条件[8],存在着劳动量大、费时费力等问题.本文利用M initab和Design Expert两种软件设计优化酶解制备酪蛋白糖巨肽的条件,对影响酶解制备酪蛋白糖巨肽的主要因素进行考察,同时对这些主要因素进行优化,为工业制备CGM P的研究提供基础理论数据.
1 材料与方法
1.1 原料与仪器
酸凝干酪素,兰州陇朊干酪素有限责任公司;复合酶,天津市诺奥科技发展有限公司.
DELTA–320型酸度计,Mettler Toledo公司;UV–9100 型紫外分光光度计,北京瑞利分析仪器公司;高速冷冻离心机,Backman公司.
1.2 方法
1.2.1 CGMP粗品的制备
配制3%的酪蛋白溶液于250,m L小烧杯中,用6,mol/L的盐酸调节pH,在不同温度下水浴保温30,min,加入复合酶,立即计时.保持反应过程中反应液的pH为初始pH,反应完的酶解液在75,℃下水浴30,m in 终止酶反应.冷却后,使用6,mol/L的NaOH溶液调整酶解液的pH为4.6,4,000,r/m in离心30,m in,收集上清液,备用.
1.2.2 CGMP的鉴定
本实验用间苯二酚–盐酸法[9]测定唾液酸的含量.
1.2.3 部分因子实验设计
根据复合酶的性质,本实验选取酶解温度、酶解时间、酶与底物比、酶解pH、CaCl2质量浓度作为部分因子实验设计的因素,以间苯二酚–盐酸法测定唾液酸在580,nm下的吸光度A580为响应指标,采用5因素2水平4中心点的1/2部分因子实验设计,筛选影响酶解条件的主要因素.
1.2.4 CCD中心组合响应面设计
按照部分因子设计筛选出的影响复合酶酶解制备酪蛋白糖巨肽的主要因素,并以此作为响应面设计的因素,以间苯二酚–盐酸法测定唾液酸在580,nm下的吸光度A580为响应指标,采用Design Expert[10–11]软件中的CCD(central composite design)实验设计.根据模型方差分析和可行度分析,确定模型的可行性和适用性后,得出复合酶酶解干酪素制备酪蛋白糖巨肽的最佳条件,并进行验证实验.
2 结果与讨论
2.1 显著影响因子的筛选
部分因子分析法筛选影响复合酶酶解制备酪蛋白糖巨肽的主要因素,即:酶解温度(A)、酶解时间(B)、酶与底物比(C)、酶解pH(D)、CaCl2质量浓度(E),实验设计及结果见表1.实验各因素的影响效果见表2.
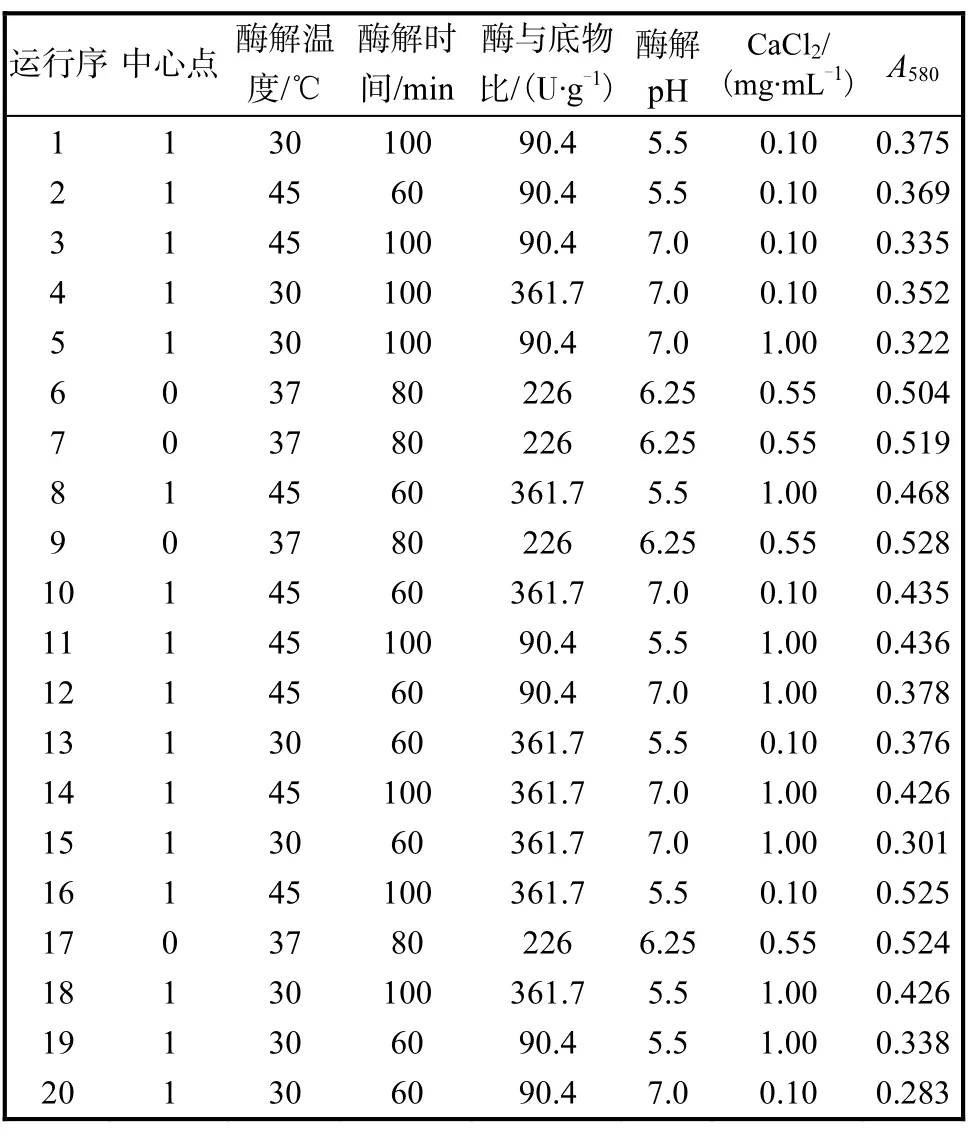
表1 n=20的部分因子实验设计及结果Tab.1 Experimental design and results for FFD as n=20
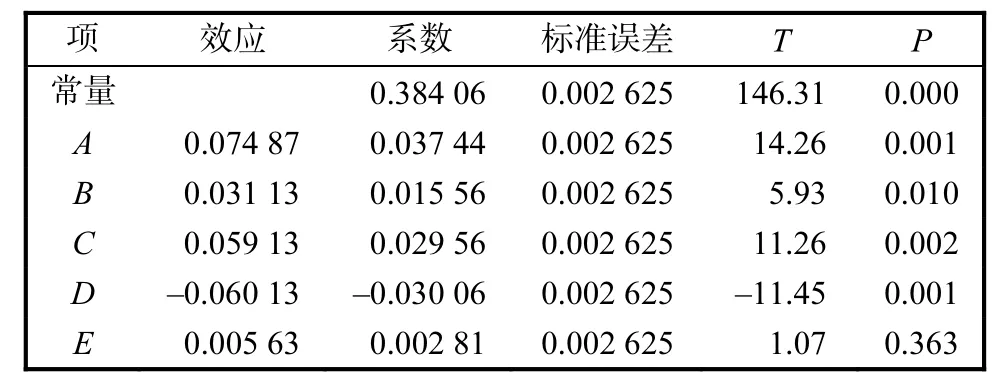
表2 实验各因素的影响效果(α=0.05)Tab.2 Effect of factors on response of experim ent(α=0.05)
表2中可以看出,酶解温度、酶解时间、酶与底物比、酶解pH的P值都小于0.05,对复合酶酶解制备酪蛋白糖巨肽具有显著影响.M initab软件同时给出柏拉图分析.设定 α=0.05,即筛选显著效应可信度在90%以上,相应的效应值在2.160以上的变量,柏拉图中表现为超过2.160的因素对酶解制备酪蛋白糖巨肽的影响显著,表示可信度在90%以上.得到同表2相同的结论,筛选得到显著因素为酶解温度、酶解时间、酶与底物比、酶解pH,而其余因素因其效应值均小于2.160,对复合酶酶解制备酪蛋白糖巨肽的影响较小,无需进一步优化其添加量.
进一步对该实验设计进行方差分析,结果见表3.

表3 回归方程方差分析表Tab.3 Variance analysis of regression equation
由表3方差分析可知P=0.002<0.01,可见回归拟合良好,分析结果可信.酶解温度、酶解时间、酶与底物比、酶解pH对复合酶酶解干酪素制备酪蛋白糖巨肽有显著影响,其水平需要进一步优化.
2.2 响应曲面实验设计
固定CaCl2浓度不变,对酶解温度、酶解时间、酶解pH、酶与底物比进行4因素中心组合响应面分析实验.利用Design Expert软件对实验数据进行二次多元回归拟合,得到A580对编码自变量A、B、C、D的二次多项回归方程A580=0.56+0.044A+0.065B-0.02C+0.030D+0.036AB-0.046AC+0.081AD+0.001BC+0.042BD-0.022CD-0.090A2+0.011B2-0.069C2-0.008D2.同时得到方差分析表(表4).

表4 CCD回归模型方差分析Tab.4 Variance analysis of CCD
由表4可知,对于模型P=0.003,6<0.01,表明该模型高度显著,不同处理间差异显著;对于失拟项P=0.396,2>0.05,差异不显著,说明该模型的拟合度良好,可以根据该回归方程来绘制响应面立体分析图,考察所拟合的相应曲面的形状.
响应面立体图如图1—图6所示,利用该组图可以对影响复合酶酶解干酪素制备酪蛋白糖巨肽的任何两种因素的交互效应进行分析和评价,并确定最佳因素水平范围.

图1 酶解pH与底物比的交互作用Fig.1 Interaction between pH and [E]/[S]

图2 酶解时间与底物比的交互作用Fig.2 Interaction between times and [E]/[S]
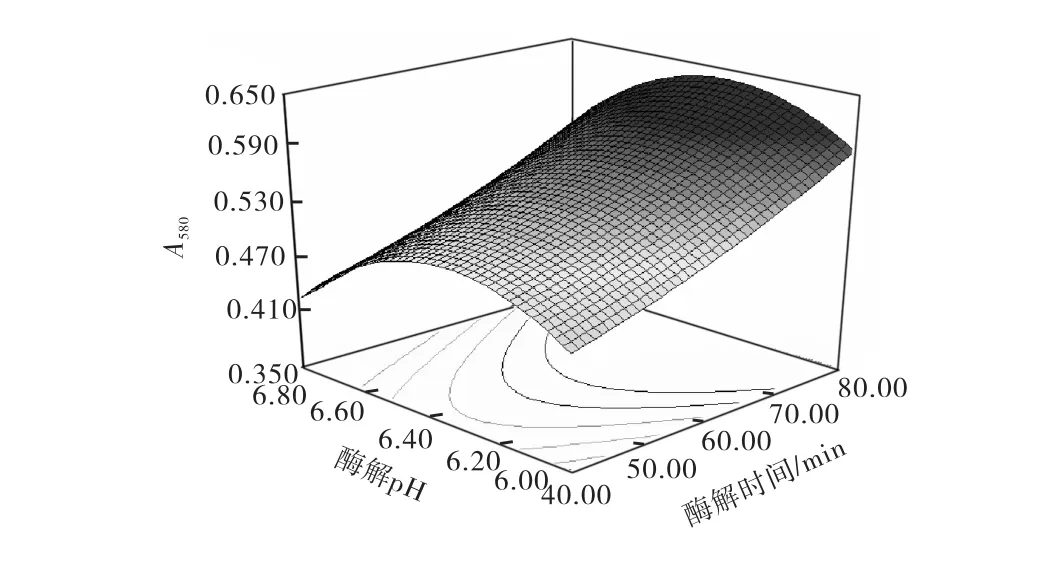
图3 酶解时间和酶解pH的交互作用Fig.3 Interaction between times and pH

图4 酶解温度与底物比的交互作用Fig.4 Interaction between temperature and [E]/[S]
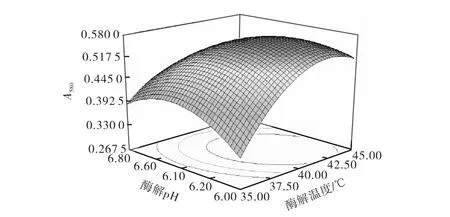
图5 酶解温度与酶解pH的交互作用Fig.5 Interaction between tem perature and pH
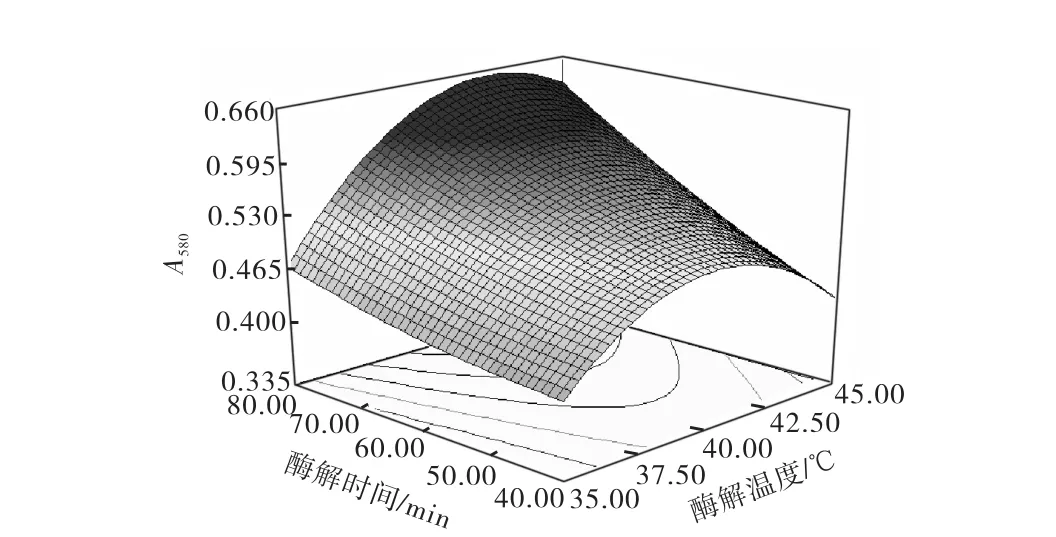
图6 酶解温度与酶解时间的交互作用Fig.6 Interaction between tem perature and times
由响应面图可知:在本实验水平范围内,A580随着酶解条件中酶解pH、酶解温度、酶与底物比和酶解温度的增大而增大,但当其超出一定范围时,反而使A580降低或不再增加,所以每种条件都有一个最优的范围,其最佳酶解条件为:酶解温度42.5,℃,酶解时间80,m in,酶解pH 6.28,酶与底物比270,U/g.在此条件下A580为0.653.为了检验模型预测的准确性,在最佳酶解条件下进行3次酶解实验,其A580分别为0.640、0.656、0.661,可见该模型能较好地预测实际酶解情况.
3 结 语
利用M initab软件进行实验设计,能够在较少的实验次数条件下快速找出主因素,利用CCD响应面设计能够快速对主因素进行优化,得到最大响应值.本实验得到制备CGMP的最佳酶解条件为:酶解温度42.5,℃,酶解时间80,m in,酶解pH,6.28,酶与底物比270,U/g.在此条件下测得的A580为0.653,此时上清液中CGMP得率为17.91,mg/g.
[1] Delfour A,Jolles J,A lais C,et al. Caseino-glycopeptides:Characterization of a methionin residue and of the N-term inal sequence[J]. Biochem ical and Biophysical Research Communications,1965,19(4):452–455.
[2] EI-Salam M H A,EI-Shibiny S,Buchheim W. Characteristics and potential uses of the casein macropeptide[J].International Dairy Journal,1996,6(4):327–341.
[3] 高志芳,钱方,陈莉,等. 酪蛋白糖巨肽的生理功能及发展前景[J]. 食品研究与开发,2007,28(3):183–185.
[4] 李海平,程涛,霍贵成. 乳源糖巨肽的生物活性[J]. 中国乳品工业,2002,30(5):74–77.
[5] Tolkach A,Kulozik U. Fractionation of whey proteins and caseinomacropeptide by means of enzymatic crosslinking and membrane separation techniques[J]. Journal of Food Engineering,2005,67(1/2):13–20.
[6] 唐传核,彭志英,曹劲松. 乳来源的酪蛋白糖巨肽(CGMP)的开发概况[J]. 食品与发酵工业,2001,27(8):71–74.
[7] 丛涛,赵霖. 酪蛋白源生物活性肽:酪蛋白巨肽研究进展[J]. 食品科技,2008(2):168–171.
[8] 张秀媛,袁永俊. 凝乳酶水解酪蛋白生产酪蛋白糖巨肽工艺条件的研究[J]. 食品工业科技,2008(4):171–173.
[9] 张惟杰. 糖复合物生化研究技术[M]. 杭州:浙江大学出版社,1999:455–456.
[10]Souza M C de O,Roberto I C,M ilagres A M F. Solidstate fermentation for xylanase production by Thermoascus aurantiacus using response surface methodology[J].Appl M icrobiol Biotechnol,1999,52(6):768–772.
[11]Ismail A,Soultani S,Ghoul M. Optimizatin of the enzymatic synthesis of butyl glucoside using response surface methodology[J]. Biotehnol Prog,1998,14(6):874–878.
Optim ize Conditions for Casein Glycomacropeptide Production by Enzyme Hydrolysis Using Response Surface M ethodology
WANG Yan-ping,ZHAO Yun-xing,ZHANG Yi-ran,SHANG Ke
(Key Laboratory of Food Nutrition and Safety,M inistry of Education,College of Food Engineering and Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)
TS201.2
A
1672-6510(2011)02-0001-04
2010–10–29;
2011–01–13
天津市应用基础及前沿技术研究计划项目(08JCYBJC01900)
王艳萍(1962—),女,天津人,教授,博士,ypwang@tust. edu.cn.

