外周血淋巴细胞培养及制备染色体G显带的技术研究
韩 晶,李 洋
(1.安阳市人民医院 检验科,河南安阳455000;2.吉林大学第一医院)
人们用物理、化学因素处理后,再用染料对染色体进行分化染色,使每条染色体上出现明暗相间,或深浅不同带纹的技术称为显带技术(banding technique)。染色带的数目、部位、宽窄和着色深浅均具有相对稳定性,所以每一条染色体都有固定的分带模式,即称带型。染色体带型是鉴别染色体的重要依据。染色体分带技术可分为两大类,一类是产生的染色带分布在整条染色体的长度上如:G、Q和R带;另一类是局部性的显带,它只能使少数特定的区域显带,如C、T和N带[1]。G带即吉姆萨带,是将处于分裂中期的细胞经胰酶或碱、热、尿素等处理后,再经吉姆萨染料染色后所呈现的区带,是目前被广泛应用的一种带型。其特性是显带方法简单恒定,带型稳定,保存时间长[2]。资料表明,外周血淋巴细胞培养及染色体G显带标本制备技术是细胞遗传学研究的基础。近几年来,有关细胞遗传技术方法方面外周血淋巴细胞培养的报道较少,本文在此基础上自2006年1月-2009年9月进行680例细胞培养,600份G显带制备技术处理总结实验方法,现将结果报道如下。
1 资料与方法
1.1 实验对象
我院自2006年1月-2009年9月门诊咨询者680例,其中包括妇产科、新生儿等住院患者,外周血淋巴细胞培养后制备的染色体标本。
1.2 实验试剂与器材
1.2.1 实验器材 分析天平,隔水式电热恒温培养箱,恒温水浴锅,离心管,离心机(北京时代北利),载玻片,显微镜(OLYMPUS-CX21),标本板,玻璃铅笔,定时钟,染色缸,直柄虹膜镊,滴管。
1.2.2 实验试剂 肝素抗凝剂(反复高压后4℃冰箱中保存),RPMI1640、植物细胞凝集素(Phaseolus vulgaris,PHA),pH6.8 PBS,Giemsa,0.025%胰蛋白酶(取0.9%氯化钠100 ml,加0.25%胰蛋白酶1 ml),0.75%的低渗液,0.50%秋水仙素(-10℃反复冻融保存),胰酶粉(显带前现配现用)
1.3 实验方法
1.3.1 染色体标本培养 取患者外周血2毫升,5毫升注射器针头28-32滴于RPMI1640培养基中,放置于37℃培养箱中培养72 h;培养终止后,离心后将细胞提取出,所获得的外周血淋巴细胞依次用0.75%mol/LKCL溶液低渗以及固定液固定,制成细胞悬液;后取洁净冷湿的载玻片,吸取适量细胞悬液,滴于载玻片上(每片3-4滴),经酒精灯外延加热烘烤至干燥[3]。
1.3.2 G显带标本制备[4]将制好的染色体标本,置85℃烤箱中烤片2 h;放入预温至37℃的0.025%胰酶溶液中(pH=7.2-7.4)消化1.5 min左右,每次的作用时间并不完全相同,可先试一张片子,再根据显带效果调整胰酶作用时间;在Giemsa染液中染色15 min,自来水冲洗干净,晾干后,即可阅片;镜检:在显微镜高倍目镜下检查显带标本,在染色体上若出现清晰的深浅相间的带型,即为可取标本。
2 结果
2.1 细胞培养成功率
680例以各个染色体分布舒展,相对集中少重叠为准,于40倍光镜下观察到1号、7号、11号、14号及X六条带纹特征性较强的染色体,培养成功率为96.62%(658/680)。取其中培养合格的600分进行下一步的显带处理。
2.2 G显带制备合格率 G显带处理共计600张片。以100倍光镜下观察2号、4号、6号、13号、17号、20号以及22号共计7对染色体特征性带纹区域清晰可辨认为准,其显带合格率为91.67%(550/600),合格标准见表1。
50例失误操作采取补救措施,效果分析,失误率为8.00%(4/50),其成功率为92.00%(46/50),结果见表2。
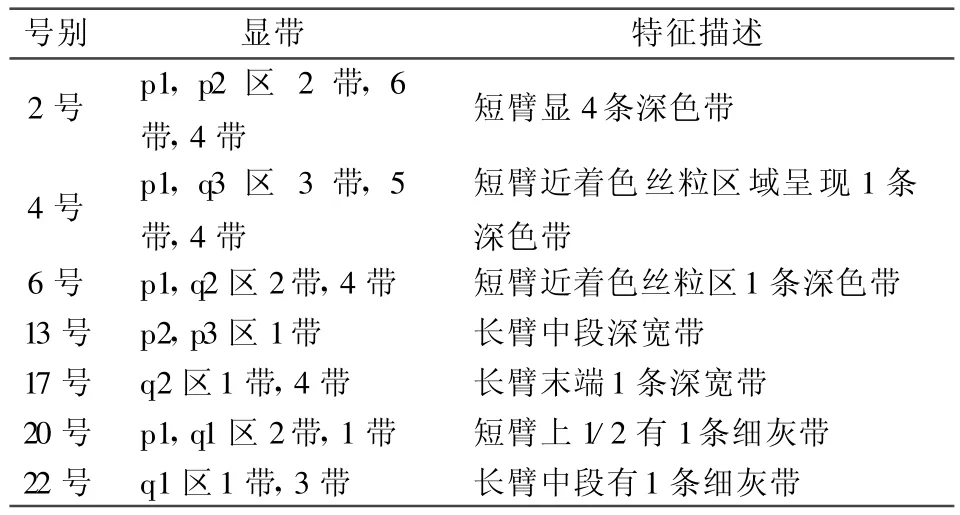
表1 染色体G显带制备技术镜下鉴定合格标准
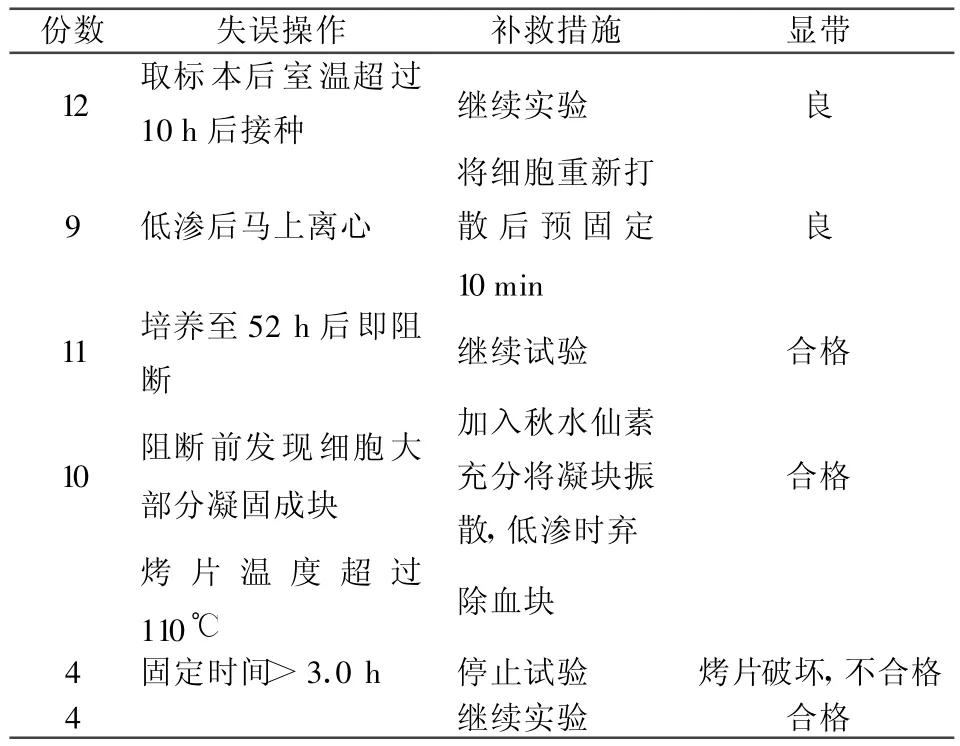
表2 50例失误操作补救措施效果观察
3 讨论
近几年来,随着人们对保健意识的不断增强,染色体检查已经逐渐在临床检查中普及,而且常用的外周血淋巴细胞培养是一个复杂并且繁琐的过程,在实际的临床工作过程中需要一周左右的时间才能正常的完成,同时,实验过程中若有一个过程出现纰漏,就极有可能导致实验的失败[5]。接种血样时要保持标本的新鲜,最好是在采用24 h内对外周血淋巴细胞进行培养,如果不能进行培养,可以放置于4℃的冰箱中保存,但保存时间不易过长,防止细胞活力的降低。对培养过程中出现血样凝集的现象,可以将培养瓶轻轻震荡,使凝块散开,后放入37℃恒温箱中培养。导致培养失败的主要因素是抗生素、消炎药以及高胆红素等的干扰,抑制淋巴细胞从而影响细胞培养的质量,对标本的采集应避开用药近期或新生儿高胆红素血症期。
1978年有报道标本总量(试剂+细胞)的总体积为4.0ml[6],本文研究发现当采用4.0ml低渗液,固定剂时,对染色体去膜化解旋、舒展、膨胀等并无影响。离心过程中应控制转速为2000 r/min,防止染色体的丢失[7]。体积堆积的细胞沉淀物可以避免操作过程中因碰颤而导致的沉淀物的悬浮。另一方面,烤片也是不容忽视的操作环节。烤片不仅是老化过程,同时可以蒸发残留于标本片上的固定剂,同时将用于浸泡载玻片的乙醇酸类等物质彻底蒸发,从而利于消化液pH环境[8]。按照以上条件,本研究结果外周血淋巴细胞培养合格率为96.62%(658/680)。资料报道,G显带技术有7种[9],其中主要以胰酶消化为主。胰蛋白酶浓度和处理时间随气温高低有所不同。一般规律是标本存放时间越长,在胰蛋白酶当中处理时间越长。太新鲜的标本,染色体会出现毛茸现象。片龄很长的标本往往会导致斑点状的染色体[10]。本实验通过研究,制备过程中临时配制胰酶溶液,用玻璃毛细血管蘸取少许胰酶粉溶解于0.90%的盐水中,配制成0.30%的胰酶溶液,消化时间6.5 h。G显带技术制备的合格率为91.67%(550/600)。
其中,染色对显带同样也是至关重要,Gimesa是噻嗪类染料,其组成成分天青B与蛋白质中的DNA分子中的磷酸基结合,蛋白质在一定的环境中,同时具有嗜酸性及嗜碱性的倾向,通过调节染色液的pH值7.0-7.5,复染7 min,可以获得较为鲜亮的显色效果。综上所述,通过对外周血淋巴细胞的培养及G显带各个制备环节的分析,提高了染色体制备技术的稳定性及成功率。
[1]吴 海,高文英,李培宁,等.人类染色体G显带质量与自身因素的相关分析[J].天津医药,2005,12(5):280.
[2]Neitrel HA.Routine method for the establishment of pernanent growing lymphoblastoid cell lines[J].Hum Genet,2000,739(4):320.
[3]金 鹰,唐 玟,李国明,等.实用淋巴细胞培养技术[J].激光生物学报,2006,9(1):75.
[4]Wuzi Zhao,Liqing Cheng,LingminMU,etal.Modified method of chromosome G-banding in human peripheral blood[J].Jourmal of Chinical Rehatilitative Tissue Engineering Research,2007,11(11):2185.
[5]曹海涛.染色体外周血淋巴细胞培养中的几点体会[J].现代中西医结合杂志,2007,16(30):4485.
[6]朱忠勇,陈之航.临床医学检验[M].上海科技出版社,1978:67.
[7]张国庆,焦顺昌,林星石.人外周血淋巴细胞体外扩增培养前后19种细胞表型研究[J].军医进修学院学报,2008,29(5):352.
[8]李 洁,徐文瑜,杨娇英.外周血淋巴细胞培养及染色体G带标本制备的实验对策[J].中国优生与遗传杂志,2006,14(1):51.
[9]李 敏,王立斌,王玉炯,等.利用染色体G显带技术鉴定人永生细胞实验条件初探[J].生物技术,2007,16(2):48.
[10]Hara M,Matsuzaki Y,Shimizu T,etal.Preoperative peripheral mative memory ratio and prognosis of nonsmall-cell lung cancer patients[J].Ann Thorac Cardiovase Surg,2007,13(6):384.

