骨髓间充质干细胞抑制Wistar大鼠脊髓损伤区神经元凋亡的实验研究
李东君,贾全章*,陈玉丙,孙景海,吴传真,王风华,徐 爽,刘丽萍,姜大伟,高德萱
(1.解放军第208医院,吉林 长春130062;2.吉林大学附属第二医院,吉林 长春130041)
骨髓间充质干细胞(Bone Mesenchymal Stem cells,BMSCs)具有强大的增殖能力和多向分化潜能,在特定的诱导环境条件下可以向骨、心肌、神经元等多胚层方向分化[1-4]。细胞凋亡是脊髓继发性损伤的重要形式之一,受多种凋亡相关蛋白的调控[5]。有研究报道BMSCs移植能改善脊髓损伤大鼠的运动功能[6,7]。本实验探讨BMSCs移植对脊髓损伤大鼠凋亡调控蛋白Caspase-3、Bax、Bcl-2表达。
1 材料
1.1 实验动物与分组 清洁级Wistar大鼠120只,雌性,体重(260±20)g,随机分为4组各30只:对照1、2组,治疗1组、2组。出生5天的Wistar乳鼠(8.0-10.0 g)5只。均购自吉林大学实验动物中心。
1.2 主要仪器与试剂 MC01751IF型CO2培养箱(日本SANYO);FACScan流式细胞仪(美国BD公司);DMEM 培养基(美国Gibco公司);胎牛血清(美国Hyclone公司);兔抗鼠CD34荧光直标抗体(美国BD公司),激光共聚焦显微镜(日本OLYMPUS公司),浓缩型DAB试剂盒(北京中山)。
1.3 实验方法
1.3.1 BMSCs的提取、分离、培养 Wistar乳鼠5只,颈椎脱臼法处死,无菌下取股骨和胫骨的骨髓细胞,采用贴壁筛选法结合差速贴壁法分离、纯化BMSCs,贴壁培养法进行培养,原代培养后按1∶3比例传代共3代。
1.3.2 BMSCs的鉴定 每次传代后行形态学观察,并测定表面标志物的表达以鉴定细胞。
(1)BMSCs的形态学观察 使用倒置相差显微镜逐日观察原代及传代培养的细胞,记录细胞生长、增殖情况及形态特征。
(2)细胞表面分子表型检测进行FACS检测分析。细胞表面标志MHC-Ⅰ、Ⅱ常规切片(片厚5 μ m),光镜下观察。
1.3.3 脊髓损伤模型的建立 实验组采用改良的Allen's打击法建立脊髓损伤模型,术后常规方法笼内饲养护理。
1.3.4 BMSCs的移植方法
(1)治疗1组采用静脉回输治疗 于建模当天行BMSCs移植,用0.3%戊巴比妥钠(30mg/kg)腹腔麻醉,1 ml注射器作尾静脉穿刺,缓推注浓度为1×106个/ml的MSCs 1 ml,连续注射两天。
(2)治疗2组采用局部移植治疗 于建模后缝合前用微量注射器约45度斜角将BMSCs细胞悬液沿后中央沟缓慢注人到脊髓损伤区头侧和尾侧损伤临近区域的灰白质交界处(距脊髓表面约1mm)共2点,每点5μ l,浓度为4×107/ml,留针5分钟,医用生物蛋白胶封闭注射孔。
1.3.5 免疫组化染色法检测各组Caspase-3、Bax、Bcl-2的表达 按试剂盒说明书操作。
每组制作每种切片各6张,每张切片于40×10倍镜下随机取5个视野,mIgae-or-Plus生物医学图像分析系统进行图像分析,在40×10倍镜下对凋亡相关蛋白caspase-3、Bax和Bcl-2的免疫组化结果进行半定量的分析,计算平均灰度值。结果用均值±标准差(±s)表示,采用SPSS13.0软件包处理数据,用t检验进行统计学处理。
2 结果
2.1 BMSCs体外培养的形态学特征 转种至塑料培养瓶内的原代细胞经换液后,即可见呈单个分散或几个细胞克隆的贴壁细胞,细胞形态较均匀,呈多边形,立体感较强(图1.A)。7天后,悬浮细胞、圆形血细胞明显减少,少量梭形或纺锤样细胞开始出现(图1.B)。根据生长情况每4-7天进行一次传代,传代培养3代时,细胞形态变得较为一致,绝大部分为细长梭形细胞,也有扁平形带突起的细胞,似成纤维样细胞,细胞可散在生长,有明显的梭形细胞集落呈克隆样生长(图1.C)。观察表明,体外分离的BMSCs得到了进一步的纯化及扩增。
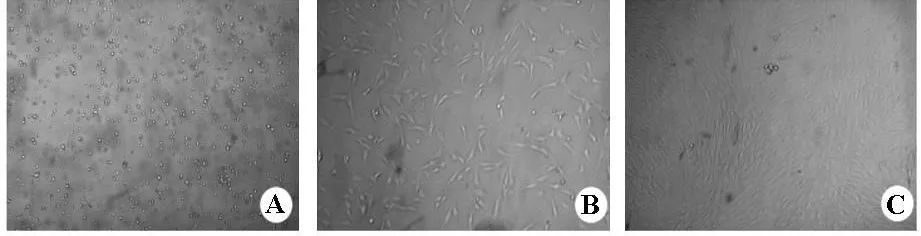
图1 Wistar大鼠BMSCs培养的形态学特征(×100)
2.2 BMSCs表面标志物的表达 流式细胞仪检测结果见图2,三代BMSCs基本不表达CD34、CD45,表达CD44。光镜下见三代BMSCs基本不表达MHC-Ⅱ ,表达MHC-Ⅰ(图3)。

图2 流式细胞仪测定BMSCs表面标志物的表达
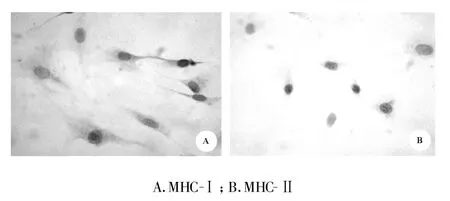
图3 光镜下BMSCs表面标志物的表达(×200)
2.3 BMSCs对模型大鼠脊髓损伤区 Bcl-2、Bax、Caspase-3表达的影响 结果见表1、图4。
3 讨论
神经细胞的凋亡在脊髓损伤中占重要地位,脊髓损伤后不但存在急性期的细胞坏死,也存在亚急性的细胞凋亡。Emery等[8]首先证实了在人类创伤性脊髓损伤后存在细胞凋亡。此后,对啮齿类动物脊髓损伤模型的研究也证实了细胞凋亡在脊髓损伤中的作用[9]。Li等[10]的研究发现SCI后长纤维束轴突表达Bcl-2,但凋亡的少突胶质细胞未见Bcl-2的上调。在凋亡信号传导过程中,通常认为Bcl-2作用于Caspase-3的上游,通过抑制Caspase-3激活而发挥作用。
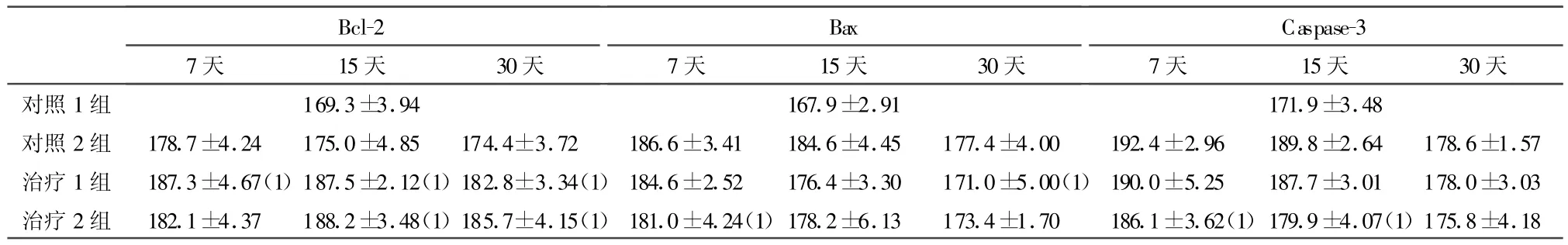
表1 各组术后损伤区Bcl-2、Bax、Caspase-3表达
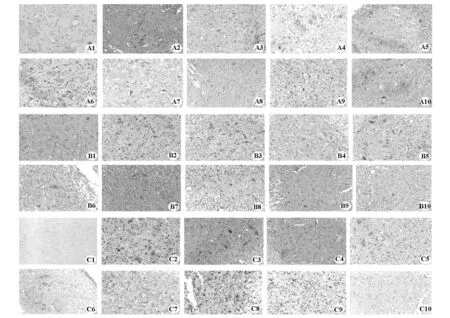
图4 各组不同时间点凋亡调控蛋白(Bcl-2、Bax、Caspase-3)的表达(DAB,×100)
Caspases家族对细胞,特别是神经元凋亡程序的启动具有核心作用。它直接水解激活与DNA断裂等凋亡特征性改变密切相关的蛋白,又称为死亡蛋白酶。迄今已发现14个家族成员,其中Caspases-3是凋亡过程中最重要的蛋白酶,是多种凋亡途径的共同下游效应部分,是细胞凋亡蛋白酶级联反应的必经之路[11]。Bcl-2家族已有成员达15种之多,包括凋亡抑制基因(Bcl-2,bcl-XI等)和促进凋亡基因(Bax,Bac等),它们共同组成一个细胞凋亡调控体系,在调节神经细胞凋亡过程中起着重要作用。研究发现,脊髓损伤后Bcl-2蛋白仅有少量表达,而Bax蛋白大量表达。说明脊髓损伤后促进凋亡因子占优势,而保护因子不足从而使神经细胞向凋亡相关基因的表达,如何调控凋亡相关基因表达,对保护神经元也具有重要意义。
本研究发现,通过静脉或局部移植的BMSCs,在不同时间点可不同程度的上调Bcl-2蛋白表达,下调Caspase-3、Bax表达,具有抗凋亡作用。两移植组间因处理因素不同,无比较意义。细胞凋亡是一很复杂的机制,涉及许多基因的调控及众多凋亡因子介导的信号转导过程,因此BMSCs对细胞凋亡的作用机制还需通过基因及细胞信号转导等角度进行更深层次的研究以阐明其机理。进一步研究凋亡发生的调控机制并利用细胞凋亡规律有效地调控细胞凋亡是治疗脊髓损伤的新思路、新途径。而通过不同方法移植BMSCs获得阳性结果也为其在临床应用上奠定了基础。
[1]Prockop DJ.Marrow stromal cells as stem cells for non-hematopoietic tissues[J].Science,1997,276(5 309):71.
[2]PittengerMF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells[J].Science,1999,284(5 411):143.
[3]Azizi SA,Strokes D,Augelli BJ,et al.Engraftment and migration of human bone marrow stromal cells implanted in the brain of albino rats similarities to astrocyte grafts[J].Proc Natl Acad SciUSA,1998,95(7):3908.
[4]Kopen GC,Prockop DJ,Phinney DG.Marrow stromal cells migrate throughout forebrain and cerebellum,and they differentiate into astrocytes after injection into neonatal mousebrains[J].Proc NatlAcad Sci SUA,1999,96(19):10.
[5]ChrysisD,Calikoglu AS,Ye P,et al.Insulin-like growth factor-1 overexpression att-enuates cerebralapoptosis by altering the expression of Bcl family protein in a de-velopmentally specificmanner[J].J Neurosc,2001,21:1481.
[6]De Haro J,Zurita M,ayllon L,et al.Detection of in-oxine-labeled bone marrow stromal cells after intravenods or intralesional administration in chronic paraplegic rat[J].Neurosci Lett,2005,377:7.
[7]Zurita M,Vaquero.Bone marrow stromal cells can achieve cure of chronic paraplegic rats;functional and morphological outcome one year after transplantation[J].Neurosci Ixtt,2006,402;51.
[8]Emery E,.Aldana P,Bunge MB,et al.Apoptosis after traumatic human spinal curd injury[J].J Neurosurg,1998,89:911.
[9]Casha S,Yu WR,Eehlings MG.Oligodendroglial apoptosis occurs along degenerating axon,and is associated with FAS and p75 expression following spinal cord injury in the rat[J].Neuroscience,2001,103:203.
[10]Li CL,Brudin G,Farooque M,et al.Apoplosis and expression of Bcl-2 after compression trauma to ral spinal cord[J].J Neuropathol Exp Neurol,1996,55:280.
[11]Basso DM,Beattie MS,Bresnahan JC.Graded histological and locomotor outcomes after spinal cord contusion us ing the NYU weight drop device versus transaction[J].Exp Neurol,1996,139:244.

