尾加压素Ⅱ促NRK-49F细胞增殖及ECM分泌作用
张 丹,李希宁,孙 波
(1.长春市中心医院心内科,吉林 长春130051;2.吉林大学药学院)
尾加压素Ⅱ(urotensinⅡ,UⅡ)是一种进化上高度保守的生长抑素样环肽,最早从硬骨鱼脊髓尾部下垂体中分离而来,其分布具有种属普遍性。Matsushita等[1]研究发现肾脏富含UⅡmRNA,现已证明,UⅡ对肾脏来说是一个自分泌或旁分泌的生长因子[2],可能与人类肾脏系统及其疾病的病理生理学有关。本研究通过体外培养大鼠肾脏成纤维细胞株NRK-49F,观察不同浓度UⅡ对大鼠肾成纤维细胞增殖及细胞外基质的影响,并且通过预先加入UⅡ抗体、尼莫地平和EDTA,观察其对UⅡ诱导NRK-49F细胞Ⅰ型胶原及Ⅲ型胶原mRNA表达的影响,旨在探讨UⅡ在肾间质纤维化中可能发生的作用。
1 材料和方法
1.1 细胞来源 大鼠肾脏成纤维细胞株NRK-49F细胞购自中国科学院上海生科院细胞资源中心,以含10%小牛血清的DMEM培养基为基础培养基。
1.2 主要试剂 UⅡ(Sigma),逆转录酶SuperScriptⅡ(Invitrogen),TaqDNA聚合酶(北京天根生物技术公司),山羊抗大鼠UⅡ多克隆抗体、兔抗大鼠Ⅰ型胶原(collagen Ⅰ,colⅠ)、Ⅲ型胶原(collagen Ⅲ,colⅢ)及纤连蛋白(fibronectin,FN)多克隆抗体(美国Santa Cruz公司),其他试剂均为国产或进口分析纯。
1.3 MTT法检测不同浓度UⅡ(1×10-10,1×10-9,1×10-8,1×10-7mol◦L-1)对NRK-49F 细胞增殖的影响。
1.4 ELISA法检测不同浓度UⅡ(1×10-10,1×10-9,1×10-8,1×10-7mol◦L-1)对NRK-49F 各组培养上清colⅠ、colⅢ及FN含量的影响。
1.5 RT-PCR法检测各组培养细胞colⅠ、colⅢ及FN mRNA表达 根据加入条件培养基不同将细胞分为5组,对照组(常规培养)、UⅡ组(用含10-8UⅡmol◦L-1培养液培养);U Ⅱ抗体组(用 10-5mol◦L-1UⅡ抗体培养液预处理60 min后,换含UⅡ10-8mol◦L-1培养液继续培养)、尼莫地平组(以10-5mol◦L-1尼莫地平预处理5 min后,换含UⅡ10-8mol◦L-1培养液继续培养);EDTA 组(用2×10-3mol◦L-1EDTA预处理30 min后,换含UⅡ10-8mol◦L-1培养液继续培养)。引 物序 列 如下:GAPDH上游 5′-ACCACAGTCCATGCCATCAC-3′,下游 5′-TCCACCACCCTGTTGCTGTA-3′,扩增片段长 450 bp;ColⅠ :上游 5′-GCCACCTCAAGAGAAGTC-3′, 下 游 5′-ATAGCGACATCGGCAGGATC-3′,扩增片段长度为 441 bp;ColⅢ 上 游 5′-ATGGTGGCTTTCAGTTCAG-3′,下 游 5′-CAATGTCATAGGGTGCGATA-3′,扩增产物长 351 bp;FN 下游 5′-AAGGACCACAGGAGCAG T-3′,下 游 5′-CCTTTCTGAGCAGCAACC-3′,扩增片段长411 bp。
1.6 数据处理与统计学分析 所得数据用SPSS 13.0进行单因素方差分析(one way ANOVA)进行比较,组间两两比较采用最小显著差(least significant difference,LSD)法。
2 结果
2.1 UⅡ对NRK-49F细胞增殖的影响 含不同浓度UⅡ(1×10-10,1×10-9,1×10-8,1×10-7mol◦L-1)培养基作用NRK-49F 24 h后,MTT结果可见,与对照组比较,不同浓度UⅡ刺激组A值均明显增加,且当 UⅡ浓度为1×10-10、1×10-9和 1×10-8mol◦L-1时,A值随着UⅡ浓度增加而增加,当UⅡ浓度为1×10-8mol◦L-1时 ,A 值最大,见表1。

表1 不同浓度UⅡ对NRK-49F增殖能力的影响
2.2 UⅡ对NRK-49F分泌colⅠ 、colⅢ 及FN能力的影响 ELISA法检测各组培养上清colⅠ、colⅢ及FN结果见表 2。10-9及 10-8mol◦L-1UⅡ组 colⅠ、colⅢ 及FN含量均明显增加,与对照组比较,差异有统计学意义(*P<0.05,**P<0.01)。10-7mol◦L-1UⅡ组上述三者含量与对照组比较,未见统计学意义。
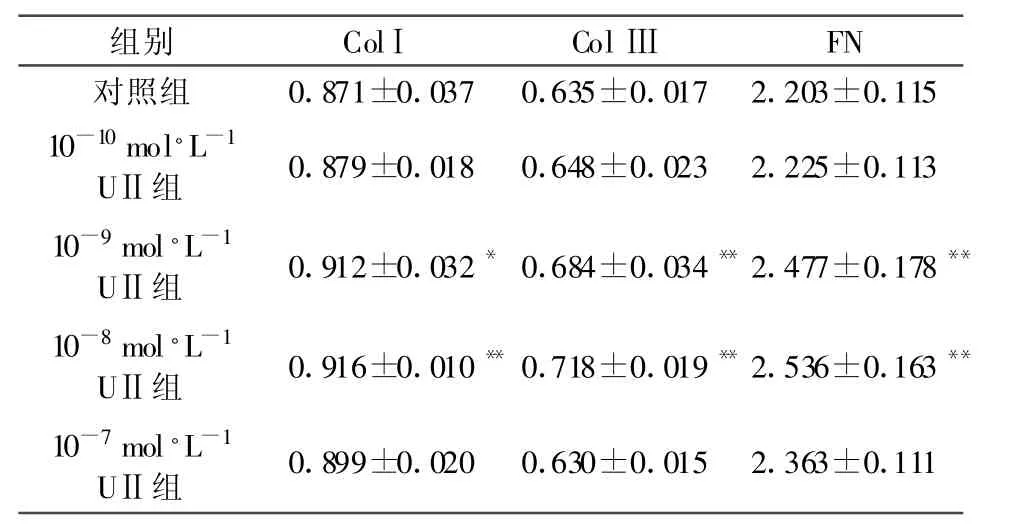
表2 UⅡ对NRK-49F分泌colⅠ、colⅢ 及FN能力的影响
2.3 UⅡ对NRK-49F colⅠ、colⅢ 及 FN mRNA表达影响 与正常对照组比较,10-8mol◦L-1UⅡ组colⅠ、colⅢ 及FN mRNA表达量明增加,差异有统计学意义(P<0.01);与10-8mol◦L-1UⅡ组比较,UⅡ抗体组上述三者mRNA表达量明均明显降低(P<0.01)。尼莫地平组和 EDTA组colⅠ、colⅢ mRNA表达量明显低于10-8mol◦L-1UⅡ组,差异有统计学意义(P<0.01),但FN mRNA表达量与10-8mol◦L-1UⅡ组比较差异未见显著性,见图1。
3 讨论
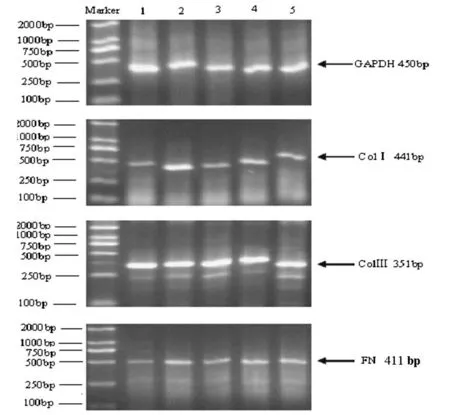
图1 UⅡ对NRK-49F colⅠ 、colⅢ及FN mRNA表达影响
研究发现,除血流动力学效应外,UⅡ还是体内重要的促有丝分裂原,能够促进血管平滑肌细胞、心脏成纤维细胞及气道平滑肌细胞等多种细胞增殖[3]。新生大鼠离体心肌研究表明,UⅡ可呈剂量依赖性促进心肌纤维化,推测其在心肌肥大及纤维化过程中起调控作用[4]。UⅡ在肾脏中的高表达提示其在肾脏具有特殊功能,可能与肾脏疾病的发生发展有关。本研究从其刺激肾间质成纤维细胞增殖及细胞外基质(Extracellar matrix,ECM)分泌的角度进行探讨,结果表明,一定浓度范围内(1×10-10,1×10-9,1×10-8mol◦L-1),UⅡ可呈剂量依赖性刺激NRK-49F的增殖,并刺激其分泌colⅠ、colⅢ 及FN等ECM成分,本研究中,当UⅡ浓度达到1×10-7mol◦L-1时,尽管其仍表现出明显的刺激NRK-49F增殖能力,但培养细胞的ECM分泌能力未见明显增加。
为探讨UⅡ刺激肾脏成纤维细胞增殖及分泌ECM机制,本研究用<去(NRK-49F)>尼莫地平及EDTA对 1×10-8mol◦L-1UⅡ刺激 NRK-49F合成ECM作用进行干预,结果发现尼莫地平及EDTA均可明显降低NRK-49F colⅠ、colⅢ 及FN mRNA的表达。尼莫地平属双氢吡啶类钙拮抗剂,可阻断细胞膜上的钙离子通道,从而抑制细胞外钙离子内流,使细胞内钙离子水平降低,EDTA是一种重要的Ca2+络合剂,可使细胞外Ca2+浓度降低,二者均可使细胞外Ca2+内流减少。有研究发现,UⅡ可促进肾小管上皮细胞(NRK52E)的增殖,其机制与其刺激细胞质Ca2+浓度升高密切相关,尼莫地平及EDTA可显著抑制此效应[5]。Iglewski等发现,UⅡ与其受体结合,可激活第二信使三磷酸肌醇(inositol triphosphate,I P3)及二酯酰甘油(diacylglycerol,DG),并导致血管平滑肌细胞内Ca2+增加,Ca2+内流增加导致Ca2+依赖的激酶(Ca2+-dependent kinases,CaMK)活性增加,从而引起细胞增殖[6]。这些研究结果提示UⅡ的促丝裂原效应通过Ca2+来介导。但有关UⅡ刺激细胞合成和分泌ECM的研究尚未见报道。本研究中,尼莫地平和EDTA均可明显抑制UⅡ介导的NRK-49F colⅠ、colⅢ mRNA高表达,即抑制肾脏成纤维细细胞的ECM合成能力,表明UⅡ的促肾间质纤维化的作用也可能与Ca2+介导的信号通路有关。
综上所述,可以推测UⅡ通过与G蛋白耦联受体相结合,促进细胞外钙内流及细胞内钙贮释放,使细胞质Ca2+增加,并激活多种信号转导途径,激活初始应答基因,表达转录因子,从而引起细胞增殖及ECM的过度表达,因此,UⅡ可能成为抑制肾间质纤维化治疗的一个新靶标,当然其具体机制尚需进行更深入探讨。
[1]Matsushita M,Shichiri M,Imai T,et al.Co-expression of urotensinⅡand its receptor(GPR14)in human cardiovascular and renal tissues[J].Hypertens,2001,19(12):2185.
[2]Matsushita M,Shichiri M,Fukai N,et al.urotensinⅡis an autocrine/paracrine growth factor for the porcine renal epithelial cell line,LLCPK1[J].Endocrinology,2003,144(5):1825.
[3]张勇刚,陈亚红,马春艳,等.尾加压素的促丝裂作用[J].中国动脉硬化杂志,2001,9(1):14.
[4]Tzanidis A,Hannan RD,Thomas WG,et al.Direct action of urotensinⅡon the heart:implications for cardiac fibrosis and hypertrophy[J].Circres,2003,93(4):246.
[5]Tian L,Li C,Qi J,et al.Diabetes-induced upregulation of urotensin II and its receptor plays an important role in TGF-beta1-mediated renal fibrosis and dysfunction[J].Am J Physiol Endocrinol Metab,2008,295(5):E1234.
[6]Iglewski M,Grant RS.Urotensin II-induced signaling involved in proliferation of vascular smooth muscle cells[J].Vasc Health Risk Manag,2010,6:723.

