酸敏感离子通道1a在糖尿病鼠局灶脑缺血中的变化及意义
方 芳,邢 影,徐忠信,郑昭石,张 爽
(吉林大学中日联谊医院神经内科,吉林长春130033)
酸敏感离子通道是一类位于细胞膜上的阳离子通道,近年来有研究已经表明在脑缺血的过程中伴有酸敏感离子通道的激活[1]。引起酸敏感离子通道激活的原因主要由于细胞外的pH值的降低,而酸中毒是脑缺血发病过程中的主要病理机制。本研究在前期实验中已经证实糖尿病合并的局灶脑缺血氧化应激反应较单纯脑缺血时明显增强,而Xiang-Ping Chu[2]等人的研究发现ASIC1a的胞外段有氧化及还原结合位点,因此我们推测在糖尿病局灶脑缺血时可能伴有ASIC1a开放的增加。为了验证此假说并观察其在不同缺血时间时的变化规律,我们进行如下实验。
1 材料与方法
1.1 实验动物、分组及主要试剂、仪器
雄性Wistar大鼠72只,体重在220-240 g(由吉林大学基础医学院动物实验中心提供)。
分组:糖尿病组32只,正常组40只;根据局灶脑缺血时间分为正常假手术组,单纯缺血1 h,3 h,6 h,24 h,糖尿病局灶缺血1 h,3 h,6 h,24 h,每组8只;共 9 组 。
主要试剂、仪器:STZ(Sigma,美国),ASIC1a(一抗Santa,美国)血糖仪、血糖试纸(美国罗氏),水合氯醛(上海亚培生物有限公司,上海),重组人胰岛素(美国礼来),TTC、柠檬酸缓冲液、DAB显色试剂盒、羊抗兔 IgG(二抗)(博士德,武汉),照相显微镜(Olympus,日本),超速离心机(OptimaTM LE-80K,美国),凝胶分析系统(Biotech,美国)
1.2 模型建立
(1)糖尿病大鼠模型建立及评价
高脂饮食4周后,参考文献[3]并按照试剂说明,制备pH=4.2的柠檬酸缓冲液。按30 mg/Kg称取STZ,溶于柠檬酸缓冲液中,快速腹腔注射。7天后尾静脉取血,测空腹血糖≥16.7 mmol/L为造模成功。血糖高于30 mmol/L剔除实验,随机补充。
(2)局灶脑缺血模型(MCAO)的建立及评价
MCAO模型以Longa[4]法为标准。待动物清醒后,观察神经系统症状以判断手术是否成功。参考文献[4]的5分制法进行评分。0分:无神经损伤症状;1分:不能完全伸展对侧前爪;2分:向对侧转圈;3分:向对侧倾倒;4分:不能自发行走,意识丧失,5分:死亡。分值越高,说明动物症状越严重。造模成功的判定标准:以大鼠手术麻醉清醒后出现右侧肢体瘫痪,站立不稳,提尾时向右侧转圈为模型成功的判断标准。1-3分为纳入标准,0分、4分或死亡剔除,缺少的随机补充。实验中选取脑缺血24 h的大鼠进行功能评分。
(3)TTC染色证实局灶脑梗死
造模后每组动物中取1只麻醉后,0.9%生理盐水灌洗后,取脑,-20℃冰箱中速冻20 min,冠状位每隔2 mm切片(5片)。切片置于2%TTC液中,避光放入37℃温箱,每隔5-10 min翻动脑组织切片,使均匀接触到染色液,30 min左右取出评价成功后,其余动物应用上述方法取脑,留取左侧大脑半球中间2/3皮层组织,-70℃冰柜保存。
1.3 蛋白免疫印记检测
按操作说明进行,Bandscan分析各条带灰度,计算ASIC1a各条带的强度与相对的β-actin条带强度的比值,表示各组ASIC1a蛋白表达水平。
1.4 数据统计 应用SSPS11.0软件包,所得数据用±s表示,组间比较用 t检验,以 P<0.05有统计学差异。
2 结果
2.1 血糖结果 所有糖尿病大鼠空腹血糖在19.7±2.38 mmol/L,符合糖尿病诊断标准。
2.2 神经功能评分
对糖尿病局灶脑缺血24 h及单纯缺血24 h大鼠进行神经评价,结果显示糖尿病组大鼠术后清醒较晚,肢体偏瘫程度重于单纯缺血组,两组相比差异显著(P<0.05)(见表1)。
表1 单纯缺血与糖尿病局灶脑缺血24 h神经功能评分(±s,n=5)

表1 单纯缺血与糖尿病局灶脑缺血24 h神经功能评分(±s,n=5)
两者神经功能评分相比,P<0.05
n 神经功能评分MCAO 24 h 8 1.80±0.837 DM+MCAO 24 h 8 2.60±0.591
2.3 TTC染色证实局灶脑梗死
正常脑组织为粉红色,经TTC染色后缺血的脑组织为苍白色,在缺血1 h脑组织变化不明显,缺血3 h可见左侧半脑组织有小片状苍白区,边界不清;缺血6 h苍白区明显增大;缺血24 h可见脑组织缺血严重。在相同实验条件下,结果显示糖尿病大鼠脑缺血区面积明显大于单纯缺血组。
2.4 Western Blot法检测单纯缺血组及糖尿病缺血组不同缺血时间ASIC1a的表达变化
2.4.1 单纯局灶脑缺血组不同缺血时间ASIC1a的表达变化
图1为Western Blot法检测单纯局灶脑缺血组不同缺血时间ASIC1a蛋白表达变化。如图1所示:上层目的条带从左到右依次为假手术组、MCAO1 h、3 h、6 h 、24 h;下层为 β-actin。计算 ASIC1a/β-actin灰度比值为纵坐标,各缺血不同时间为分组变量横坐标,直条图变化如图所示。结果显示从MCAO1 h开始ASIC1a的表达增加,并与缺血时间呈依赖关系,24 h增加最明显,组间比较有显著性差异(P<0.05)。
2.4.2 糖尿病局灶脑缺血组不同缺血时间ASIC1a的表达变化
图2为Western Blot法检测糖尿病局灶脑缺血组不同缺血时间ASIC1a蛋白表达变化(上层目的条带从左到右依次为 DM+MCAO1 h、3 h、6 h、24 h;下层为β-actin。计算ASIC1a/β-actin灰度比值为纵坐标,各缺血不同时间为分组变量横坐标)。结果显示从DM+MCAO1h开始ASIC1a的表达增加,并与缺血时间呈依赖关系,24 h增加最明显。组间比较有显著性差异(P<0.05)。
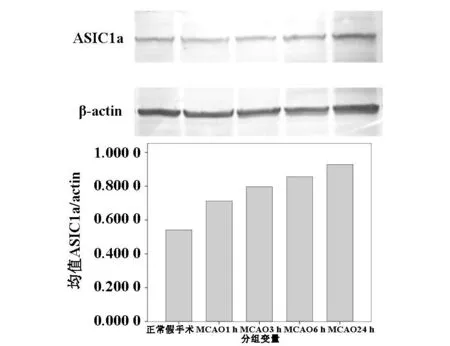
图1 单纯缺血不同时间ASIC1α表达变化
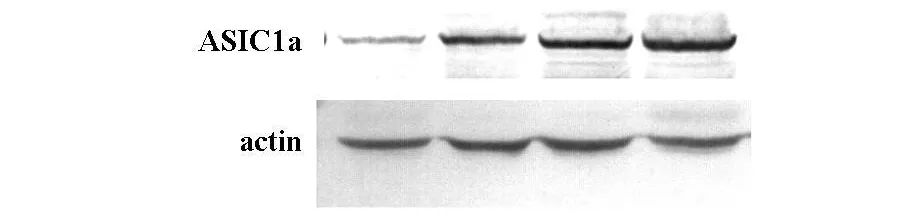
图2 糖尿病局灶脑缺血组不同缺血时间ASIC1a表达变化
2.4.3 MCAO与DM+MCAO不同缺血时间各组ASIC1a的比较
通过上述结果,比较MCAO与DM+MCAO不同缺血时间ASIC1a的变化,结果显示与MCAO对应缺血时间相比DM+MCAO各组的ASIC1a明显增高,尤以缺血24 h明显。说明缺血时间越长,脑组织损伤越重;相同条件下糖尿病组损伤更重,组间比较P<0.05。
3 讨论
近年来有关ASIC1a与缺血性脑血管病的研究成为热点[5]。研究表明在急性脑缺血时明显激活了ASIC1a电流,加重脑损伤。Xiong等[6]发现一种从动物狼蛛体内提取的毒素Psalmotoxinl(或PCTX1),它可以特异性阻断ASIC1a电流,使脑短暂缺血病灶模型的梗死容积显著减小。
ASIC1a电流增强加重脑损伤的原因在于它的开放可使Na+和Ca2+的通透性增加,引起细胞内Ca2+超载,这是除谷氨酸的兴奋毒性以外另一种引起钙超载的原因[7]。Bayer K[8]的研究证实在脑缺血条件下,CaMKII依赖性磷酸化,激活ASIC1a通道上的Ser478和 Ser479位点,电流增强的同时加速Ca2+内流。胞内过量的Ca2+激活一连串的细胞毒性事件导致胞内的酶激活,从而引发蛋白质、脂类和核酸的降解,加重组织细胞损伤。在本研究中,我们检测了局灶脑缺血不同时间缺血周围皮层组织ASIC1a的表达,结果发现随着缺血时间的延长,ASIC1a呈现逐渐增多趋势,这一结果同文献报道相一致,同样也进一步证实了随着缺血时间的延长,脑组织损伤加重。
为了验证在糖尿病基础上的局灶脑缺血时是否存在ASIC1a表达的增加,我们应用高脂饮食联合链脲佐菌素STZ制备糖尿病大鼠模型,再用线栓法制备糖尿病大鼠局灶脑缺血模型,通过神经功能评分及TTC染色,我们证实了糖尿病大鼠局灶脑缺血的缺血病灶及功能障碍明显重于单纯局灶脑缺血。免疫印记的结果显示与单纯局灶脑缺血各时间点相比,糖尿病组各个时间点ASIC1a的表达明显增加。
综上,我们得出结论糖尿病大鼠局灶脑缺血加重的原因是由于膜上ASIC1a电流增加,导致细胞内Ca2+内流增多,加重组织细胞损伤。因此封闭ASIC1a或者延迟ASIC1a的开放将是治疗缺血性脑血管病的新靶点。
[1]Gründer S,Chen X.Structure,function,and pharmacology of acid-sensing ion channels(ASICs):focus on ASIC1a[J].Int J Physiol Pathophysiol Pharmacol,2010,2(2):73.
[2]Xiang-Ping Chu,Natasha Close,Julie A.ASIC1a-Specific Modulation of Acid-Sensing Ion Channels in Mouse Cortical Neurons by Redox Reagents[J].The Journal of Neuroscience,2006,26(20):5329.
[3]Rees DA,Alcolado JC.Animal models of diabetes mellitus[J].Diabet Med,2005,22(4):359.
[4]Zea longa EL,Weisein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniotomy in rats[J].Stroke,1989,20(1):84.
[5]Pignataro G,Simon RP,Xiong ZG.Prolonged activation of ASIC1a and the time window for neuroprotection in cerebral ischaemia.Brain,2007,130(1):151.
[6]XiongZ G,Zhu XM,Chu XP,et al.Neuroprotection in ischemia:blocking calcium-permeable acid-sensing ion channels[J].Cell,2004,18(6):687.
[7]Mishra V,Verma R,Raghubir R.Neuroprotective effect of flurbiprofen in focal cerebral ischemia:the possible role of ASIC1a[J].Neuropharmacology,2010,59(7-8):582.
[8]BayerKU,De Koninck P,Leonard AS,et al.Interaction with the NMDA receptor locks CaMKII in an active confor mation[J].Nature,2001,411(6839):801.

