AZT对胃癌细胞SGC7901端粒酶活性的影响
于金海,刘国辉
(吉林大学白求恩第一医院1.胃肠外科;2.急诊科,吉林 长春130021)
近几年的研究显示通过抑端粒酶活性,干预端粒酶的激活过程,阻断肿瘤细胞的亚性转化,在肿瘤治疗上有重要意义和巨大的潜力[1]。本研究通过端粒酶抑制剂3-叠氮脱氧胸苷(3-azido-deoxythymidine,AZT)作用于人胃癌细胞SGC7901,比较AZT作用后癌细胞端粒酶活性的变化,并利用缺口末端标记技术【terminal deoxyribonucleotidyl transferse(TdT)-mediated biotin-16dUTP nick end labeling,TUNEL】和流式细胞术检测AZT作用后肿瘤作用后胃癌细胞SGC7901凋亡情况,进而探讨AZT抑制肿瘤细胞端粒酶可能的机制,为端粒酶抑制剂的临床应用奠定基础。
1 材料与方法
1.1 细胞
人胃癌细胞株SGC7901及其培养基由中国医学科学院肿瘤医院提供。
1.2 主要试剂和仪器
AZT为德国默克公司产品;1250胰蛋酶为罗氏诊断产品(上海)有限公司产品;新生牛血清购自武汉达邦生物科技有限公司;注射用青霉素钠购自山东鲁抗医药股份有限公司;注射用硫酸链霉素购自大连美罗大药厂;PBS购自武汉博士德生物公司;DMSSO购自广州新港化工有限公司;DEPC购自上海生物工程技术服务有限公司;SYBR Green I荧光染料购自上海物工程技术服务有限公司;端粒酶活性检测试剂盒(TRAP-ELISA)为Sigma产品;细胞凋亡检测试剂盒购自BoehringerMannheim公司;Annexin V-FITC试剂盒购自 Beckman Coulter公司;美国Bio-Rad公司的icycleriQ实时荧光定量PCR仪;德国Leica的DMR+Q550病理图像分析仪;美国Becton Dickinson,FACS Calibur流式细胞仪;
1.3 细胞培养液及细胞毒性实验(MTT法)
具体操作方法参见文献[2]。实验组为AZT处理的胃癌细胞SGC7901,对照组为不加任何处理因素的胃癌细胞SGC7901。MTT作用浓度分别为:2 mmol/L,4 mmol/L,8 mmol/L,16 mmol/L,32 mmol/L,作用时间分别为:12 h,24 h,36 h,48 h。通过MTT实验确定AZT作用最佳作用浓度和时间。
1.4 实时荧光定量端粒重复序列扩增(real-time fluorescent quantitative TRAP assay,FQ-TRAP)法检测端粒酶活性
1.4.1 端粒酶提取液的准备 收集实验组和对照组细胞,调整细胞密度为1×106/ml,参照端粒酶TRAP-ELISA试剂盒说明书操作。
1.4.2 实时荧光定量PCR反应体系包括 反应混合物(TRAP-ELISA 试剂盒溶液 2)12.5 μ l,模板 1 μ l,20×SYBR Green I 1.25 μ l,焦碳酸二乙酯(DEPC)水10.25 μ l。25℃引物延伸 30 min,94℃端粒酶灭活 5 min,94 ℃30 s、50℃30 s、72℃90 s,共进行 40个循球,最后72℃延伸10 min,实验重复4次。
1.4.3 结果判定 以4次实验平均阀限循环值(cycle threshold,CT)(±s)表示端粒酶活性。CT值大者,模板数小,表示端粒酶活性低。CT值小者,模板数大,表示端粒酶活性高。用SPSS10.0For windows软件进行数据的统计公析。根据实验组CT值对照CT值,可计算AZT作用后癌细胞端粒酶活性下调率。计算公式为:端粒酶活性下调率=(实验组平均CT值-对照组平均 CT值)/对照组平均CT值×100%。
1.5 细胞凋亡检测
1.5.1 TUNEL法检测细胞凋亡 收集实验组和对照组细胞,消化制成1×105/ml的单细胞悬液。按照试剂盒说明书的要求进行操作。Leica病理图像分析仪进行凋亡分析,以细胞核中有棕黄色颗粒者为凋亡细胞。400倍光镜下随机计数300个细胞计算凋亡细胞的比率。
1.5.2 流式细胞仪检测细胞凋亡 收集实验组和对照组细胞,消化制成单细胞悬液。按照Annexin V-FITC试剂盒说明书进行操作。在流式细胞仪上记录激发波长488 nm处的红色荧光。
2 结果
2.1 AZT的作用浓度、作用时间与细胞抑制率的关系
MTT实验结果见表1。

表1 不同浓度AZT作用于SGC7901胃癌细胞后细胞存活率
2.2 FQ-TRAP法检测AZT作用后癌细胞端粒酶活性变化
以16 mmol/L浓度AZT作用于SGC7901胃癌细胞36 h后,FQ-TRAP检测显示,实验组CT值为31.0±0.8,对照组CT值为16.5±0.6两组有显著性差异(P<0.001)。这说明AZT对SGC7901胃癌细胞的端粒酶活性有明显的抑制作用。同时计算端粒酶活性的下调率,结果显示AZT对SGC7901胃癌细胞端粒酶活性的下调率为54.7%。
2.3 细胞凋亡的检测
AZT作用36 h后,利用TUNEL法在光学显微镜下观察到实验组出现典型的凋亡细胞形态学变化,即贴壁由伸展的铺路石样变为椭圆形,细胞体积缩小,细胞之间的联接变得松散,部分贴壁的细胞开始脱壁;而对照组没有出现此类改变(见图1,2)Annexin V-FITC法检测肿瘤细胞凋亡率,对照组的凋亡率为1.43%,实验组凋亡率为14.6%(见图3,4)。
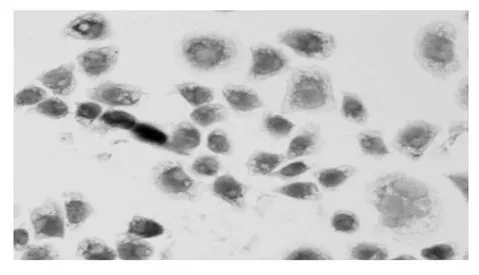
图1 AZT作用36 h后凋亡细胞形态变化

图2 对照组36 h后凋亡细胞形态变化
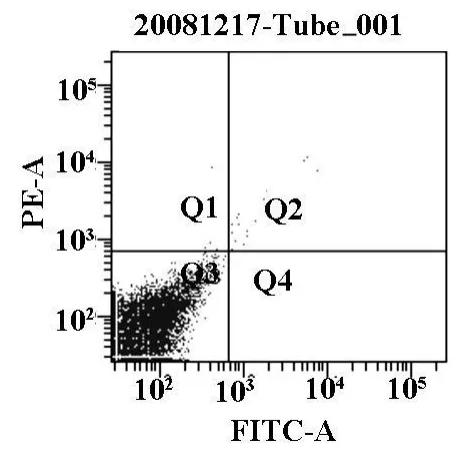
图3 流式细胞术检测AZT作用后凋亡率
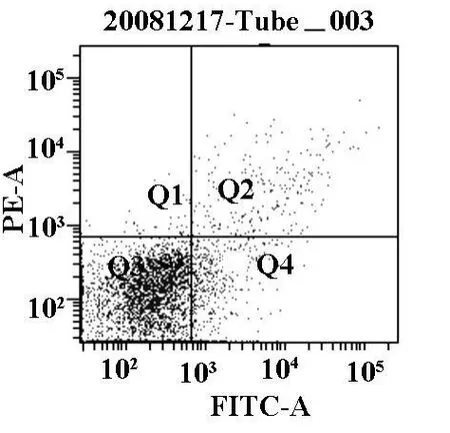
图4 流式细胞术检测对照组凋亡率
3 讨论
端粒酶是合成端粒酶DNA的特殊逆转录酶,具有RNA依赖性和DNA多聚酶性质的核糖蛋白复合体,能以自身RNA为模板,不断合成端粒DNA序列,保持染色体端粒的完整性。研究显示,在几乎所有恶性肿瘤及永生细胞中都有阳性表达,而在绝大部分正常体细胞(除生殖细胞、造血干细胞及表皮基底细胞等少数细胞外)及良性肿瘤组织中则为阴性或表达率极低,它是目前已知的最广谱的恶性肿瘤标志物之一[3,4]。端粒酶活性与恶性肿瘤之间的高度相关性使端粒酶成为近年来肿瘤治疗研究的新热点,端粒酶活性高低与肿瘤的治疗及预后有一定关系,对端粒酶活性的抑制是治疗恶性肿瘤的可能新途径之一[5,6]。
AZT属核苷类似物,是一种逆转录酶的抑制剂,可以和正常的单核苷酸竞争与RNA模板结合并抑制细胞内部逆转录酶的活性,在DNA复制时亦可掺入继而使复制过程中止,因此,AZT可以抑制多种肿瘤细胞的端粒酶活性,从而达到抑制肿瘤细胞增殖的作用。研究发现,AZT对体外培养的肝癌细胞、结直肠细胞、乳腺癌及肺癌细胞均有抑制作用。本研究观察到AZT在体外可以明显抑制SGC7901胃癌细胞的端粒酶活性,对其端粒酶活性下调率为54.6%,这与相关研究的结果是一致的。
[1]Yang SM,Fang DC,Luo YH,et al.Alterations of telomerase activity ang terminal restriction fragment in gastric cancer and its premalingnant lesions[J].J Gastroenterol Hepatol,2001,16(8):876.
[2]Jong HS,Park YI,KimS,et al,Up-regulation of human telomerse catalytic subunit during gastric carcinogenesis[J].Cancer,1999,86(4):559.
[3]Lechel A,MannsMP,Rudolph KL,Telomeres and telomerase:new targets for the treatment of liver cirrhosis and hepatocellular carcinoma[J].J Hepatol,2004,41(3):491.
[4]Xie C,Li Y,Tang W,et al,Study of dynamical process of heat denaturation in optically trapped single microorganisms by near-infrared Raman spectroscopy[J].J Appl Phys,2003,94(9):6138.
[5]Hsu YL,Kuo PL,Chiang LC,ET AL,involvement of p53,nuclearfactor kappab and Fas/Fas ligand in induction of apoptosis and cell cycle arrest by saikosaponind in human hepatoma cell lines[J].Cancer-Lett,2004,213:213.
[6]Zhang YH,Peng HY,Xia GH,et ai.Anticancer effect of two diterpenoid compounds isolated from Snnona glabra Linn[J].Acta-Pharmacol-Sin,2004,25:937.

