镉和汞两种重金属离子对四角蛤蜊血细胞DNA损伤的初步研究
房 燕, 杨红生
(1.中国科学院 海洋研究所海洋生态与环境科学重点实验室, 山东 青岛 266071; 2.中国科学院 研究生院,北京 100049)
镉和汞两种重金属离子对四角蛤蜊血细胞DNA损伤的初步研究
房 燕1,2, 杨红生1
(1.中国科学院 海洋研究所海洋生态与环境科学重点实验室, 山东 青岛 266071; 2.中国科学院 研究生院,北京 100049)
利用彗星电泳技术, 研究了不同胁迫浓度和胁迫时间下, Cd2+和 Hg2+对四角蛤蜊(Mactra veneriformis)血细胞DNA损伤的情况。研究结果显示, 50、100和200 μg/L Cd2+胁迫14天不能造成四角蛤蜊血细胞DNA损伤。10、20和40 μg/L Hg2+胁迫均能明显损伤血细胞DNA, 并且DNA损伤程度分别与Hg2+胁迫时间、胁迫浓度具有一定正相关性。200 μg/L Cd2++20 μg/L Hg2+复合胁迫组, 四角蛤蜊血细胞 DNA损伤程度随胁迫时间延长而增加, 并且大于 Hg2+胁迫组。上述结果表明对于四角蛤蜊而言, Hg2+潜在的遗传毒性大于Cd2+; Cd2+和Hg2+对DNA的损伤具有协同作用。
四角蛤蜊(Mactra veneriformis); Cd2+; Hg2+; DNA损伤; 彗星电泳
工农业的快速发展以及人口的急剧增加, 特别是沿海地区工业的快速发展, 导致了近海海洋环境污染日益突出。调查结果显示, 我国近岸海域部分海水和沉积物样品中重金属镉(Cd)、汞(Hg)含量超标[1]。重金属是一类毒性较大的污染物, 可以被水生生物大量富集, 引起生物体代谢的紊乱、疾病甚至死亡, 还可以通过食物链的生物放大作用危害人类健康[2]。而且, 许多重金属污染物具有潜在的遗传毒性,能够导致DNA损伤, 引起疾病, 并危害子代健康。
双壳贝类是监测水域污染物的常用指示生物,同时, 污染物对贝类的毒理学研究也成为研究热点。目前, 这些研究多集中于贻贝和牡蛎。由于缺乏附着基, 在滩涂区域, 贻贝和牡蛎的分布量非常小。随着该区域生态与环境状况恶化, 开发其他贝类用于滩涂污染物检测和毒理学研究是十分必要的。四角蛤蜊(Mactra veneriformis)是一种典型的埋栖型滩涂贝类, 广泛分布在我国、韩国和日本沿海, 是我国主要的经济贝类之一。它能够大量富集重金属, 具有作为污染物指示物种的潜力[3]。但是有关四角蛤蜊的毒理学研究还较少, 尤其是污染物导致四角蛤蜊DNA损伤的研究还未见报道。本研究开展了室内模拟实验,利用彗星电泳技术评价了 Cd2+和 Hg2+对四角蛤蜊DNA损伤的情况。为重金属毒性评价体系的建立提供技术支持, 为阐明重金属对生物体的毒性机制提供科学依据。
1 材料与方法
1.1 实验生物的驯养和胁迫实验
实验用二龄四角蛤蜊[壳长(3.27 ± 0.23)cm, 壳高(2.95 ± 0.31)cm, 壳宽(2.17 ± 0.17)cm, 湿质量(12.07 ± 1.56) g], 于2009年6月购自日照养殖场。在实验室驯养 14 d[水温(20±2)℃, 溶解氧 7.7~8.3mg/L, pH 7.9~8.1, 盐度 33], 将四角蛤蜊转移至聚乙烯箱内开始正式胁迫实验。每只箱内海水体积为50 L, 放养100只四角蛤蜊。根据课题组前期研究中得到的Cd2+、Hg2+对四角蛤蜊96h LC50[4], 结合参考文献中常用的 Cd2+、Hg2+对双壳贝类亚致死浓度[5,6], 设置了以下 7个胁迫组 50 μg/L Cd2+、100 μg/L Cd2+、200 μg/L Cd2+、10 μg/L Hg2+、20 μg/L Hg2+、40 μg/L Hg2+、200 μg/L Cd2++20 μg/L Hg2+, 并设对照组, 每组均设2个平行。配备1.35 g/L HgCl2和2.03 g/L CdCl2·2.5H2O母液, 加入到海水中以达到相应的Cd2+、Hg2+浓度, 对照组不加Cd2+、Hg2+。实验进行14 d, 整个实验过程持续充气, 并监测水体理化参数,每天固定时间换水, 换水后补加相应浓度的重金属溶液。投饵在换水前2 h进行。
1.2 血淋巴的采集
在胁迫的第0、1、4、7、11、14天, 用1mL注射器从四角蛤蜊的闭壳肌中抽取血淋巴, 及时存放于4℃冰箱。第11天Cd2+、Hg2+复合胁迫组和第14天 200 μg/L Cd2+胁迫组, 四角蛤蜊已全部死亡, 无血淋巴可取。每组随机取9只四角蛤蜊, 每3只混合为一个样本。用台盼蓝染色法检测血细胞存活率。存活率大于 95%的样本才可以用于后续的彗星电泳实验。
1.3 彗星电泳实验流程
本实验在Singh等[7]的方法上稍做改进, 具体程序如下: (1)胶板制备(烤胶法): 在烧杯里配置100mL 0.6%正常熔点琼脂糖, 煮沸后, 放入磨砂玻片并取出, 室温凉干。37℃下, 取75μL低熔点胶与25μL血淋巴混匀, 用枪直接把凝胶吹到玻片上, 4℃放置 10 min。(2)裂解: 将玻片放入裂解液(2.5 mmol/L NaCl、100 mmol/L Na2EDTA、10 mmol/L Tris-base, pH10,用前加TritonX-100和DMSO), 4℃裂解2 h, 取出玻片, 用0.2 mol/L pH7.4的磷酸钠缓冲液漂洗。(3)解旋: 将玻片放入水平电泳槽中, 倒入新鲜的电泳缓冲液(0.3 mol/L NaOH、1 mmol/L Na2EDTA, pH>13),4℃避光放置 20 min以解旋。(4)电泳: 调整电压为25V, 调整液面高度使电流达到300 mA, 4℃避光电泳20 min。电泳结束, 用磷酸钠缓冲液漂洗玻片。(5)中和: 用预冷的中和液(0.4 mmol/L Tris-base, pH 7.5), 4℃漂洗3次, 每次10 min。(6)染色和观察: 在胶板上滴加核酸染料gene finder, 染色15 min后, 在Nikon80i荧光显微镜 200倍下, 观察并拍照。(7)图像分析, 用 CASP软件分析彗星图像。Olive尾矩(OTM值)是彗星细胞尾长与尾部 DNA含量的乘积,与 DNA损伤有很好的正相关性[8], 作者选择该指标用于DNA损伤的评价。
1.4 数据处理
每个玻片上随机选择30个细胞进行分析, 结果表示为平均值±标准差。采用 SPSS13.0软件对数据作单因素方差分析, Turkey检验比较每个取样点不同实验组间的差异, 显著水平为0.05。
2 结果
2.1 Cd2+胁迫对四角蛤蜊血细胞DNA的损伤
图 1A显示的是四角蛤蜊血细胞内未受损伤的DNA电泳后的图片。图 1B显示的是细胞内损伤的DNA电泳后的图片, 彗尾即是断裂的DNA碎片。由图2可见, Cd2+胁迫期间, 四角蛤蜊血细胞OTM值没有发生显著的变化, 表明在本实验胁迫浓度和时间下, Cd2+未能造成四角蛤蜊血细胞DNA明显的损伤。
2.2 Hg2+胁迫对四角蛤蜊血细胞DNA的损伤

图1 四角蛤蜊血细胞DNA电泳Fig. 1 The comet assay ofMactra veneriformishaemocyte
由图3可知, Hg2+胁迫第1天, 血细胞OTM值即开始显著升高, 10 μg/L Hg2+胁迫组OTM值在第7和11天下降, 14天又上升; 20 μg/L Hg2+和40 μg/L Hg2+胁迫组第7天下降, 之后又上升。10μg/L Hg2+、20 μg/L Hg2+和 40 μg/L Hg2+胁迫组, OTM 值最高值均出现在第 14天, 分别为 9.12±0.14、13.09±2.11和15.95±3.48。OTM 值分别与 Hg2+胁迫时间、胁迫浓度具有一定的正相关性。上述结果表明 Hg2+能够显著诱导四角蛤蜊血细胞DNA损伤。Hg2+胁迫组与对照组OTM值的差值与胁迫时间的回归曲线表明, 20 μg/L Hg2+和40 μg/L Hg2+胁迫组OTM值与胁迫时间具有较好的线性相关性, 相关系数分别为0.907 2和0.825; 而10 μg/L Hg2+胁迫组OTM值与胁迫时间相关性较差, 相关系数为0.564 2(图4)。
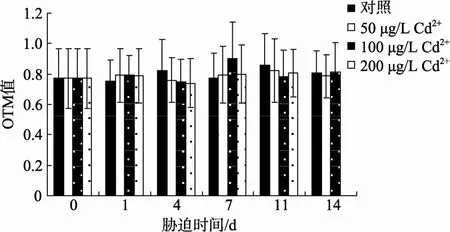
图2 Cd2+胁迫对四角蛤蜊血细胞DNA的损伤Fig. 2 DNA damage in haemocytes ofM. veneriformisexposed to Cd2+
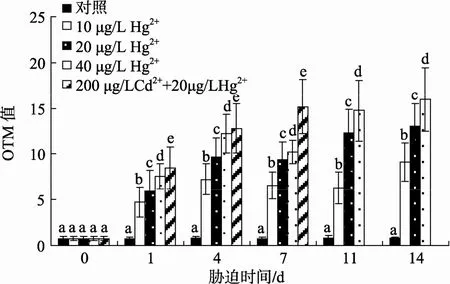
图 3 Hg2+胁迫和 Cd2++Hg2+复合胁迫对四角蛤蜊血细胞DNA的损伤Fig. 3 DNA damage in haemocytes ofM. veneriformisexposed to Hg2+and the combination of Cd2+and Hg2+
2.3 Cd2+和 Hg2+复合胁迫对四角蛤蜊血细胞DNA的损伤
由图 3可见, Cd2+和 Hg2+复合胁迫组血细胞OTM 值在第 1天即显著上升, 随胁迫时间的延长,OTM 值逐渐增加。OTM 最大值出现在第 7天, 为15.17±2.94。同一时间点, 该组 OTM 值高于 Hg2+胁迫组。
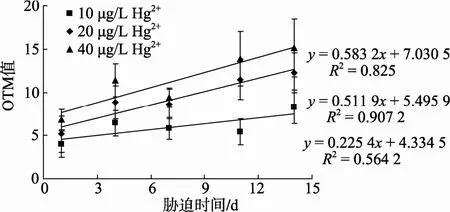
图 4 Hg2+胁迫组四角蛤蜊血细胞 OTM 值与胁迫时间的回归曲线Fig. 4 Correlation between OTMs in haemocytes ofM.veneriformisin Hg2+-treated groups and duration of exposure
3 讨论
彗星电泳是在一种在单细胞水平上检测DNA损伤与修复的方法, 能够评价外源污染物对细胞潜在的遗传毒性和致癌性。由于其简便、快速、灵敏等的特点, 被广泛应用于遗传毒理学、医学、生物学和环境监测等领域。
本研究发现, 50、100和200 μg/L Cd2+胁迫14 d,不能引起四角蛤蜊血细胞DNA的损伤。这与普遍认为Cd是一种具有较微弱遗传毒性的重金属的观点相一致。据报道, 200 μg/L Cd2+胁迫贻贝Mytilus edulis28 d, 100 μg/L Cd2+胁迫海鲷Sparus aurata11 d, 均不能导致血细胞 DNA的损伤[5,9]。作为生物体的防御机制, 四角蛤蜊金属硫蛋白和超氧化物歧化酶在mRNA和蛋白水平可被 Cd2+显著诱导[10], 有效地保护了 DNA分子免受 Cd2+毒性的伤害。但是, 大于50μmol/L 的 Cd2+能够引起大鼠肝细胞 TRL 1215 DNA 链的断裂[11]; 112 μg/L Cd2+胁迫贻贝Mytilus galloprovinciallis5 d能够引起血细胞DNA的损伤[12]。可见, Cd2+引起的DNA损伤程度因物种、细胞类型、作用剂量和作用时间的不同而不尽相同。本研究中,200 μg/L Cd2+胁迫组, 在第14天, 四角蛤蜊已全部死亡, 表明 Cd2+可能通过其他的途径, 而不是直接作用于DNA, 对四角蛤蜊产生较高的毒性。
本研究表明 Hg2+能够明显导致四角蛤蜊血细胞DNA的损伤。20 μg/L Hg2+胁迫贻贝M. edulis3 d, 32 μg/L Hg2+胁迫紫贻贝M. galloprovinciallis5 d, 血细胞DNA损伤的程度显著增大[12-13], 与本研究结果一致。据报道, 只有当污染物在生物体内靶组织中的浓度到达一定阈值时, 才可启动DNA修复系统[14]。结合实验过程中, Hg2+胁迫组血细胞OTM值在第7天下降的现象, 表明生物体可能启动了DNA修复机制,对断裂的DNA进行一定的修复。11天 20 μg/L Hg2+和 40 μg/L Hg2+胁迫组与 14 天 10 μg/L Hg2+胁迫组,OTM 值再次上升, 表明四角蛤蜊的 DNA修复系统被持续的 Hg2+胁迫所抑制, DNA损伤程度加剧。OTM 值与胁迫时间线性相关性分析表明, 10 μg/L Hg2+组的相关性较差, 仅为0.564 2, 而20 μg/L Hg2+组和 40 μg/L Hg2+组的相关性均高于 0.8, 可见 10 μg/L Hg2+胁迫组, DNA 修复能力大于 20 μg/L Hg2+和40 μg/L Hg2+胁迫组。低浓度胁迫组DNA修复能力大于高浓度胁迫组这一现象, 也在其他的研究中得到证实[14]。随着水体中 Hg2+质量浓度的升高, 生物体自身修复的相对作用变小, DNA损伤程度加剧,对生物体造成不可逆的损伤。
Cd2+和 Hg2+复合胁迫能够显著损伤四角蛤蜊血细胞DNA, 随着胁迫时间的延长, DNA损伤程度逐渐增大。在同一时间点, 该组血细胞DNA损伤程度大于Hg2+胁迫组, 表明Cd2+的存在加重了DNA的损伤, Cd2+和Hg2+对DNA损伤具有协同作用。Cd2+能够加重H2O2对贻贝M.edulis鳃细胞DNA的损伤[5]。Cd2+胁迫能够通过减缓虾Paleomonetes pugio胚胎DNA修复的过程, 加重 UV辐射和苯并芘导致的DNA损伤[15]。研究发现, Cd2+可以通过取代DNA修复过程中某些关键酶例如8-羟基鸟嘌呤DNA糖苷酶锌指结构中的 Zn2+, 导致酶活性的丧失, 干扰 DNA修复, 间接引起DNA损伤[16]。综合本文的实验结果,推测Cd2+可能会干扰四角蛤蜊DNA损伤的修复过程,使得DNA损伤不能及时修复, 从而加重Hg2+胁迫导致的DNA损伤。但具体的作用机制, 还需要进一步的实验来阐明。
综上所述, 彗星电泳技术可以成功地检测四角蛤蜊DNA损伤, 能够应用于重金属对四角蛤蜊的毒理学研究领域。200 μg/L Cd2+不能造成四角蛤蜊血细胞 DNA 损伤, 10 μg/L Hg2+即可显著诱导血细胞DNA损伤, 因此, 对于四角蛤蜊而言, Hg2+潜在的遗传毒性大于Cd2+。Cd2+和Hg2+复合胁迫造成的DNA损伤显著大于 Cd2+、Hg2+单独胁迫, Cd2+和 Hg2+对DNA损伤具有协同作用。因此, 应充分重视我国近海复合污染对贝类的毒性效应, 开展更深入的研究,阐明复合污染对贝类的作用机制。
[1] Wang C Y, Wang X L. Spatial distribution of dissolved Pb, Hg, Cd, Cu and as in the Bohai sea [J]. Journal of Environmental Sciences, 2007, 19: 1 061-1 066.
[2] Booth S, Zeller D. Mercury, food webs, and marine mammals: implications of diet and climate change for human health [J]. Environmental Health Perspectives,2005, 113: 521-526.
[3] Wang Y W, Liang L, Shi J B, et al. Study on the contamination of heavy metals and their correlations in mollusks collected from coastal sites along the Chinese Bohai Sea [J]. Environmental International, 2005, 31:1 103-1 113.
[4] 王晓宇, 王清, 杨红生. 镉和汞两种重金属离子对四角蛤蜊的急性毒性[J]. 海洋科学, 2009, 33(12):24-29.
[5] Pruski A M, Dixon D R. Effects of cadmium on nuclear integrity and DNA repair efficiency in the gill cells ofMytilus edulisL [J]. Aquatic Toxicology, 2002, 57:127-137.
[6] Tran D, Moody A J, Fisher A S, et al. Protective effects of selenium on mercury-induced DNA damage in mussel haemocytes [J]. Aquatic Toxicology, 2007, 84:11-18.
[7] Singh N P, McCoy M T, Tice R R, et al.A simple technique for quantitation of low levels of DNA damage in individual cells [J]. Experimental Cell Research, 1988, 175: 1 841-1 891.
[8] Chang M, Wang W N, Wang A L, et al. Effects of cadmium on respiratory burst, intracellular Ca2+and DNA damage in the white shrimpLitopenaeus vannamei[J]. Comparative Biochemistry and Physiology, Part C, 2009, 149: 581-586.
[9] Isani G, Andreani G, Cocchioni F, et al. Cadmium accumulation and biochemical responses inSparus auratafollowing sub-lethal Cd exposure [J].Ecotoxicology and Environmental Safety, 2009, 72:224-230.
[10] Fang Y, Yang H, Wang T, et al. Metallothionein and superoxide dismutase responses to sublethal cadmium exposure in the clamMactra veneriformis[J].Comparative Biochemistry Physiology, Part C, 2010,151: 325-333.
[11] Misra R R, Smith G T, Waalkes M P. Evaluation of the direct genotoxic potential of cadmium in four different rodent cell lines [J]. Toxicology, 1998, 126: 103-114.
[12] Bolognesi C, Landini E, Roggieri P, et al.Genotoxicity biomarkers in the assessment of heavy metal effects inmussels: Experimental studies [J]. Environmental and Molecular Mutagenesis, 1999, 33: 287-292.
[13] Tran D, Moody A J, Fisher A S, et al. Protective effects of selenium on mercury-induced DNA damage in mussel haemocytes [J]. Aquatic Toxicology, 2007, 84:11-18.
[14] Black M C, Ferrell J R, Horning R C, et al. DNA strand breakage in freshwater mussels (Anodonta grandis)exposed to lead in the laboratory and field [J].Environmental Toxicology and Chemistry, 1996, 15:802-806.
[15] Hook, S E, Lee R F. Interactive effects of UV,benzo[alpha] pyrene, and cadmium on DNA damage and repair in embryos of the grass shrimpPaleomonetes pugio[J]. Marine Environmental Research, 2004, 58: 735-739.
[16] Giaginis C, Gatzidou E, Theocharis S. DNA repair systems as targets of cadmium toxicity [J]. Toxicology and Applied Pharmacology, 2006, 213: 282-290.
Received: Aug., 12, 2010
Key words:Mactra veneriformis; Cd2+; Hg2+; DNA damage; comet assay
Abstract:The objective of this study was to investigate the effects of Cd2+and Hg2+on DNA damage in haemocytes ofMactra veneriformisthat were exposed to different concentrations of Cd2+or/and Hg2+for 14 days.DNA damage was determined by the comet assay. There was no obvious DNA damage in haemocytes caused by 50,100, and 200 μg/L Cd2+during the exposure period. However, Hg2+caused significant DNA damage in haemocytes at doses of 10, 20, and 40 μg/L in a dose- and time- dependent manner. Combination of 200μg/L Cd2+and 20μg/L Hg2+induced a time-dependent increase of DNA damage. The degree of DNA damage in the combined exposure group was severer than that in Hg2+-treated groups. These results indicate that the ranking of genotoxic potential toM.veneriformisis in decreasing order: Hg2+>Cd2+. There is a synergistic effect to DNA damage between Cd2+and Hg2+.
(本文编辑:梁德海)
Effects of Cd2+and Hg2+on DNA damage in haemocytes of Mactra veneriformis
FANG Yan1,2, YANG Hong-sheng1
(1. Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Graduate University, Chinese Academy of Sciences, Beijing 100049, China)
X171.5
A
1000-3096(2011)02-0001-05
2010-08-12;
2010-10-21
国家基金委创新研究群体科学基金项目(40821004); 国家973计划资助项目(2007CB407305); 国家农业部公益性计划资助项目(nyhyzx07-047); 国家海洋公益性行业科研专项资助项目(200805069)
房燕(1983-), 女, 山东郓城人, 博士研究生, 主要从事生态毒理学方面的研究, 电话: 0532-82898596, E-mail: fly12689@163.com; 杨红生, 通信作者, 研究员, 电话: 0532-82898620, E-mail: hshyang@qdio.ac.cn

