大型海藻无性系微球体构建和反应器培养研究
王金霞, 李爱芬, 周百成
(1. 中国科学院 海洋研究所, 山东 青岛, 266071; 2. 暨南大学 水生生物研究中心, 广东 广州 510632;3. 中国科学院 研究生院, 北京 100039)
大型海藻无性系微球体构建和反应器培养研究
王金霞1,3, 李爱芬2, 周百成1
(1. 中国科学院 海洋研究所, 山东 青岛, 266071; 2. 暨南大学 水生生物研究中心, 广东 广州 510632;3. 中国科学院 研究生院, 北京 100039)
利用大型海藻细胞的全能性获得了蜈蚣藻(Grateloupia filicina)、多管藻(Polysiphonia urceolata)和孔石莼(Ulva pertusaKjellm)的无性系材料, 在此基础上分别构建了绒球状微球体、网状微球体和簇生状微球体 3种微球体形式, 这种微球体形式适合于大型海藻的生物反应器高密度培养。簇生状的孔石莼微球体在10 L藻类生物反应器中的培养密度达5.81 g/L 鲜质量, 最高生长速度达到0.36 g/L/d 鲜质量, 最大比生长速率为0.103/d。藻类生物反应器高密度培养海藻无性系可用于海藻育苗、水产养殖水处理以及天然活性物质生产等。
海藻无性系; 光生物反应器; 微球体; 高密度培养
大型海藻生物反应器培养技术在海藻育种、育苗、天然产物和饲料生产以及水处理等方面有广泛的应用价值, 是藻类生物技术实现产业化的关键下游技术[1]。由于在藻体形态构建和生物反应器选型方面都存在一定的问题, 所以大型海藻反应工程研究落后于微藻方面的研究和应用。
中国已经建立了大规模的海带、紫菜等海藻的育苗和养殖产业[2]。在此基础上, 紫菜丝状体(孢子体)悬浮培养技术已用于良种扩繁和育苗[3-4], 海带、裙带菜丝状配子体悬浮培养已用于良种扩繁, 但采用高效生物反应器进行培养仅处于初步试验阶段[5]。在国际上, 多数使用陆基水槽培养大型海藻叶状体,试用于海藻生产或水处理等[6-7], 生物反应器选型和高效培养的研究较少。
大型海藻具有比高等植物更强的细胞全能性,可以在无外加激素的条件下, 从各种外植体获得可扩繁的无性系, 再通过无性系再生获得叶状体,成为一种新的育苗方法, 取代传统的以孢子为起点的育苗技术[8-9]。在本项研究中, 以从切段、次生假根等外植体获得的蜈蚣藻(Grateloupia filicina)、多管藻(Polysiphonia urceolata)和孔石莼(Ulva pertusaKjellm)无性系为起始材料, 进一步构建停留在一定发育阶段的微球体, 用气升式光生物反应器实现高密度培养, 构建了具有多种用途反应工程模块。
1 材料与方法
1.1 材料
3种海藻均采自青岛太平角潮间带, 在单藻培养条件下获得无性系, 在实验室条件下长期保存。蜈蚣藻是由果孢子萌发获得的丝状体, 多管藻是从藻体切段获得的可以在室内长年生长的藻体, 孔石莼是从叶状体切块再生获得的无性系, 其次生假根可大量再生新的藻体[10]。
将无性系藻体切成 1~5 mm长的藻段, 于加 PES培养基[11]的海水中通气培养, 获得小球状藻落, 用于实验。培养温度约 15℃, 光照强度 30~40 μE/(m2⋅s), 光暗周期为12 h: 12 h。培养液不加生长素和细胞分裂素。
1.2 培养
采用外照光、内导流气升式生物反应器培养海藻无性系。2种反应器的体积分别为2 L和10 L。2 L反应器用于海藻微球体构建和扩培。
实验用的10 L反应器用有机玻璃制成, 包括具有环形支架的底座和加内导流筒的反应器(图 1)。4支直径25 cm, 32 W环形荧光灯置于环形支架上作为光源; 用时间控制器自动控制照光和通气时间。反应器主要技术参数如下: 高径比2.78, 光径9 cm, 受光面积(A)0.251 m2, 容积 12.5 L, 装料体积(V)10.1 L,A/V为 23.68/m, 上升区与下降区体积之比为 0.41。反应器表面入射光强可调, 为66~112 μE/(m2s)。通气量为0.3 m3/h, 设空气过滤器。

图1 气升式藻类生物反应器(10 L)Fig. 1 Airlift photobioreactor (10 L) for algae culture
培养液为海水加PES培养基[11]。用化学灭菌法对反应器和培养液同时灭菌, 24 h后接种培养。光暗周期为12 h: 12 h, 24 h连续通气培养。每天定时测量DO、pH和温度。
1.3 生物量的测定
培养成球状的藻体经抽滤, 再用消毒海水冲洗 3遍, 继续抽滤3~5 min。将藻体转移到另一干燥滤纸上,进一步吸干藻体表面水分, 用电子天平称鲜质量。
比生长速率按下式计算:
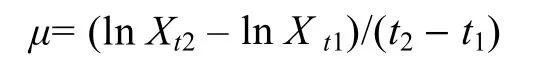
其中,μ为比生长速率,Xt2、Xt1分别为t2和t1时的生物量。
1.4 其他
培养液的pH、温度用上海雷磁仪器厂的pHS-3B型精密pH计测量。培养液的溶解氧量(DO)用上海雷磁仪器厂的 JPB-607型溶氧仪测量。光强用北师大光电仪器厂的FGH-1型光合有效辐射计测量。
2 结果
2.1 海藻无性系的构建
蜈蚣藻是同型世代交替。生殖细胞附着后先形成盘状体, 再长成直立株, 生活史中无丝状体阶段。但是, 通过培养可以从孢子、盘状体和直立株外植体获得丝状体[9,12]。这种丝状体的阶段可以再生, 扩繁成单列细胞组成的丝状体无性系(图 2-1)。在静止培养时, 切断再生顶端细胞, 附着后在7 d以后开始形成盘状体, 丝状体不再伸长, 盘状体继续长大, 最后长出直立株, 进入正常的生活史循环。
多管藻也是同型世代交替。在自然界, 多管藻在冬季生长旺盛, 夏季消失, 其度夏机制并不清楚。但是, 如在生长期将藻体切段, 可以再生为植株, 并可在室温条件下度夏[10]。这种藻体可以通过切段扩繁为长期保存的无性系。无性系藻体虽然也是由多列细胞组成, 具有中轴细胞和围轴细胞等结构特征,但是没有野生藻体那样的分枝结构。虽然藻体表面的有些围轴细胞会转化为分生细胞, 长出无规则分枝, 但总体上呈丝状形态, 长度可达5 cm以上。此外, 还从围轴细胞长出许多无色、透明的毛丝体(图2-2)。藻体切段具有极性。一端再生为顶端细胞, 另一端产生丝状假根。这些毛丝体和丝状假根一旦同培养器皿的固体表面接触, 就会迅速以二叉分枝的方式形成固着器, 成为独立的完整藻体。
将孔石莼的叶状体切割成小块可以诱导获得无性系[8]。在静止培养条件下, 假根附着在基质上, 从次生假根不断长出新的丝状藻体, 覆盖瓶壁, 形成藻垫。将其取出, 剪碎成1~2 mm左右片段, 又能从次生假根生出新的藻体, 实现无性系扩增, 重新长成藻垫(图2-3)。
2.2 海藻微球体的构建
蜈蚣藻、多管藻和孔石莼的无性系在静止培养时都形成固着器, 长成附壁的个体, 所以并不适于反应器高密度培养。为此, 将这些海藻的无性系切段置于2 L气升式反应器中进行通气、照光培养。在微重力和向光性的双重作用下, 海藻切段经过再生和扩繁, 形成适于反应器培养的球状藻落, 我们称其为微球体(microsphere)。
蜈蚣藻由单列细胞丝状体构成绒球状藻落。丝状体呈辐射状向外生长, 在悬浮培养条件下不形成 盘状体, 继续以丝状体形态扩繁(图3-1,3-2)。
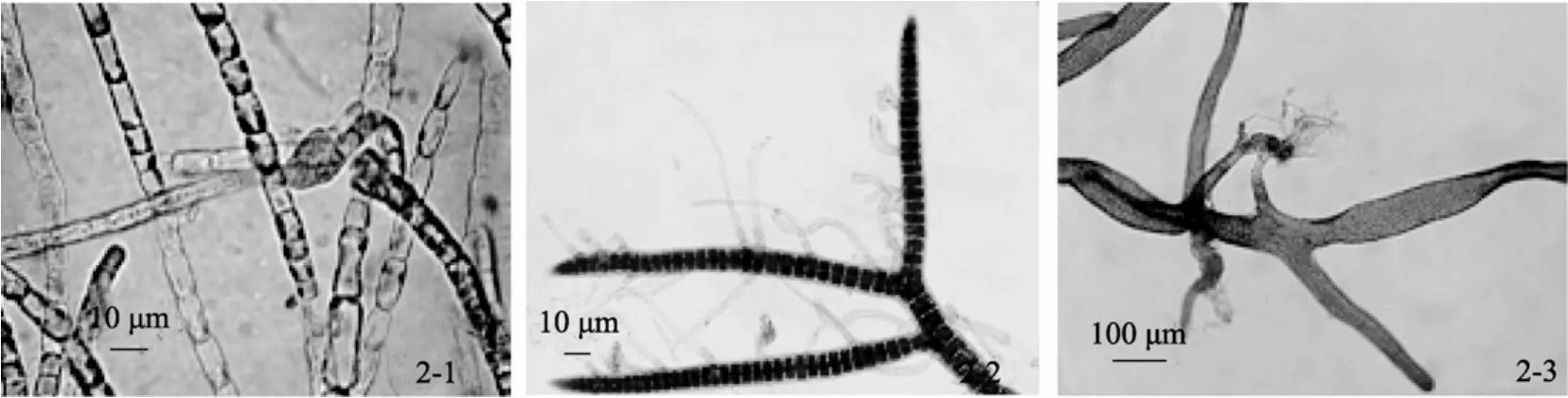
图2 3种海藻的丝状体无性系Fig. 2 Filaments of three macroalgae

图3 3种不同类型的海藻微球体Fig. 3 Three types of algal microspheres
多管藻无性系形成的微球体由多列细胞的假膜体构成。线状假膜体分枝交织成网状。藻体上虽然也长毛丝体, 但在悬浮培养条件下失去附着机会,因此不形成固着器, 成为可悬浮的微球体(图 3-3,3-4)。
孔石莼无性系的次生假根细胞具有全能性, 可以再生新的藻体, 在悬浮培养条件下形成球状藻落。这种由次生假根再生的藻体最初是由单列细胞组成的丝状体, 以后长成多列细胞的丝状体, 少数可以长成二层细胞的小叶状体。由于次生假根位于微球体中央, 藻体向外生长, 在悬浮培养时假根无法附着, 始终保持球状生长(图3-5, 3-6)。
根据其形态特点, 将蜈蚣藻的微球体称为绒球状微球体, 多管藻为网状微球体, 孔石莼为簇生状微球体。由于都具有再生能力, 可以将这些微球体剪碎培养, 大量扩增为新的微球体。
2.3 海藻微球体的生物反应器培养
在内导流气升式反应器中, 向中央导流筒中的通气管通空气, 在导流筒中形成带气泡的上升流,海藻微球体被水流从反应器底部带入导流筒, 上升至顶部后再从导流筒回到外部由反应器主体和导流筒间的环带中, 在湍流条件下沉降, 同时接受光照,充分吸收 CO2和营养盐, 然后再从底部进入中央导流筒。如此循环往复, 快速生长, 实现高密度培养。中央导流筒中通入空气可以同时向培养液中补充CO2, 同时培养液没有出现 O2过饱和, 不会抑制海藻的光合作用。
首先用体积为 2 L的气升式反应器培养孔石莼无性系切段, 长成微球体, 鲜质量为6.8 g。用消毒海水冲洗后将微球体置于10 L反应器中通气培养, 起始密度为0.68 g/L鲜质量, 初始温度在室温条件下, 培养过程中温度和 pH均有所上升,最高温度为26 ℃。每5 d测藻体鲜质量, 同时以新鲜培养液更换1/10的培养液, pH保持在9以下。培养25 d后, 藻体生物量达到3.04 g/L鲜质量, 为起始值的4.5倍。平均生长速率为0.094 g/(L⋅d)鲜质量, 在第10 天达到最大比生长速率, 为0.092/d。孔石莼微球体的生长曲线和比生长速率变化见图4。由图4可见, 在 10 L反应器表面入射光强为 112 μE/(m2·s), 光周期10: 14 LD, 24 h连续通气、通气量为0.3 m3/h的培养条件下, 孔石莼微球体在25 d内保持近似线性生长。
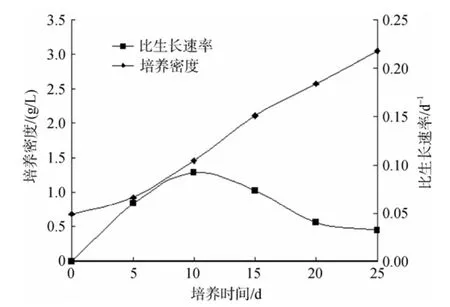
图4 孔石莼在10 L藻类生物反应器中的生长曲线Fig. 4 Growth curve forUlva pertusacultivated in 10 L airlift photobioreactor
在相同的培养条件下, 改变孔石莼微球体的接种密度, 获得生长速率、比生长速率与接种密度的关系(表1)。结果表明当初始接种密度为1.40 g/L鲜质量时, 用10 L反应器培养孔石莼微球体可获得最大生物量, 密度达到5.81 g/L鲜质量的密度, 最高生长速度达到 0.36 g/L/d鲜质量, 最大比生长速率为0.103/d, 经过16 d培养, 10 L反应器中的总生物量已由14.0 g鲜质量增加到58.1 g鲜质量, 达4.15倍。
3 讨论
传统的大型海藻育苗都是以孢子为起始材料。如果利用海藻比高等植物更强的细胞全能性, 就可以利用各种外植体, 从营养体构建无性系, 通过简单的切段, 在不加激素的条件下大量扩繁、并形成新的植株, 用于育种和育苗。继悬浮培养的紫菜丝状体、海带和裙带菜等的丝状配子体之后, 作者用3种海藻通过不同途径获得无性系, 再次证明了这种可能性。据报导, 一些具盘状体的红藻的切段也会产生可扩繁的丝状体, 同样可以建立无性系[13]。
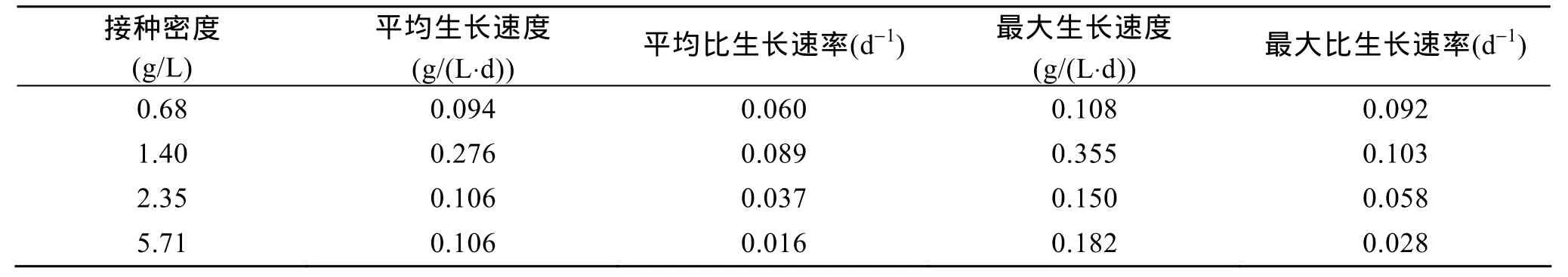
表1 接种密度对孔石莼微球体光生物反应器培养的影响Tab. 1 Effect of inoculation biomass density on growth rate for the microsphere ofUlva pertusacultivated in airlift photobioreactor
为了大规模培养海藻无性系, 需要构建生物反应器。Rorrer等[14]用不同类型的生物反应器对 4种海藻的小球状藻落进行培养, 认为气升式反应器是最合适的类型。但是, 常用于微生物培养的这类反应器结构复杂, 不适应于长时间无人值守运转。我们已将通气管改由顶部插入内导流筒, 不会发生氧气过饱和, 省略了止逆阀和脱氧装置, 只需用时间控制器对通气和光照时间进行控制, 反应器就可以在无人值守下长期自动运作。气升式反应器可以充分利用空间, 减少占地面积, 在较小的恒温室内进行集约化控温培养。气升式反应器易于放大, 作者已将反应器放大到100 L, 可以用于规模化培养。
海藻无性系切段在通气培养条件下形成微球体,由于失去附着生长的条件, 所以停留在这一发育阶段, 不断扩繁和生长, 长期不进入生活史循环。因此,高密度培养海藻无性系的气升式反应器又可作为一种反应工程模块, 用于构建水产养殖的水处理系统或生产饵料用海藻, 如孔石莼用于鲍鱼室内养殖。此外, 也可用于海藻天然产物生产。例如多管藻无性系常年高密度培养技术的建立为试剂级藻胆蛋白的生产创造了条件。中国学者已对多管藻的各种藻胆蛋白作过晶体结构解析[15], 而且已经证明其所含的三峰型 R藻红蛋白具有良好的稳定性和荧光特性, 比国际市场上的双峰型R藻红蛋白的性能更为优良。
[1] 周百成.我国的海水养殖业和海洋生物种苗业[C]//中国生物工程学会.中国生物技术产业发展报告(2003).北京: 化学工业出版社, 2004: 231-242.
[2] Tseng C K. The past, present and future of phycologyin China[J]. Hydrobiologia, 2004, 512: 1-3.
[3] 费修绠, 王素娟, 卢山.海洋生物技术[M].济南: 山东科学技术出版社, 1998: 7-26.
[4] 邹立红.坛紫菜丝状体增殖系的构建与生产应用[D].北京: 中国科学院研究生院, 2004: 53-69.
[5] 张栩, 李大棚, 蔡昭铃, 等.气升式光生物反应器培养裙带菜配子体的初步研究[J]. 海洋科学, 2002,26(6): 39-43.
[6] Porrello S, Lenzi M, Persia E, et al. Eutrophication by intensive aquaculture using a phytotreatment pond system. II. Nitrogen and phosphorus content in pond macroalgae and sediment[J]. Aquaculture, 2003, 219:531-544.
[7] Neori A, Chopin T, Troell M, et al.Integrated aquaculture: rationale, evolution and state of the art emphasizing seaweed biofiltration in modern mariculture[J].Aquaculture, 2004, 231: 361-391.
[8] 邵魁双, 王金霞, 周百成.孔石莼外植体再生及发育途径的研究[J].海洋科学, 2004, 28(6): 46-50.
[9] Shao K S, Wang J X, Zhou B C. Production and application of filaments fromGrateloupia turuturu(Halymenia Rhodophyta)[J]. J Appl Phycol, 2004, 16:431-437.
[10] 邵魁双.海藻无性系的构建[D].北京: 中国科学院研究生院, 2003: 42-55.
[11] Provasoli L. Media and prospects for the cultivation of marine algae[C]// Watanabe A, Hattori A. Culture and Collections of Algae. Tokyo: Jpn. Soc. Plant Physiol.,1968: 63-75.
[12] Chen Y C, Chiang Y M. Development of protoplasts fromGrateloupia sparsaandG. filicina(Halymeniaceae, Rhodophyta)[J]. Bot Mar, 1994. 37: 361-366.
[13] Iima M, Kinoshita T, Kawaguchi S, et al. Cultivation ofGrateloupia acuminata(Halymeniaceae, Rhodophyta)by regeneration from cut fragments of basal crusts and upright thalli[J]. J Appl Phycol, 1995, 7: 583-588.
[14] Rorrer G L, Cheney D P. Bioprocess engineering of cell and tissue cultures for marine seaweeds[J]. Aquacul Engineer, 2004, 32: 11-41.
[15] Chang W R, Jiang T, Wan Z L, et al.Crystal structure of R -phycoerythrin fromPolysiphonia urceolataat 2.8 Å resolution[J]. J Molecular Biol, 1996, 262: 721-722.
Received: Dec., 29, 2009
Key words:macroalgal clone; photobioreactor; microsphere; high-density cultivation
Abstract:Three macroalgal clones ofGrateloupia filicina,Polysiphonia urceolataandUlva pertusa, respectively,were obtained by the totipotency of marine algae. From them, three types of algal microspheres suitable for cultivation in a 10-L airlift photobioreactor were developed, which were flossy, netty and fascicular, respectively. The tufted microspheres ofU.pertusawere cultivated in the photobioreactor to the biomass density of 5.81 g/L FW L,with the maximum growth rate of 0.36 g/(L⋅d)FW and specific growth rate of 0.103 d−1. The technology of high-density culture of macroalgae in photobioreactor will have wide applications, including seeding, mass cultivation, integrate-aquaculture, and manufacture of bioactive products.
(本文编辑:谭雪静)
Studies on developments of microspheres from macroalgal clones and cultivations in airlift photobioreactor
WANG Jin-xia1,3, LI Ai-fen2, ZHOU Bai-cheng1
(1. Institute of Oceanology, the Chinese Academy of Science, Qingdao 266071, China; 2. Jinan University,Research Center of Hydrobiology, Guangzhou, 510632, China; 3. The Graduate School of the Chinese Academy of Sciences, Beijing 100039, China)
Q813.1, S968.4
A
1000-3096(2011)02-0017-05
2009-12-29;
2010-12-17
广东省高校水体富营养化与赤潮防治重点实验室开放基金资助项目(JN2010-2)
王金霞(1975-), 女, 山东青岛市人, 博士, 主要从事藻类光合作用与生物技术方面研究, E-mail: jx_wang2003@126.com

