红花黄色素对氧自由基引起人红细胞膜损伤的保护作用
周 璐,王媛凯,张立伟
(山西大学分子科学研究所,山西太原030006)
红花为菊科植物Carthamus tinctorius L.的干燥花瓣,为常用的活血化瘀中药。红花黄色素(SY)是红花活血作用的主要有效部位,能够改善心肌及脑组织微循环障碍,临床上被大量应用于冠心病和心绞痛的治疗[1]。羟基红花黄色素A(HSYA)和红花黄色素B(SYB)是SY中含量较高的查耳酮类成分,也是SY发挥药理作用的主要物质[2]。文献报道,HSYA具有保护心脑[3-4]和拮抗血小板激活因子受体的作用,可明显抑制血小板内游离钙离子浓度升高[5];SYB可明显抑制ADP诱导的大鼠体外血小板聚集率并可延长大鼠凝血时间[6]。近来研究发现HSYA具有一定的抗氧化作用,可清除羟自由基,抑制脂质过氧化反应[7]。为了探讨HSYA和SYB防治心血管疾病及抗氧化作用的机制,本文进行了HSYA和SYB对外源O2-.所致红细胞膜氧化损伤的保护作用的研究。
1 材料与方法
1.1 实验材料
1.1.1 药品与试剂 DPH探针(1,6-二苯基-1,3,5己三烯)为Sigma-Aldrich公司产品,以四氢呋喃配成2 mmol/L溶液,装入棕色瓶中置4℃冰箱中保存,临用前用PBS稀释成2×10-6mol/L;考马斯亮蓝试剂盒购自南京建成生物工程研究所;邻苯三酚购自天津市申泰化学试剂有限公司;维生素C为新乡市常乐制药有限公司生产;其他试剂均为国产分析纯。新鲜血液由山西大学校医院提供。PBS缓冲液(10 mM)的配制:NaCl 125 mM,KCl 2.7 mM,Na2HPO48 mM,KH2PO41.5 mM,glucose 10 mM,pH 7.4。
1.1.2 实验仪器 CR-22G型高速冷冻离心机(HITACHI公司);TGL-16M高速台式冷冻离心机(长沙湘仪离心机仪器有限公司);Cary-50Bio紫外可见分光光度计(美国瓦里安技术中国有限公司);荧光光度计LS-50B(PE公司)。
1.2 实验方法
1.2.1 药物的提取纯化 HSYA、SYB的提取纯化:红花干燥粉末,加30倍水60℃提取2次,每次45 min,合并提取液,滤过,50℃减压浓缩;将提取液过聚酰胺柱,水、30%乙醇、70%乙醇依次梯度洗脱,收集70%乙醇洗脱部分经制备液相纯化,得SYB纯品;收集30%乙醇洗脱部分再经反相柱材料MDS及制备液相纯化,得HSYA纯品。通过理化常数、化学方法及光谱数据(UV、IR、NMR、MS、CD 等)分析,鉴定了它们的结构为 HSYA[8]及 SYB[9]。
1.2.2 红细胞膜的制备 取新鲜健康人全血于1 000 r/min离心5 min,吸除上层白细胞及血小板,在洗净的红细胞中按照1∶40的比例加入预冷的5 mM pH
8.4 的PBS缓冲液,置于4℃冰箱中1 h,使之溶血。然后于4℃,15 000 r/min,离心30 min,离心后倾去离心管中的上层液体,下层品红色沉淀反复洗涤至无色,最后悬浮于5 mM pH 8.4的PBS缓冲液中。考马斯亮蓝法测膜蛋白含量,调蛋白浓度为400 mg/L。
1.2.3 氧化损伤红细胞膜的制备 取制备好的红细胞膜悬浮液,加入新鲜配制的邻苯三酚溶液(终浓度为0.5 mM),混匀后37℃水浴 10 min,立即用6倍10 mM pH 7.4的PBS缓冲液洗涤并在4℃15 000 r/min离心10 min,沉淀即为氧化损伤红细胞膜。
1.2.4 抗氧化损伤红细胞膜的制备 取制备好的红细胞膜悬浮液,加入不同浓度的HSYA和SYB,然后按“1.2.3”项下方法进行,沉淀即为抗氧化损伤红细胞膜。同时以加入VitC制备的抗氧化损伤红细胞膜作为阳性对照。
1.2.5 HSYA和SYB对人红细胞膜流动性的影响取已制备好的正常红细胞膜、氧化损伤红细胞膜和抗氧化损伤红细胞膜各1 mL,每组4管,分别加入含DPH 为 2 μM/L 的 PBS(10 mM,pH 7.4)溶液 3 mL 混匀,于37℃孵育30 min。离心除去DPH标记残液,用PBS(10 mM,pH 7.4)缓冲液洗涤1次,最后悬浮在 4 mL PBS(10 mM,pH 7.4)缓冲液中,采用荧光偏振法检测DPH荧光各向异性,激发波长为362 nm,发射波长为432 nm。荧光各向异性(r)根据公式(1)计算:

式中Iυυ和Iυh分别代表与激发偏振光振动方向平行、垂直时的荧光偏振度,G 为校正因子(G=Ihυ/Ihh)。
表观微黏度(η)根据公式(2)计算:

式中γ0为0.362。膜流动性用膜表观微黏度表示,γ值越大,η值越大,则膜流动性越小,反之亦然。
1.3 统计学方法
采用SPSS 11.5统计软件进行单因素方差分析并进行多组组间比较,所有数据均采用均数±标准差(x±s)表示。
2 结 果
HSYA和SYB对红细胞膜流动性的影响,结果见表1。
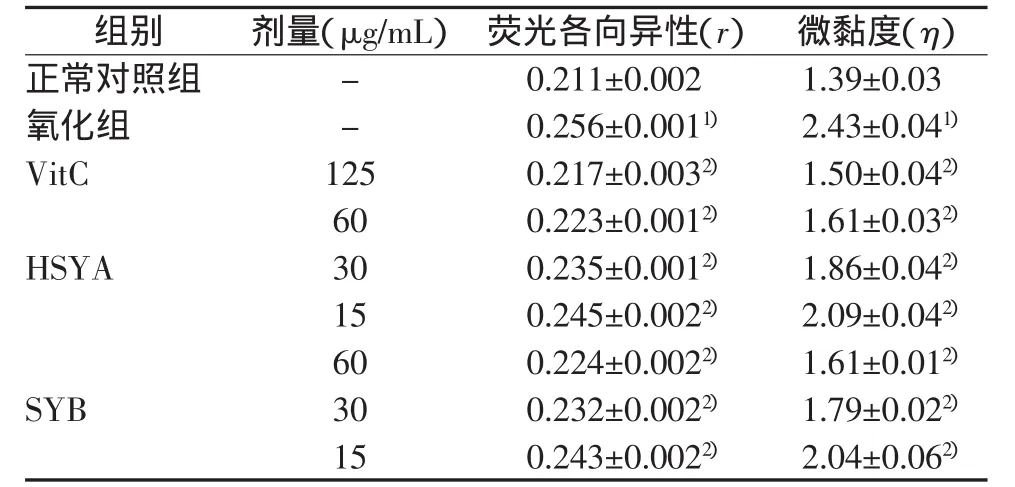
表1 HSYA和SYB对红细胞膜流动性的影响 (n=4)
由表1可见,氧化组与正常对照组比较,其荧光各向异性值明显增大(P<0.01),即表观微黏度值明显增大(P<0.01),红细胞膜流动性明显降低。而在膜制剂中预先分别加入了不同浓度的HSYA和SYB后再经邻苯三酚处理,其荧光各向异性值明显降低(P<0.01),表观微黏度明显下降(P<0.01),红细胞膜流动性明显增大,并且存在明显的剂量效应关系。
3 讨论
细胞膜流动性与细胞膜的能量转换、信息传递、物质交换等重要功能密切相关[10],适宜的膜脂流动性是维持生物膜正常功能的必要条件。大量事实证明,许多疾病与生物膜脂的流动性变化有关,如动脉粥样硬化、高血脂、糖尿病、遗传性球形红细胞增多症等患者的红细胞膜的膜脂流动性明显低于正常人[11]。
由于红细胞持续暴露于充足的氧分压环境中,富含与铁结合的血红蛋白,且膜中含有丰富的多不饱和脂肪酸,对氧化损伤较敏感,易导致膜结构的损伤和破坏,从而造成膜流动性的降低、红细胞刚性增加,影响微循环灌注。细胞膜过氧化反应在体内的进程很难掌控,故本文用邻苯三酚在碱性条件下自氧化产生的超氧阴离子自由基(O2-.)处理正常的和经过药物保护的红细胞膜,观察细胞膜流动性的变化。邻苯三酚在碱性(pH 8.4左右)条件下自氧化产生O2-.,O2-.寿命极短,可通过连锁反应产生羟自由基、单线态氧和过氧化氢,这些活性氧能直接或间接促使红细胞膜脂质过氧化,并导致膜流动性的降低[12]。
DPH是比较敏感的常用荧光探针,在水中荧光强度很低,当嵌入到膜脂疏水区内层时荧光强度可增加1 000倍。本实验用氧自由基攻击红细胞膜后,红细胞膜脂荧光各向异性值和表观微黏度值均明显上升,表明红细胞膜经氧自由基攻击后膜脂流动性下降。预先将红细胞膜与HSYA和SYB分别孵育,然后再用氧自由基进行攻击,红细胞膜的荧光各向异性值和表观微黏度值均呈现下降趋势,且存在剂量与效应关系,提示HSYA和SYB能阻止红细胞膜脂流动性的降低。本研究结果对进一步阐明红花改善微循环的作用机制,开发天然的心脑血管药物具有重要意义。
[1]李桂伟,刘新桥.红花黄色素治疗冠心病研究进展[J].中国中医急症,2010,19(9):1 570-1 572.
[2]杨红,魏宗德.红花黄色素与心血管疾病的研究进展[J].西南军医,2009,11(1):183-185.
[3]金鸣,董宁宁,吴伟,等.羟基红花黄色素A缓解大鼠心肌细胞凋亡作用的研究[J].中草药,2009,40(6):924-930.
[4]Wei X B,Liu H Q,Sun X,et al.Hydroxysafflor yellow A protects rat brains against ischemia-reperfusion injury by antioxidant action[J].Neuroscience Letter,2005,386(1):58-62.
[5]臧宝霞,金鸣,司南,等.羟基红花黄色素A对血小板活化因子的拮抗作用[J].药学学报,2002,37(9):696-699.
[6]贾菲菲,柴秋彦,贾俊,等.红花黄色素B抗凝作用研究[J].山西中医学院学报,2009,10(3):13-15.
[7]金鸣,李金荣,吴伟.羟基红花黄色素A抗氧化作用的研究[J].中草药,2004,35(6):665-666.
[8]Meselhy M R,Kadota S,Momose Y,et al.Two new quinochalcone yellowpigmentsfromCarthamustinctoriusandCa2+antagonisticactivity of tinctorius[J].J Chem Pharm Bull,1993,41(10):1 796-1 802.
[9]Takahashi Y,Satio K,Yanagiya M,et al.Chemical constitution of safflor yellow B,a quinochalcone C-glycoside from the flower petals of Carthamus tinctorius L[J].Tet Lett,1984,25(23):2 471.
[10]温筱煦,刘蔚,邓锡军.刺五加提取物的总黄酮含量测定及其对血液流变学的影响[J].解放军药学学报,2006,22(3):197-199.
[11]卢新华,关章顺,何军山.马齿苋总黄酮对氧自由基引发人红细胞膜损伤的保护作用[J].中国药学杂志,2004,39(8):587-589.
[12]王辉,周立,刘刚.莲心碱对氧自由基引发红细胞膜损伤的保护作用[J].中国药理学通报,2006,22(9):1 088-1 091.

