蛇床子素减轻 A25-35诱导的大鼠学习记忆减退及海马神经元结构损伤
龚其海,石京山,杨丹莉
(遵义医学院 药理学教研室,贵州遵义563000)
蛇床子素(osthole,Ost)又名甲氧基欧芹酚或欧芹酚甲醚,是最先从伞形科植物中提取分离出的天然香豆素类化合物,存在于多属植物中,目前已知至少在15个属如蛇床属、当归属等中存在[1]。现代药理研究发现,蛇床子素在中枢神经系统具有抗缺血性脑损伤、延缓衰老、镇静、镇痛、抗惊厥及抗帕金森病等作用[2]。采用东莨菪碱诱导的记忆获得减退模型、亚硝酸钠诱导记忆巩固障碍模型、乙醇诱导记忆再现障碍模型及三氯化铝诱导的急性衰老模型,发现蛇床子素可明显改善记忆获得和巩固障碍以及方向辨别障碍[2]。离体研究发现,蛇床子素可抑制 -淀粉样蛋白25-35片段(beta-amyloid protein fragment 25-35,A25-35)的神经毒性作用[3]。然而,蛇床子素对整体条件下A25-35诱导的大鼠学习记忆减退及海马神经元结构损伤是否存在影响尚不清楚。因此,本研究探索了蛇床子素对大鼠侧脑室注射A25-35所致的学习记忆减退及海马神经元结构损伤的作用,旨在为其用于老年痴呆的治疗提供基础药理学依据。
1 材料与方法
1.1 药品、试剂和仪器 蛇床子素(纯度:98.6%),购置于南京泽朗医药科技有限公司;盐酸多奈哌齐片,购置于陕西方舟制药有限公司,规格:5mg×12片,批号:国药准字 H20030583;A25-35,购自 Sigma公司;Morris水迷宫,成都泰盟科技有限公司产品。
1.2 实验动物、分组及处理 清洁级雄性SD大鼠40只,3~4月龄,体重300~350g,由第三军医大学实验动物中心提供,合格证书号渝SCXK 2007-0005。实验条件下适应性喂养1wk后,随机均分为4组,即假手术组、模型组、阳性药组及蛇床子素组,每组10只。阳性药组及蛇床子素组分别灌胃盐酸多奈哌齐片1.0 mg/kg、蛇床子素40 mg/kg,假手术组、模型组灌胃等体积的生理盐水(normal saline,NS),每日1次,连续18d。
1.3 A25-35孵育 无菌NS将A25-35稀释成2g/L,37℃孵育4d,使其变为聚集态的A25-35,增加毒性。
1.4 动物模型的制备 给药后3d进行进行手术制模,其操作按照本研究组既往研究进行[4]。待动物清醒后继续给药,并监测其体重。
1.5 Morris水迷宫实验 制模后10d行Morris水迷宫检测[5]。Morris水迷宫检测共5d,前4d为定向航行实验,5d为空间探索实验,具体操作按照本研究组既往方法进行[4,5]。大鼠成绩以逃避潜伏期及校正逃避潜伏期表示,逃避潜伏期越长,大鼠学习功能越差。校正逃避潜伏期为大鼠跨原安全岛所在象限的搜索时间/120×100%。校正逃避潜伏期值越大,表明大鼠的记忆越好。每日9:00和15:00各检测1次,入水点可以更改,每日的成绩以上下午的均值表示。
1.6 海马神经元形态学观察 水迷宫测试完毕后,每组随机抽取3只大鼠用于透射电镜观察海马 CA1区的超微结构,取材及操作按文献进行[4,5]。
1.7 统计学处理 实验数据用SPSS 12.0统计软件处理,各项指标采用均数±标准差(± )表示,多组间数据比较使用one-way ANOVA检验(方差齐使用LSD法,方差不齐使用Dunnett'T3法)。<0.05为有统计学意义。
2 结果
2.1 蛇床子素对A25-35所致大鼠学习记忆减退的影响 分组时及术前各组大鼠的体重未见差异,术后1~2d各组大鼠进食量较少,体重增长缓慢甚至降低,但2d后体重又逐渐增加,至实验结束时各组大鼠体重未见显著性差异。术后10d开始采用Morris水迷宫检测大鼠的空间记忆能力。在前4d的定向航行实验中,1~2d各组大鼠的平均逃避潜伏期未见差异,3~4d模型组大鼠的平均逃避潜伏期较正常对照组明显延长(均<0.01),然而,3~4d阳性药组及蛇床子素组大鼠的平均逃避潜伏期较模型组明显缩短(分别<0.01)。见图1A。5d进行了空间探索实验,发现模型组大鼠的校正逃避潜伏期较正常对照组明显减少(<0.01),然而,阳性药组及蛇床子素组大鼠的校正逃避潜伏期较模型组明显增大(均<0.01)。见图1B。
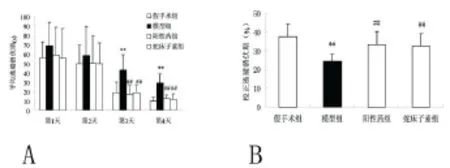
图1 蛇床子素对A25-35所致大鼠学习记忆功能减退的影响
2.2 蛇床子素对A25-35所致大鼠海马CA1区神经元超微结构改变的影响 超微结构观察发现,假手术组大鼠海马CA1区神经元胞核较大,呈卵圆形或圆形,染色质分布均匀,线粒体及粗面内质网结构清楚,核糖体丰富(图2A)。与此相反,模型组大鼠海马CA1区神经元胞核不规则,染色质聚集,核周间隙明显增宽,线粒体肿胀或呈空泡状,粗面内质网肿胀,细胞器明显减少,核糖体稀疏 (图2B)。与模型组比较,阳性药组海马CA1区神经元损伤程度有所减轻,大多数核染色质分布较均匀,线粒体及粗面内质网结构较清楚,核糖体较丰富,核周间隙明显较模型组明显变窄,细胞器增多(图2C)。蛇床子素组海马CA1区神经元损伤程度与阳性药组相似,大多数核染色质分布较均匀,线粒体轻微肿胀,线粒体及粗面内质网结构较清楚,核糖体较为丰富,核周间隙明显较模型组变窄,细胞器较多(图2D)。这些结果表明蛇床子素能够减轻A25-35诱导的大鼠海马神经元超微结构损伤。
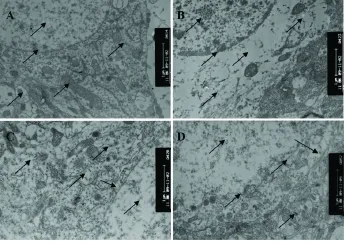
图2 蛇床子素对A25-35所致大鼠海马CA1区神经元超微结构改变的影响
3 讨论
学习记忆功能减退是阿尔茨海默病(Alzheimer'sdisease,AD)早期的主要症状[6],且A 在AD发病过程中起着核心作用[7]。本研究在注射A25-35后第10天观察了大鼠的学习记忆功能,发现大鼠在定向航行实验中的平均逃避潜伏期较假手术组明显延长,在空间探索实验中的的校正逃避潜伏期明显缩短,表明A注射后大鼠出现了学习记忆功能减退。单次侧脑室注射A 后最早可在术后8d出现学习记忆减退[8],然后维持2~3wk。本研究在单次侧脑室注射A25-35后,大鼠第12天出现了学习记忆减退,与报道一致。海马是学习记忆的中枢,其CA1区对各种伤害刺激其最为敏感。因此,本研究观察了海马CA1区的神经元的超微结构,结果与其行为学结果一致,A 注射后,大鼠海马CA1区神经元的超微结构受到明显破坏。
本研究的主要目的在于观察蛇床子素对侧脑室注射A25-35诱导的学习记忆减退及神经元超微结构损伤的影响,结果与阳性药多奈哌齐一致,蛇床子素在定向航行实验明显缩短大鼠的平均逃避潜伏期,在空间探索实验中明显延长大鼠的校正逃避潜伏。超微结构的观察结果与行为学结果一致,蛇床子素明显减轻了大鼠海马CA1区神经元的超微结构损伤,除了线粒体仅仅有轻微的水肿外,其余超微结构已处于正常水平。多奈哌齐是一种经典的胆碱酯酶抑制剂,为目前治疗AD的首选药,本研究所用其剂量为有效剂量[9]。受试药蛇床子素尽管也仅为一个剂量,但已有研究表明该剂量在防治中枢神经系统疾病中为有效剂量[10]。非常有趣的是,蛇床子素产生了与多奈哌齐相似的改善A25-35所致的学习记忆减退及神经元超微结构损伤的作用,这表明蛇床子素不仅在离体条件下抑制A25-35的神经毒性作用[3],而且在整体条件下对A25-35所致的神经毒性同样有效,提示蛇床子素在防治AD方面存在良好的临床应用前景。
总之,本研究表明蛇床子素可减轻A25-35诱导的大鼠学习记忆减退及海马神经元结构损伤,为进一步将其用于AD的开发研究提供了基础药理学依据,其作用机制有待下一步研究。
[1]马玉明.蛇床子素的药理进展及剂型开发[J].中国现代药物应用,2008,2(15):112-114.
[2]龚其海,杨丹莉,李菲,等.蛇床子素:防治中枢神经系统疾病的新希望[J].遵义医学院学报,2011,34(1):83-87.
[3]程淑意,陈云波,王奇,等.蛇床子素对A25-35诱导的星形胶质细胞NF-B活化机制的影响[J].广州中医药大学学报,2010,27(1)36-39,101.
[4]GONG QH,PAN LL,LIU XH,et al.S-propargylcysteine(ZYZ-802),a sulphur-containing amino acid,attenuates beta-amyloid-induced cognitive deficits and pro-inflammatory response:involvement of ERK1/2 and NF-B pathway in rats[J].Amino Acids,2011,40(2):601-610.
[5]GONG QH,WANG Q,PAN LL,et al.Hydrogen sulfide attenuates lipopolysaccharide-induced cognitive impairment:A pro-inflammatory pathway in rats[J].Pharmacol Biochem Behav,2010,96(1):52-58.
[6]KASKIE B,STORANDT M.Visuospatial deficit in dementia of the Alzheimer type[J].Arch Neurol,1995,52(4):422-425.
[7]HARDY J,SELKOE DJ.The amyloid hypothesis of Alzheimer's disease:p rogress and problems on the road to therapeutics[J].Science,2002,297(5580):353-356.
[8]BAUNE BT,WIEDE F,BRAUN A,et al.Cognitive dysfunction in mice deficient for TNF-and its receptors[J].AmJ Med Genet BNeuropsychiatr Genet,2008,147B(7):1056-1064.
[9]HANSEN RA,GARTLEHNER G,WEBB AP,et al.Efficacy and safety of donepezil,galantamine,and rivastigmine for the treatment of Alzheimer's disease:a systematic review and meta-analysis[J].Clin Interv Aging,2008,3(2):211-225.
[10]CHAO X,ZHOU J,CHEN T,et al.Neuroprotective effect of osthole against acute ischemic stroke on middle cerebral ischemia occlusion in rats[J].Brain Res,2010,1363:206-211.

