Cripto-1高表达以及E-cadherin低表达与晚期胃癌转移有关
王烯冬,德 力,陈 珂,陈 峰,张 飞,高小平
(内蒙古自治区人民医院普外二科,呼和浩特 010017)
Cripto-1可作为细胞膜表面受体接受多种信号刺激,是重要的癌基因生长因子,参与致癌、癌细胞的增殖和转移。研究发现,Cripto-1基因在许多实体瘤中过度表达[1-3],而正常组织表达极低或者不表达,但国内目前对此基因研究甚少。体外实验证明,Cripto-1作为重要的癌基因生长因子,在肿瘤细胞迁移、上皮-间质转化(epithelial-mesenchymal transition,EMT)、分支形态的发生以及促进肿瘤血管形成等方面发挥着重要的作用[4,5]。EMT是胚胎发生、慢性炎症和纤维化以及肿瘤进展中的一个重要过程,以上皮细胞极性的丧失及其间质特性的获得为主要特征。近年来,EMT被提出同样参与了肿瘤侵袭与转移的过程,而其最重要的特征之一表现为钙黏蛋白(E-cadherin)的缺失[6,7]。E-cadherin 的表达下调和基因突变时,可导致细胞黏附力的降低、移动力加强和发生侵袭。这些研究表明,Cripto-1与E-cadherin在肿瘤侵袭转移过程中发挥作用及可能存在内在联系。
在本研究中,联合检测了Cripto-1与E-cadherin在胃癌组织中的表达情况,以探讨两者与肿瘤侵袭转移可能发挥的作用。
1 材料与方法
1.1 组织标本与临床资料 选用2005年1月至2010年12月期间内蒙古自治区人民医院收治的75例胃癌患者标本,所有标本均经病理检查证实。患者平均年龄58岁(27~80岁)。选用的病例有完整的基本资料统计,如肿瘤分化等级、肿瘤浸润深度、淋巴结转移情况、肝脏转移情况及TNM分期。除了75例原发性胃癌,选取配对的切除的断端作为正常胃黏膜对照标本。
1.2 免疫组织化学染色免疫组化技术采用EnVision二步法。鼠抗人的单克隆抗体 Cripto-1(1∶100,R&D 公司)或鼠抗人的单克隆抗体E-cadherin(1∶100,Zymed公司)4℃孵育过夜;滴加二抗,室温孵育30 min;二氨基联苯胺(diaminobenzidine,DAB)显色。
Cripto-1或E-cadherin阳性染色为淡黄色、棕黄色或棕褐色。阳性细胞数>20%的为免疫组化Cripto-1表达阳性。而阳性细胞数>60%,且定位于细胞膜的为E-cadherin表达阳性(E-cad+);相反,<60%阳性细胞定位于细胞膜或定位于细胞质的为E-cadherin表达下调(E-cad-)。
1.3 统计学方法 采用SPSS 12.0进行统计分析,Cripto-1或E-cadherin的表达与临床病理学特征的关系采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 Cripto-1及E-cadherin在胃癌组织及正常胃黏膜中的表达情况 在正常胃黏膜中,Cripto-1在细胞质中有弱表达。与正常组织相比,Cripto-1在肿瘤细胞质(48%,36/75)中高表达(图 1和图 2)。与Cripto-1的表达不同,E-cadherin在肿瘤组织中的表达呈不均一性的特点(图4),68%(51/75)的肿瘤细胞膜表现为E-cadherin的完全性或不完全性缺失表达。部分肿瘤细胞质中出现E-cadherin的表达。而在正常组织中,E-cadherin有细胞膜呈高表达(图3)。

图1 Cripto-1在正常胃黏膜中呈细胞质弱表达(×100)

图2 Cripto-1在胃癌细胞质呈高表达(×400)
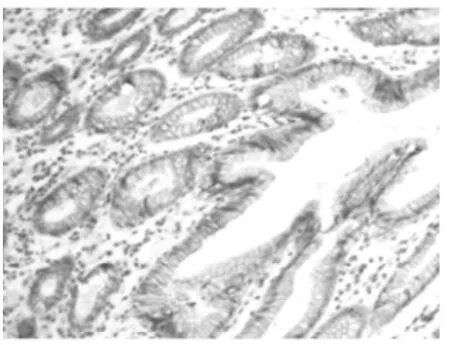
图3 E-cadherin在正常胃黏膜中呈细胞膜高表达(×100)
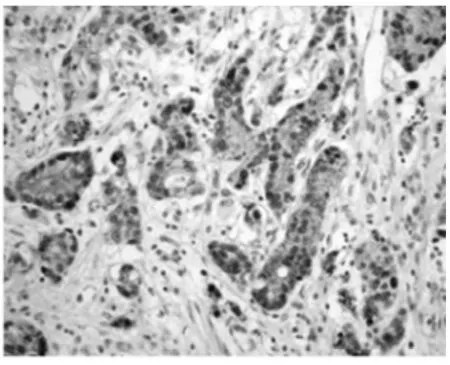
图4 E-cadherin在胃癌细胞膜呈不均一性表达(×400)
2.2 Cripto-1及E-cadherin的表达情况与临床病理特征的关系 由表1显示了Cripto-1和 E-cadherin与临床病理特征的相关性分析结果。统计结果发现,Cripto-1高表达与远处转移(P=0.028)以及TNM分期(P=0.025)有关。而E-cadherin缺失表达则与淋巴结转移(P=0.010)、以及TNM分期(P=0.022)有关。联合分析Cripto-1和E-cadherin在胃癌组织中的表达情况,将75例患者分为以下三组:①同时Cripto-1低表达和E-cadherin高表达(Cripto-1-/E-cadherin+,n=14);②Cripto-1+/E-cadherin+或Cripto-1-/E-cadherin-(n=35);③Cripto-1+/E-cadherin-(n=26)。统计结果显示,Cripto-1+/E-cadherin-的肿瘤与淋巴结转移(P=0.014)、远处转移(P=0.028)以及 TNM 期(P=0.007)相关性更强(表2)。
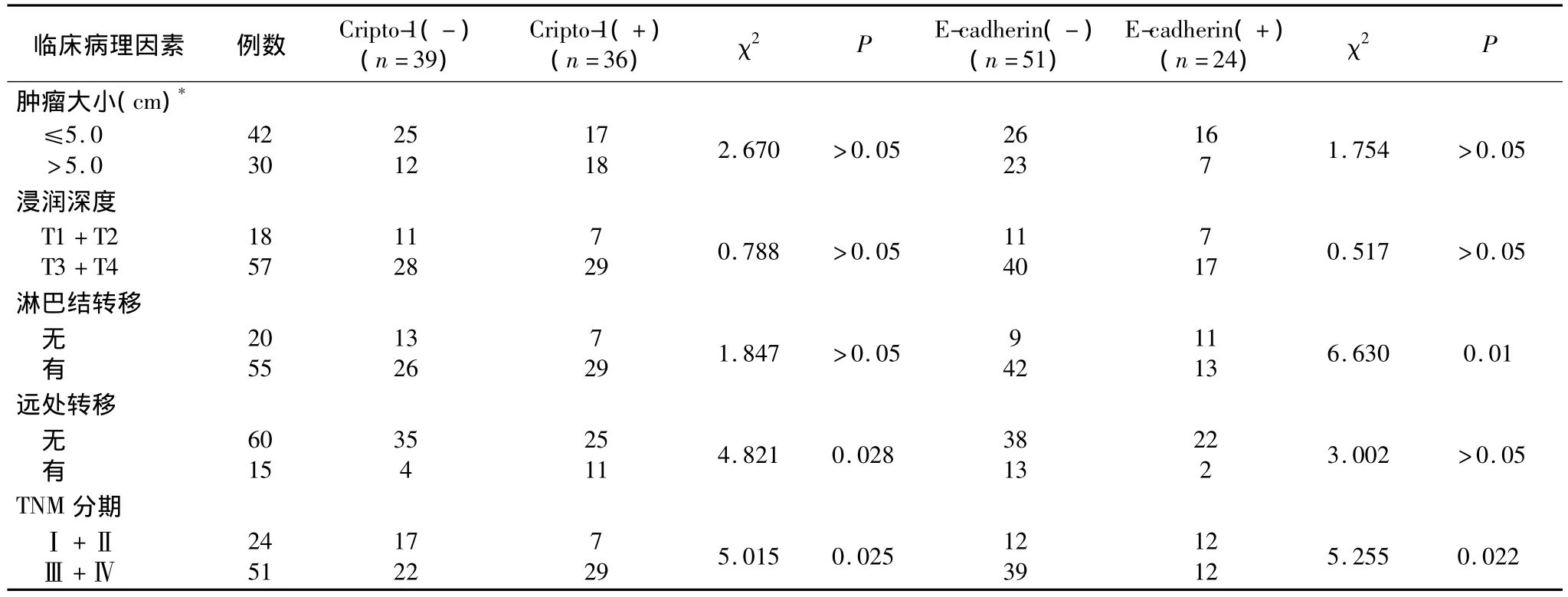
表1 75例胃癌患者Cripto-1及E-cadherin表达与临床病理因素的关系
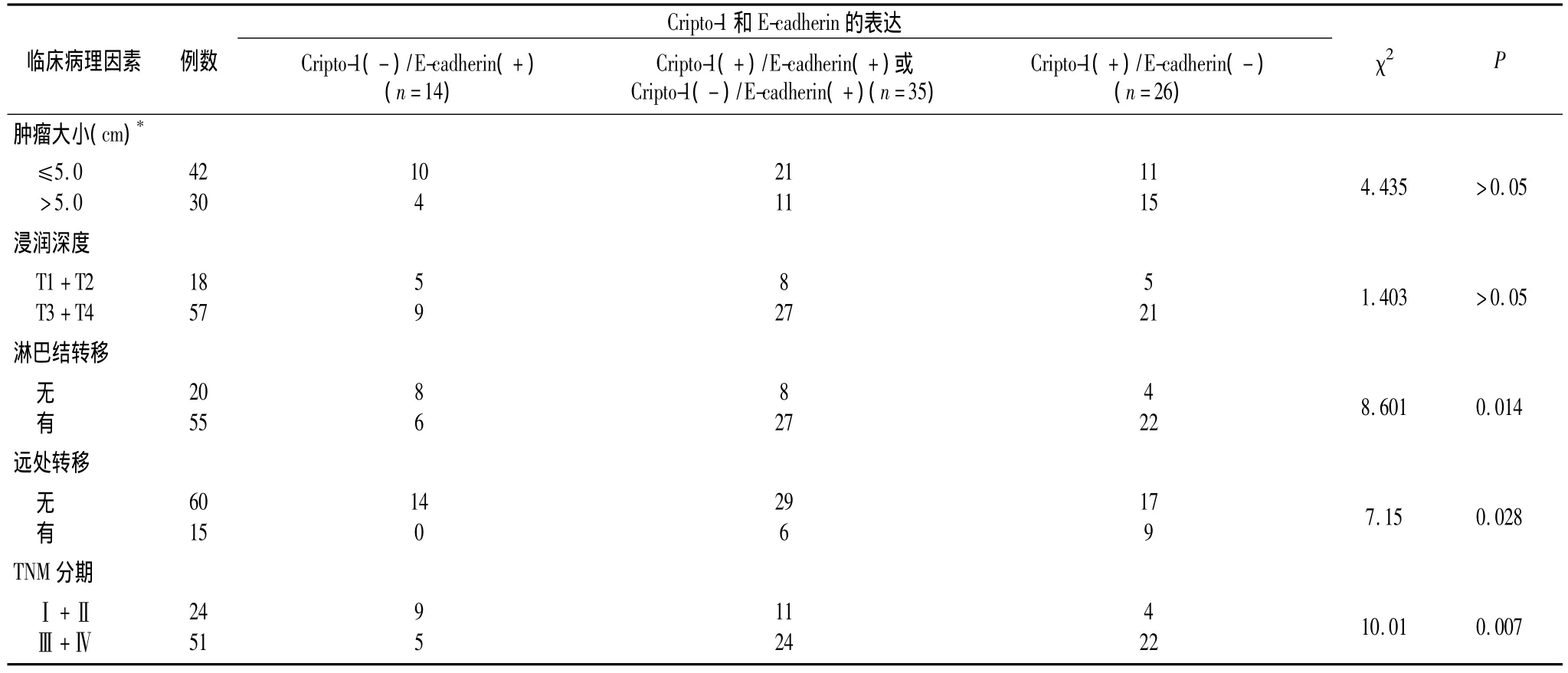
表2 联合分析75例胃癌患者Cripto-1及E-cadherin表达与临床病理因素的关系
3 讨论
Cripto-1是一种自分泌型肿瘤生长因子,是表皮生长因子(epidermal growth factor,EGF)家族重要成员之一,是一个具有多功能的信号分子蛋白,参与调节了多种信号转导通路,从而在促进细胞转化以及肿瘤发生发展方面上发挥着重要的作用[8,9]。体内/外实验证明,Cripto-1在多种肿瘤中发挥着潜在癌基因的作用[1,10,11]。E-cadherin 是肿瘤转移和扩散的抑制性分子,普遍存在于各种上皮细胞中起着介导同种细胞黏附和维持正常细胞形态完整性的作用。E-cadherin的下调或缺失使其不能与细胞质内β-catenin形成复合物,从而不能与细胞骨架肌动蛋白相连,导致细胞易于由原发病灶脱落移动到邻近组织及血管、淋巴管,发生局部浸润和远处转移。
EMT是从具有极性的上皮细胞转换成具有活动能力的细胞的一个正常的生理学过程,表现为上皮细胞失去极性,与周围细胞和基质的接触减少,细胞黏附力下降,迁移和运动能力增加,同时细胞表型发生改变,表现出具有移行能力的间质细胞的特性。Cripto-1可作为细胞膜表面受体,间接参与EMT相关的信号通路蛋白的上调[12]。研究发现,当β-catenin的酪氨酸磷酸化后即与E-cadherin-β-catenin复合体分离,由于E-cadherin失去与β-catenin的锚连接而形成一种“活动”形式,因而从细胞内连接处重分布到别的区域,失去黏附功能,导致细胞分散增加,移动力加强,肿瘤细胞运动能力提高,增强其侵袭力。而Cripto-1高表达的细胞可以抑制β-catenin的酪氨酸磷酸化,E-cadherin-β-catenin复合体不能分离,从而游离 E-cadherin 减少[13,14]。
由本研究结果可以假设,Cripto-1高表达的同时E-cadherin的下调在肿瘤侵袭转移中发挥着重要的作用。本研究结果也显示,与Cripto-1-/E-cad+的胃癌组相比,Cripto-1+/E-cadherin-的胃癌组的侵袭性更加明显。由此,Cripto-1的上调同时E-cadherin的下调可能在促进肿瘤侵袭转移方面发挥协同作用,但有关的作用机制有待进一步的研究。根据本实验结果显示,联合检测Cripto-1和E-cadherin的表达可能更好地分析胃癌转移情况,具体情况需要更深一步的研究证实。
[1] Wu Z,Li G,Wu L,et al.Cripto-1 overexpression is involved in the tumorigenesis of nasopharyngeal carcinoma[J].BMC Cancer,2009,9:315.
[2] Hong SP,Lee EK,Park JY,et al.Cripto-1 overexpression is involved in the tumorigenesis of gastric-type and pancreatobiliarytype intraductal papillary mucinous neoplasms of the pancreas[J].Oncol Rep,2009,21(1):19-24.
[3] Sun Y,Strizzi L,Raafat A,et al.Overexpression of human Cripto-1 in transgenic mice delays mammary gland development and differentiation and induces mammary tumorigenesis[J].Am J Pathol,2005,167(2):585-597.
[4] Watanabe K,Meyer MJ,Strizzi L,et al.Cripto-1 is a cell surface marker for a tumorigenic,undifferentiated subpopulation in human embryonal carcinoma cells[J].Stem Cells,2010,28(8):1303-1314.
[5] de Castro NP,Rangel MC,Nagaoka T,et al.Cripto-1:an embryonic gene that promotes tumorigenesis[J].Future Oncol,2010,6(7):1127-1142.
[6] Chao YL,Shepard CR,Wells A.Breast carcinoma cells re-express E-cadherin during mesenchymal to epithelial reverting transition[J].Mol Cancer,2010,9:179.
[7] Gravdal K,Halvorsen OJ,Haukaas SA,et al.A switch from E-cadherin to N-cadherin expression indicates epithelial to mesenchymal transition and is of strong and independent importance for the progress of prostate cancer[J].Clin Cancer Res,2007,13(23):7003-7011.
[8] Hamada S,Watanabe K,Hirota M,et al.beta-Catenin/TCF/LEF regulate expression of the short form human Cripto-1[J].Biochem Biophys Res Commun,2007,355(1):240-244.
[9] Harrison CA,Gray PC,Vale WW,et al.Antagonists of activin signaling:mechanisms and potential biological applications[J].Trends Endocrinol Metab,2005,16(2):73-78.
[10] Strizzi L,Bianco C,Normanno N,et al.Cripto-1:a multifunctional modulator during embryogenesis and oncogenesis[J].Oncogene,2005,24(37):5731-5741.
[11] Strizzi L,Postovit LM,Margaryan NV,et al.Emerging roles of nodal and Cripto-1:from embryogenesis to breast cancer progression[J].Breast Dis,2008,29:91-103.
[12] Strizzi L,Bianco C,Normanno N,et al.Epithelial mesenchymal transition is a characteristic of hyperplasias and tumors in mammary gland from MMTV-Cripto-1 transgenic mice[J].J Cell Physiol,2004,201(2):266-276.
[13] Saloman DS,Bianco C,Ebert AD,et al.The EGF-CFC family:novel epidermal growth factor-related proteins in development and cancer[J].Endocr Relat Cancer,2000,7(4):199-226.
[14] Howard S,Deroo T,Fujita Y,et al.A positive role of cadherin in Wnt/β-catenin signalling during epithelial-mesenchymal transition[J].PLoS One,2011,6(8):e23899.

