静脉注射骨髓基质细胞对大鼠局灶性脑缺血区域ICAM-1表达的影响
范 斌, 何志义
脑梗死发病率,致残率高,且近年来呈逐渐上升的趋势。目前除成人卒中急性期溶栓治疗外,其他治疗都局限于支持治疗,不能阻断脑损伤的发生或诱导脑组织的再生。近年来的研究证明骨髓基质细胞(bone marrow stromal cells,BMSCs)作为一种非造血干细胞,具有自我更新、多向分化潜能,在特定的条件下能够向神经细胞分化,分泌多种神经生长因子、保护因子,具有神经保护作用[1]。本实验拟采用骨髓基质细胞治疗大鼠局限性脑缺血,并观察对大鼠细胞间粘附分子-1(intercellular adhesion molecule-1,ICAM-1)的表达影响。
1 材料与方法
1.1 实验动物与分组 清洁级,2月龄,Wistar大鼠45只(由中国医科大学动物部提供),体重280~300g雌雄不限,随机将大鼠分为正常对照组、盐水对照组、股静脉注射骨髓基质细胞组,每组动物15只,每组又随机分为缺血再灌注3d、7d、14d 3个亚组,每组动物5只。另取1只Wistar大鼠,用于骨髓基质细胞分离培养,在实验过程中对动物的处理符合动物伦理学标准。小鼠抗 BrdU,兔抗大鼠ICAM-1抗体,生物素标记羊抗兔IgG抗体,生物素标记羊抗小鼠抗体(武汉博士德公司);显微照相仪(Olypus BX,51,Japan);图像处理软件包(Metamorph imagin system V4.6,USA)。
1.2 大脑中动脉闭塞(MCAO)模型制作 采用改良Longa栓线法。以10%水合氯醛(3.5ml/kg)腹腔麻醉大鼠,做颈部正中切口,分离左颈总动脉后穿一根4号缝线,继续分离颈内、颈外动脉,结扎颈总、颈外动脉,用动脉夹夹闭颈总动脉远心端,在其动脉夹远端和结扎之间用1ml注射针头将颈总动脉扎一小眼,将事先准备好的鱼线穿人(鱼线为5cm长,在2.0cm处做一标记,尖端用砂纸磨光滑),松开动脉夹,调整鱼线的角度和方向插入颈内动脉,测量鱼线尾侧距离动脉分叉处的距离,便可知插入的深度(应为1.8~2.0cm),用缝线将鱼线固定。全部大鼠统一采用栓死左侧大脑中动脉并于梗死后1h再灌注。
1.3 骨髓基质细胞的分离培养及BrdU标记取2个月龄Wistar大鼠1只,腹腔注射5-氟尿嘧啶(150m/kg),杀死部分外周血细胞,促进骨髓增殖,48h后将大鼠处死,无菌条件下,取股骨、胫骨用FBS液清洗干净,除去股骨近端和胫骨远端,除去另一端骨垢,用大号针头在骨端生长面开一个小孔,用注射器将DMEM-LG培养液注入,收集冲洗出来的骨髓,打散组织成为细胞悬液,离心用DMEM-LG培养液重新悬浮沉淀的细胞,吹散后计数,按1×107接种于10%FBSw完全培养基的75cm2培养瓶中,于37℃5%二氧化碳及饱和温度下培养。24h后换液去除未贴壁细胞。以后每3d换液1次,20d左右待后代培养的细胞增殖到80%时胰酶消化传代,取第8代之前的细胞,在接种前1d以终浓度0.1mmol/L的溴脱氧尿苷(bromodeoxyuridine BrdU)标记。接种时,制成单细胞悬液,细胞密度3×106/ml。
1.4 骨髓基质细胞移植 在大鼠栓塞24h,大鼠随机分组,治疗组(n=15)每只大鼠股静脉注射1ml 3×109的骨髓基质细胞;盐水对照组(n=15)每只大鼠股静脉注射1ml的生理盐水;正常对照组(n=15)每只大鼠栓塞24h。
1.5 免疫细胞化学方法鉴定骨髓基质细胞用0.2%胰酶消化传代培养的骨髓基质细胞使之成为单细胞悬液,接种于盖玻片上培养过夜。次日用4%多聚甲醛固定20min,滴加血清封闭液10min,滴加一抗 CD34,CD44,CD106,37℃,60min,滴加生物素标记第二抗体37℃,10min,滴加链霉素抗生物素蛋白过氧化酶37℃,20min,DAB显色,苏木素轻度复染,脱水透明封片镜检。
1.6 神经功能损害评分 采用Chen等[2]报道的神经功能损害评分表(Neurological Severity Scores,NSS),分别于移植前,移植后 3、7、14d 进行神经功能缺陷评分。分值越高代表损伤越重,评分8~12的大鼠纳入实验。
1.7 免疫组化染色 大鼠麻醉后(量同前),剑突下剪开充分暴露心脏,6号输液器刺入左心室,剪开右心耳,输入250ml生理盐水,之后输入250ml 4%多聚甲醛固定。然后断头取脑,脑组织去掉额极和尾极,放在固定液中储存3d,以备做免疫组化分析。免疫组化采用SABC法。试剂来自武汉博士德公司。取出鼠脑切片,常规脱蜡脱水,新鲜配置3%H2O2室温10min,切片浸0.01mol/L枸橼酸盐缓冲液,微波炉加热至沸腾断电,间隔5min,甩去多余液体。一抗为兔抗大鼠ICAM-1单克隆抗体及兔抗大鼠BrdU抗体,工作浓度(1∶100),购于武汉博士德公司,二抗为生物素化山羊抗兔IgG,按说明逐步操作。切片在显微照相仪下照相(Olypus BX,51,Japan),由图像处理软件包量化(Metamorph imagin system V4.6,USA)。照相部位取梗死周围皮质。
2 结果
2.1 静脉移植骨髓基质细胞后 骨髓基质细胞可在缺血半球大量存活,在対侧半球也有少量存活。BrdU免疫组织化学染色结果提示,在梗死半球可见大量BrdU阳性细胞,绝大部分分布在梗死灶周围,対侧半球也可见少量BrdU阳性细胞。
2.2 静脉移植骨髓基质细胞显著改善大鼠神经功能评分 造模后3、7、14d分别对各组大鼠进行神经功能损伤评分并进行统计学分析,结果发现正常对照组及生理盐水组在各时间点,大鼠神经功能评分无显著性差异(P>0.05),骨髓基质细胞移植组在各时间点,神经功能评分均显著低于正常对照组及生理盐水组(P<0.05)。并且组内比较,在14d骨髓基质细胞移植组神经功能评分显著低于同组3d及7d的神经功能评分(P<0.05)(见表1)。
2.3 静脉移植骨髓基质细胞显著抑制梗死区ICAM-1的表达 缺血后,正常对照组及生理盐水组ICAM-1蛋白表达水平显著升高,但在缺血后各时间点,两组间无显著性差异(P>0.05)。骨髓基质细胞组ICAM-1表达水平经方差分析在缺血后3d、7d较正常对照组及生理盐水组显著降低(P<0.05)。14d较对照组及生理盐水组无显著性差异(P>0.05)(见表2、图2)。

表1 静脉注射BMSCs对MACO大鼠神经功能缺陷评分的影响

表2 免疫组化检测术后不同时间点ICAM-1的表达(平均灰度值)
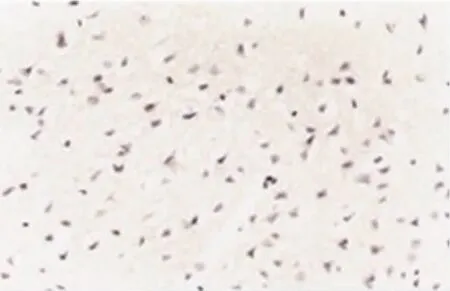
图1 梗死半球BrdU阳性细胞(×400)
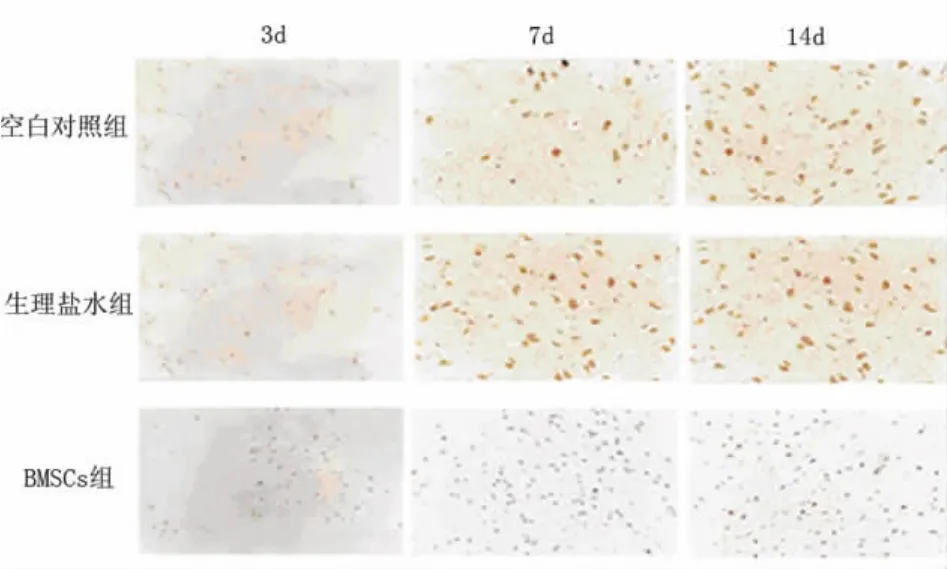
图2 免疫组化检测术后不同时间点ICAM-1的表达(×400)
3 讨论
我们的研究结果提示,骨髓基质细胞可通过股静脉进入缺血的脑组织中,这些移植的骨髓基质细胞可以存活,绝大部分分布在梗死灶内及周边带并在对侧大脑半球及纹状体有少量表达。并可以显著改善脑梗死所造成的神经功能缺损,最重要的是我们的研究首次发现静脉移植骨髓基质细胞可以显著抑制ICAM-1的表达。
MSCs是骨髓内造血干细胞以外的非造血干细胞,通常也被称作骨髓间质干细胞、骨髓祖细胞等。MSCs在体外和体内具有多向分化潜能。特定诱导环境下MSCs可以向骨、软骨、心肌、神经元等多胚层方向分化[3]。在合适的培养条件下MSC可以在体外长期传代、大量扩增,而细胞生物学特性没有明显改变。
我们的实验中用免疫化学方法鉴定骨髓基质细胞,结果:CD34(-);CD44(+);CD106(-);CD34是造血细胞特异性标志,主要分布于T B细胞,单核细胞及前体细胞的表面,骨髓基质细胞没有表达。CD44及CD106在骨髓来源的骨髓基质细胞及造血干细胞均阳性表达,因此骨髓基质细胞的特征为CD34(-);CD44(+);CD106(+)。
我们的结果提示静脉移植骨髓基质细胞后,骨髓基质细胞可在缺血半球大量存活,在对侧半球也有少量存活。局灶性脑缺血时,由于血脑屏障的破坏,可能有助于MSCs选择性迁入缺血脑区。此外,缺血脑组织的炎症等缺血相关信号也可能诱导和促进MSCs的迁移。Wang等[4]研究发现,单核细胞趋化因子(MCP-1)水平有助于MSc向缺血脑组织迁移。
本研究表明通过静脉注射骨髓基质细胞可以显著改善脑梗死所造成的神经功能缺损。那么是什么机制或因素使移植的骨髓基质细胞改善大脑的神经功能,降低脑梗死的体积?目前考虑可能的作用机制为:(1)骨髓基质细胞渗透至缺血脑组织部位,替代受损的神经元细胞,重塑神经传导通路。(2)传导通路的重建并不是神经功能恢复的必要条件,更合理的解释是移植的骨髓基质细胞除可以分泌NGF、VEGF、BDNF、bFGF、HGF、CSF-1 等多种生长因子;还可分泌 IL-6、IL-7、IL-8、IL-11、IL-12、IL-14、IL-15等重要的细胞因子[5];骨髓基质细胞还可以合成胶原蛋白、纤维连接蛋白、层粘蛋白等细胞外基质[6,7]。这些神经营养和保护因子可能通过不同的机制,在半暗区起着神经保护作用,减少神经元凋亡。近年来的大量研究证明脑梗死是一个炎性反应的过程,对脑内炎症反应及其干预措施的研究成为脑梗死病理、生理和防治研究的热点。白细胞的黏附在缺血/再灌注损伤中起重要作用,在此过程中细胞间粘附分子-1(ICAM-1)起核心作用,因此在本研究中,我们检测了静脉移植骨髓基质细胞对ICAM-1表达的影响。ICAM-1属免疫球蛋白超家族成员,在体内分布较广。在正常情况下ICAM-1在脑组织中仅有少量表达,在脑组织受损如缺血、创伤及炎症时,在内毒素及一些细胞因子,如白介素-1(IL-1)、肿瘤坏死因子-α(TNF-α)、γ-干扰素等刺激下,其表达明显升高[8]。ICAM-1和其配体白细胞功能相关抗原LFA-1结合后能够介导白细胞与靶细胞黏附,促使白细胞向缺血区聚集和浸润,这些聚集和浸润的白细胞不仅能够直接阻断微血管,而且还能产生缩血管物质,引起血管收缩,降低血流量加重脑缺血,同时还可以释放自由基、蛋白水解酶等细胞毒性物质,导致缺血细胞进一步损伤[9,10]。最近,Soriano等[11]发现,能表达ICAM-1的野生型小鼠脑组织梗死体积是不能表达ICAM-1的纯合子小鼠脑组织梗死体积的5.6~7.8倍。应用ICAM-1抗体亦能证实ICAM-1和白细胞在缺血脑损伤中的作用。Zhang等[12]观察了大鼠短暂性大脑中动脉闭塞时缺血区ICAM-1单克隆抗体的作用。结果表明,应用ICAM-1抗体组梗死体积较对照组缩小41%,白细胞的数量也显著减少。缺血早期应用ICAM-1抗体治疗还可以延长(t-PA)溶栓治疗的时间窗。这说明ICAM-1是介导缺血再灌注损伤的关键因子,抑制其异常表达,可以有效的阻断白细胞和血管内皮细胞间的粘附过程,从而减轻再灌注的损伤程度。
本研究发现生理盐水组与正常对照组之间,缺血后各时间点均见ICAM-1表达明显上调,但两组间无显著性差异。这与 Vemuganti等[13]的研究相一致,说明脑梗死后存在炎症反应。注射骨髓基质细胞组ICAM-1的表达水平经方差分析在3d、7d较对照组和生理盐水组显著降低。说明通过静脉移植骨髓基质细胞可以显著抑制ICAM-1的表达,从而阻断细胞间的粘附,改善缺血再灌注损伤的程度,达到保护脑组织,治疗脑梗死的目的。
ICAM-1的表达是可以诱导的。核转录因子NF-κB、IL-1、TNF-α 可以诱导 ICAM-1 的表达[14~16]。我们推测静脉移植骨髓基质细胞可以改善脑缺血局部的微环境,抑制炎症反应的发生,从而抑制ICAM-1的表达。这值得进一步研究。
综上所述,我们的研究结果提示:静脉注射骨髓基质细胞治疗大鼠局限性脑梗死,可以改善大鼠神经功能评分,降低脑梗死体积,抑制ICAM-1的表达,从而保护脑神经细胞,减轻缺血再灌注的损害。为更好的应用于临床还有以下问题需进一步研究:(1)经静脉注射的骨髓基质细胞迁移入脑内的方式途径及其分子机制,如何提高骨髓基质细胞进入脑内的数量。(2)骨髓基质细胞移植是否也存在治疗时间窗。(3)骨髓基质细胞移植治疗局灶性脑缺血的生物安全性,有必要进行广泛、深入的基础研究。总之静脉移植骨髓基质细胞治疗大鼠局限性脑梗死可能为临床治疗缺血性脑梗死开辟了一条新的途径。
[1] Sachez-Ramos J,Song S,Cardozo-Pelaez F,et al.Adult bone marrow stromal cells differentiate into neural cells in vitro[J].Experimental Neu-rology,2000,164(2):247 -256.
[2] Chen J,Li Y,Wang L,et al.Therapeutic benefit of intravenous administration of bone marrow stromal cells after cerebral ischemia in rat[J].Stroke,2001,32(4):1005 -1011.
[3] Kopen GC,Prockop DJ,Phinney DG.Marrow stromal cells migrate throughout forbrain and cerebellum,and they differentiate into astrocytes after injection into neonatal mouse brains[J].Proc Natl Acad Sci,1999,96(19):10711 -10716.
[4] Wang L,Li Y,Chen J,et al.Ischemic cerebral tissue and MCP-I enhance rat bone marrow stromal cell migration in interface culture.Exp Iematol[J].2002,30(4):831 - 836.
[5] Dormady SP,Bashayan O,Dougherty R,et al.Immortalized multipotential mesenchymal cells and the hematopoietic microenvironment[J].Hematother Stem Cell Res,2001,10(1):125 -140.
[6] 宋玉成,刘永海,张尊成,等.骨髓基质细胞源干细胞对大鼠局灶性脑缺血神经细胞凋亡及相关蛋白表达的动态影像[J].中风与神经疾病杂志,2005,22(4):319 -322.
[7] 咎 坤,刘永海,崔桂云,等.骨髓基质源神经干细胞对血管性痴呆大鼠行为及血管内皮生长因子蛋白表达的影响[J].中风与神经疾病杂志,2010,27(6):499 -502.
[8] Sobel RA,Mttchell ME,Fondren G.Intercellular adhesion molecule-1(ICAM-1)in cellular immune reactions in the humancentral nervous system[J].Am Pathol,1990,136(6):1309 -1316.
[9] Zoppo GT,Schinid-Schonbein GW,Mori E,et al.Poly-morphonuclear leukocyte occlude capillaries following middle cerebral artery occlude and reperfusion in baboons[J].Stroke,1991,22(10):1276 - 1283.
[10] Harlan JM.Leukocyte-endothelial interactions[J].Blood,1985,65(3):513-525.
[11] Soriano SG,Lipton SA,Wang YF,et al.Intercellular adhesion molecule-1-deficient mice are less susceptible to cerebral ischemia-reperfusion injury[J].Ann Neurol,1996,39(5):618 -624.
[12] Zhang RL,Chopp M,Jiang N,et al.Anti-intercellular adhesion molecule-1 antibody reduce ischemic cell damage after transient but not permanent middle cerebral artery occlusion in the Wistar rat[J].Stroke,1995,26(8):1438 -1442.
[13] Vemuganti R,Dempscy RJ,Bowen KK.Inhibition of intercellular adhesion molecule-1 protein expression by antisense oligonucleotides is neuroprotective after transient middle cerebral artery occlusion in rat[J].Stroke,2004,35(1):179 - 184.
[14] Galeae,Santizo R,Feinstein DL,et al.Estrogen inhibits NF kappa B-dependent inflammation in brain endothelium without interfering with Ikappa B degradation[J].Neuroreport,2002,13(11):1469 -1472.
[15] Shibata M,Kumar SR,Amar A,et al.Anti-inflammatory,antithrombotic,and neuroprotective effects of activated protein C in a murine model of facal ischemic stroke[J].Circulation,2001,103(13):1799-1805.
[16] Wang GJ,Deng HY,Maier CM,et al.Mild hypothermia reduces ICAM-1 expression,neutrophil infiltration and microglia monocyte accumulation following experimental stroke[J].Neuroscience,2002,114(4):1081 -1890.

