草豆蔻总黄酮抗氧化活性研究
吴珍,陈永顺,王启斌
(湖北医药学院附属太和医院1.消化内科;2.药学部,湖北十堰442000)
草豆蔻主要化学成分为黄酮类和挥发油。草豆蔻总黄酮具有健胃、止吐、抑制血小板聚集和肿瘤形成、抗炎抑菌等药理作用[1-3]。笔者在本实验中研究草豆蔻总黄酮的体内外抗氧化活性,并与茶多酚的抗氧化性能比较,以期为深入开发应用该药提供实验依据。
1 材料
1.1 试药与仪器草豆蔻药材(购自湖北省十堰市宏康药材公司,批号:20100215,经我院中药房鉴定为姜科山姜属植物草豆蔻种子),二苯代苦味酰肼自由基(2,2 diphenyl-1-picrylhydrazyl,DPPH,Sigma公司),茶多酚(湖北武汉浩河化工厂,纯度≥98.8%,批号:20090621),番红花红(温州市瓯海精细化工公司,批号:20090317),维生素E(浙江新和成股份公司,批号:20100106),D-半乳糖(上海试剂厂,批号:F20090108),超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒(上海超研生物科技有限公司,批号:20090230),丙二醛(malondialdehyde,MDA)测定试剂盒(上海超研生物科技有限公司,批号:20090407)。其余试剂均为国产分析纯。
1.2 动物SPF级昆明种小鼠,雌雄各半,体质量(20±2.0)g,湖北医药学院实验动物中心提供,动物合格证号:SCYY(鄂)2004-0012。
2 方法与结果
2.1 草豆蔻总黄酮的提取[4]精密称取草豆蔻粉末200 g,过内径0.600 mm(30目)筛,用8倍量95%乙醇回流提取两次,每次2 h,提取液减压浓缩至含醇量约10%,抽滤,除去杂质,加60%乙醇定容至100 mL,作为供试品溶液,备用。经测定,总黄酮含量为6.82%。
2.2 统计学方法数据使用SPSS11.5软件进行统计分析,结果以均数±标准差±s)表示,组间比较采用t检验。
2.3 体外抗氧化实验
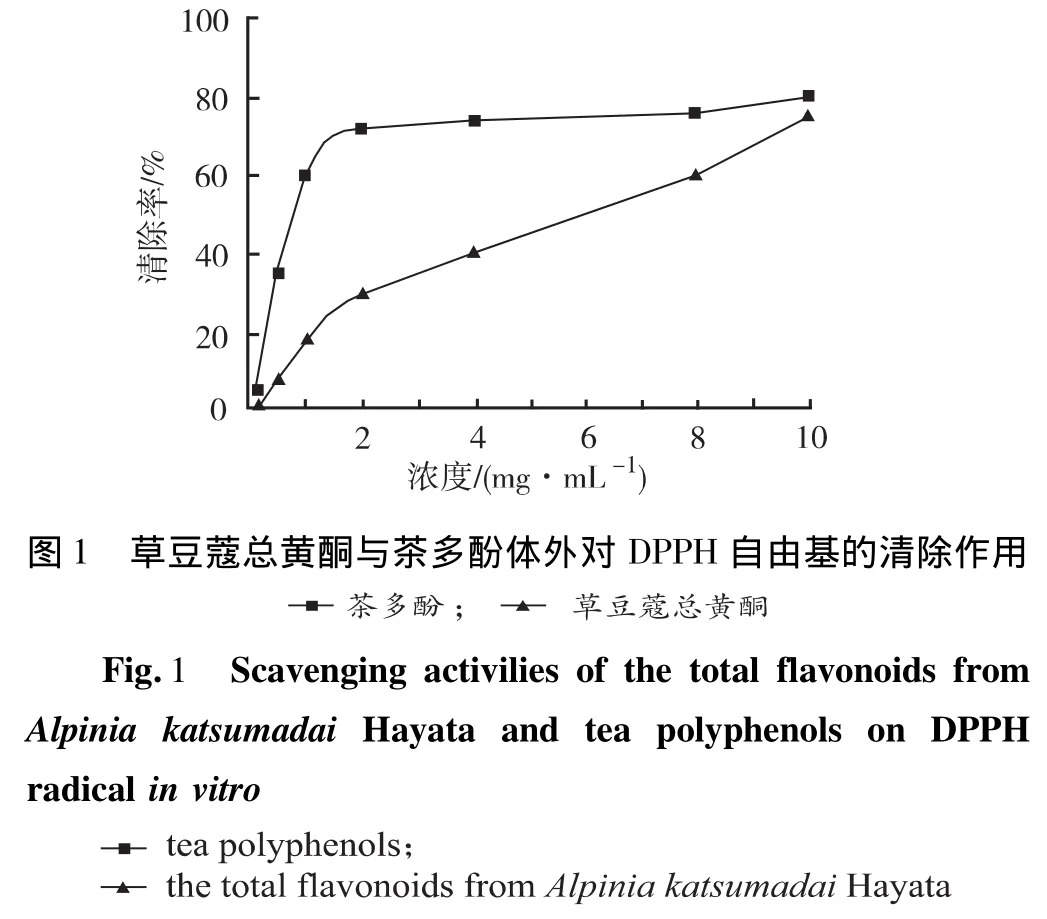
2.3.1 DPPH法DPPH是一种较为稳定的自由基,其乙醇溶液呈紫色,在517 nm波长处有吸收峰。测试时分别以50%乙醇将茶多酚、草豆蔻总黄酮提取液配制成相应浓度。按文献[5]方法测定,分别在517 nm波长处测定不同浓度样品2 mL加DPPH 2 mL的吸光度(Ai),不同浓度草豆蔻总黄酮样品2 mL加50%乙醇2 mL的吸光度(Aj),50%乙醇2 mL加DPPH2 mL的吸收光度(A0)。实验平行3次,草豆蔻总黄酮样品及对照品分别测8个浓度,以50%乙醇作为空白。草豆蔻总黄酮样品对DPPH自由基的清除能力(SA)可采用以下公式计算:SA(%)=[1-(Ai-Aj)]/A0×100%。结果见图1。
草豆蔻总黄酮与茶多酚对DPPH自由基都表现出明显的清除活性,清除作用随浓度的增加而增强,茶多酚对DPPH自由基的清除能力强于草豆蔻总黄酮,当浓度达到10 mg·mL-1时,两者对DPPH自由基的清除能力相近,最大清除率可达78%。
2.3.2 草豆蔻总黄酮清除羟自由基活性测定[6]采用Fe(Ⅱ)催化过氧化氢(H2O2)产生羟自由基(Fenton反应),该反应产生的羟自由基可使番红花红褪色。针对这一特点来研究草豆蔻总黄酮对羟自由基的清除能力。取0.15 mol·L-1pH7.4的磷酸盐缓冲溶液1.0 mL,40 μg·L-1番红花红1.0 mL,0.945 mmol·L-1乙二胺四乙酸(EDTA)-Fe(Ⅱ)(新鲜配制)1.0 mL,不同浓度的样品溶液0.5 mL、3%H2O21.0 mL(新鲜配制),混合后在37℃水浴中反应30 min后在520 nm波长处测定吸光度(As)。空白组以纯化水0.5 mL代替样品测定吸光度(A0),对照组以纯化水1.5 mL代替H2O2和样品测定吸光度(A),用纯化水3.5 mL代替番红花红、EDTA-Fe(Ⅱ)、H2O2、样品,磷酸盐缓冲溶液1.0 mL,调零。并按下式计算清除率:清除率(%)=(As-A0)/(A-A0)×100%,结果见图2。
当草豆蔻总黄酮的浓度≥0.8 mg·mL-1时,清除率达到最大,最大清除率为88.5%,而此时茶多酚的清除率为58.5%,表明同浓度时,草豆蔻总黄酮对羟自由基的清除活性强于茶多酚。

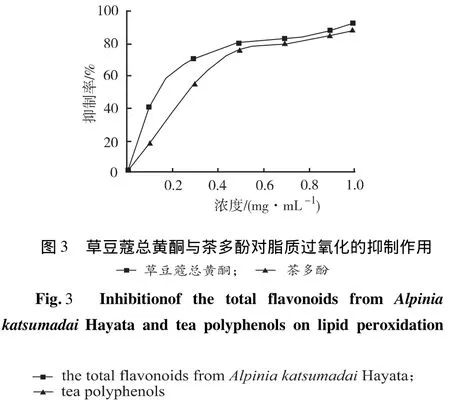
2.3.3 抑制脂质过氧化活性测定取大豆卵磷脂溶液0.5 mL(大豆卵磷脂200 mg溶解于10 mmol·L-1pH7.4磷酸盐30 mL,冰浴震荡),加入pH7.14磷酸盐缓冲液1.0 mL,不同浓度的样品溶液1 mL,2.5 mmol·L-1EDTA-Fe(Ⅱ)1.0 mL,混匀后于37℃水浴中反应45 min,再加入28%三氯乙酸(trichloroacetic acid,TCA)2.0 mL,1%硫代巴比妥钠(thiobar bituric acid,TBA)1.0 mL,混匀后置于100℃沸水浴中加热10 min,冷却后在532 nm波长处测定吸光度(A样),用磷酸盐缓冲液调零,空白管用磷酸盐缓冲液代替样品测吸光度(A0)。并按下式计算抑制率:抑制率(%)=(A0-A样)/A0×100%。从图3中可以看出,草豆蔻总黄酮与茶多酚对卵磷脂过氧化物的抑制作用相近,浓度≥1.0 mg·mL-1时,草豆蔻总黄酮的最大抑制率91.5%。
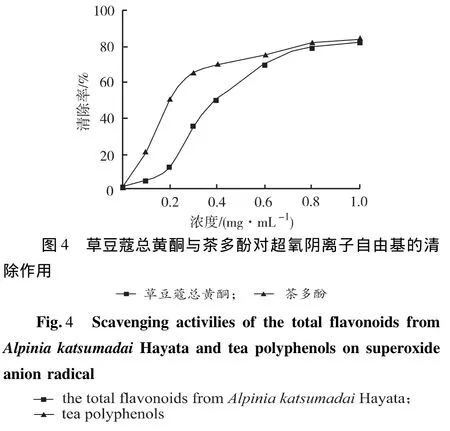
2.3.4 清除超氧阴离子自由基活性测定[7]取0.05 mol·L-1三羟甲基氨基甲烷-盐酸缓冲液(pH=8.2)4.5 mL,置于25℃水浴中预热20 min,分别加入试样1 mL和25 mmol·L-1邻苯三酚溶液0.4 mL,混匀后于25℃水浴中反应5 min,加入8 mmol·L-1盐酸(HCl)1 mL终止反应,于299 nm处测定吸光度(Ai),每个试样做3个平行样,行统计学处理。空白对照组以相同体积纯化水代替样品。清除率(%)=(A0-A样)/A0×100%。结果见图4,随着浓度的增加,草豆蔻总黄酮与茶多酚对超氧阴离子自由基的清除能力也增强,当两者浓度≥1.0 mg·mL-1时,草豆蔻总黄酮的清除率为79.8%,茶多酚的清除率为80.8%,表明两者对超氧阴离子自由基的清除能力相近。
2.4 体内抗氧化实验
2.4.1 造模与给药将小鼠随机分成6组,每组6只,分别为正常对照组,衰老模型组,维生素E组,草豆蔻总黄酮低、中、高剂量组。除正常对照组外,其余5组小鼠均按100 mg·kg-1·d-1皮下注射D-半乳糖造模,正常对照组皮下注射等体积0.9%氯化钠溶液。造模同时给药治疗,维生素E组按0.05 g·kg-1·d-1灌胃给药,草豆蔻总黄酮低、中、高剂量组分别按相当于生药材20,40,60 g·kg-1·d-1灌胃给药,正常对照组和衰老模型组给予等体积纯化水,连续42 d。
2.4.2 样品的处理小鼠摘眼球取血,抗凝剂抗凝后2 500 r·min-1离心10 min(离心半径175 mm),取上清液冰箱冷藏备用;动物处死后迅速取出肝组织块,用冰0.9%氯化钠溶液洗涤除去血液,滤纸拭干,分别称取0.2~0.3 g加入0.9%氯化钠溶液(0.9%氯化钠溶液体积总量是组织块质量的9倍),制成10%肝组织匀浆,3 000 r·min-1离心10 min(离心半径175 mm),取上清液,置冰箱内冷藏备用。用时稀释。
2.4.3 主要检测指标血浆SOD活力及肝匀浆中MDA含量均依据试剂盒所附方法、步骤进行测定,并计算结果。草豆蔻总黄酮中、高剂量组血浆SOD活性明显升高(P<0.01),肝脏MDA含量显著降低(P<0.01),结果见表1。提示草豆蔻总黄酮在体内具有较好的抗氧化活性。
3 讨论
笔者在本实验中以常用的且具有较强抗氧化能力的茶多酚为对照,考察了草豆蔻总黄酮对羟自由基、脂质过氧化物及超氧阴离子自由基的清除能力,结果提示草豆蔻总黄酮具有较强的抗氧化能力,且抗氧化作用随浓度的增加逐渐增强。本实验以SOD及MDA这两个指标来评价草豆蔻总黄酮体内的抗氧化活性,结果表明其可显著提高血浆SOD活性,同时降低肝脏中MDA含量,提示其体内具有较好的抗氧化活性。
表1 6组小鼠血清SOD活性及肝脏MDA含量测定结果Tab.1Effects of the total flavonoids from Alpinia katsumadai Hayata and tea polyphenols on the serum levels of SOD activity and MDA content in liver homogenate of aging mice in 6 groups±s
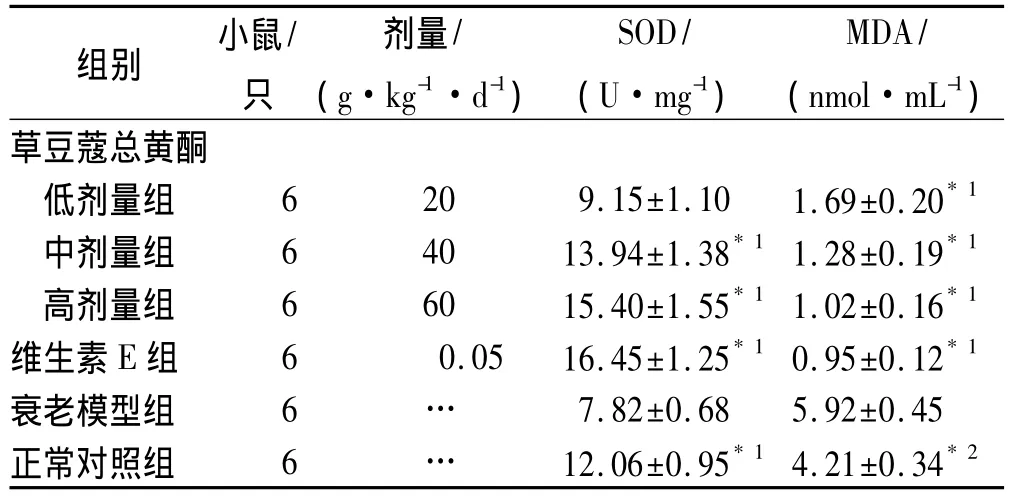
表1 6组小鼠血清SOD活性及肝脏MDA含量测定结果Tab.1Effects of the total flavonoids from Alpinia katsumadai Hayata and tea polyphenols on the serum levels of SOD activity and MDA content in liver homogenate of aging mice in 6 groups±s
与衰老模型组比较,*1P<0.01,*2P<0.05Compared with aging model group,*1P<0.01,*2P<0.05
?
黄酮类化合物主要通过酚羟基与自由基进行抽氢反应生成稳定的半醌自由基,从而中断链式反应,达到抗氧化作用,且高效低毒[8]。本研究提示草豆蔻总黄酮具有较强的抗氧化活性,但其活性成分有待进一步研究。
[1]金宏,赵文英,公衍玲.草豆蔻的质量标准研究[J].医药导报,2009,28(3):354-356.
[2]李元圆,桂新,杨莉,等.草豆蔻药材质量控制方法研究[J].中国中药杂志,2010,35(16):2091-2094.
[3]毕培曦,江润祥,吴德邻.姜科药用植物的化学、药理和经济用途-(五)草豆蔻[J].中药材,1999,11(6):44-45.
[4]王秀芹,李教社,杨孝江,等.草豆蔻中山姜素和小豆蔻明提取工艺的优选[J].中药材,2005,28(4):338-339.
[5]CHANG W C,SEI C K,SOON S H,et al.Antioxidant activity and free radical scavenging capacity between korean medicinal plants and flavonoids by assay-guided comparison[J].Plant Science,2002,163(6):1161-1168.
[6]项明志,刘红梅,贝玉祥,等.诃子多糖的提取及其抗氧化活性研究[J].云南中医中药杂志,2009,30(2):46.
[7]单承莺,任红荣,何海玲,等.毛胶蓣多糖的体外抗氧化活性研究[J].食品与发酵工业,2009,35(12):86-89.
[8]张东庆,吴守林,张丽表,等.植物黄酮在抑制亚硝化反应中的应用[J].医药导报,2009,28(6):733-734.

