CAV1基因沉默增强MCF-7多细胞球对多柔比星的敏感性
顾栋桦 平金良 董吉顺 朱荣 陈琦
1. 浙江省湖州市中心医院病理科,浙江 湖州 313000;2. 复旦大学上海医学院病理学系,上海 200032
肿瘤化疗耐药是导致肿瘤治疗失败的重要原因,因此深入了解肿瘤耐药的机制是提高肿瘤临床化疗疗效的重要基础。细胞质膜微囊蛋白-1 (caveolin-1,CAV1)是细胞质膜微囊的主要功能蛋白,能与细胞膜上许多生物活性蛋白结合并调节细胞的生命活动,也与肿瘤细胞的耐药相关[1-2]。本研究以体外三维培养的MCF-7多细胞球作为模型,运用RNA干扰技术沉默CAV1基因的表达,观察MCF-7多细胞球对多柔比星耐药性,并对其机制作初步的探讨。
1 材料与方法
1.1 乳腺癌MCF-7细胞单层培养
乳腺癌MCF-7细胞株购于中国科学院细胞资源中心,细胞在37 ℃、CO2体积分数为5%、饱和湿度的条件下用含10%胎牛血清的RPMI-1640培养基(Gibco公司,美国)培养。
1.2 MCF-7多细胞球模型的建立
按细胞三维培养方法(liquid overlay technique)获得MCF-7多细胞球:首先用无血清培养液RPMI-1640溶解稀释琼脂糖至1.5%浓度,灭菌后在细胞培养皿上铺一浅层,冷却凝固后用于细胞接种;单层贴壁培养的MCF-7细胞处于生长对数期时,用胰酶消化后制成单细胞悬液,调整细胞密度至5×105/mL接种于上述培养皿中,轻轻震荡后置于37 ℃、CO2体积分数为5%的培养箱中,每24 h半量换液,相差显微镜观察多细胞球生长情况,培养3 d后形成大小较一致的MCS,直径约100~150 μm,用于实验。
1.3 RNA干扰CAV1 mRNA的表达
特异针对CAV1基因及非特异性阴性对照双链小RNA(siRNA)购于美国Santa Cruz公司,转染方法按试剂说明书进行:MCF-7细胞生长于6孔板至60%~70%汇合,用无血清培养液静置24 h,5 μL siRNA与5 μL RNA干扰转染试剂(Santa Cruz公司,美国)混合于190 μL无血清的RPMI-1640培养液,静置30 min后滴加到培养皿中,温育6 h后,添加10%胎牛血清的培养液继续温育24 h,弃去培养液重新用含10%胎牛血清的培养液培养24 h后,小心消化细胞成单细胞悬液,再按上述三维培养的方法得到多细胞球用于实验。
1.4 细胞生长抑制率的检测
单层MCF-7细胞消化制成单细胞悬液,调整细胞密度,接种于24孔板中;三维培养的细胞先取部分多细胞球吹散成单细胞悬液,细胞计数,然后按与单层培养细胞相同的细胞密度接种于1.5%琼脂糖铺底的24孔板中;各组细胞接种6 h后用终浓度分别为0.001、0.01、0.1、1及10 μmol/L的多柔比星(海正药业有限公司,浙江)作用24 h,以无多柔比星的细胞培养液作为阴性对照;细胞经胰酶消化后吹散成单细胞悬液,与等体积0.02%台盼蓝混合,显微镜不同视野计数300个细胞及活细胞数。细胞生长抑制率=(1-多柔比星作用组活细胞数/阴性对照组活细胞数)×100%。每组设3个复孔,实验重复3次。
1.5 RT-PCR检测
Trizol试剂(生工生物工程有限公司,上海)提取细胞总RNA,cDNA合成按M-MLV逆转录酶(Invitrogen公司,美国)操作说明书进行,PCR扩增CAV1 mRNA,并以3-磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogease,GAPDH)作为内参照,引物由Primer 5.0软件设计,上海生工生物工程有限公司合成,CAV1引物:上游引物5’-ACATCTCTACACCGTTCCCAT-3’,下游引物5’-TGTGTGTCCCTTCTGGTTCTG-3’,产物长度206 bp;GAPDH引物:上游引物5’-AACGGATTTGGTCGTATTG-3’,下游引物5’-GGAAGATGGTGATGGGATT-3’,产物长度208 bp;反应条件:95 ℃预变性10 min;95 ℃变性30 s,54 ℃退火1 min,72 ℃ 延伸1 min,26个循环,最后72 ℃延伸10 min。Taq酶为美国Promega公司产品,PCR产物经1.5%琼脂糖电泳分离后,溴乙锭染色,紫外灯下观察。
1.6 蛋白免疫印迹检测
收集细胞,经PBS清洗后,加入细胞裂解缓冲液,提取总蛋白,蛋白定量按BCA试剂盒(Pierce公司,美国)说明书进行。根据蛋白相对分子量选用合适浓度的胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。电泳完毕,将蛋白转移至聚偏二氟乙烯(PVDF)膜上,加入相应的一抗,37 ℃温育1 h,洗涤后加入过氧化物酶标记的二抗,37 ℃温育1 h ,最后用ECL法试剂盒(Pierce公司,美国)按产品说明书步骤显色。条带用Pro Analyzer 4.0软件进行积分吸光度(IA)分析,以β-actin作为内参。一抗:兔抗人caveolin-1多克隆抗体(Santa Cruz公司,美国),工作浓度1∶1 000;鼠抗人Phospho-FAK (Tyr397)及FAK单克隆抗体(BD Bioscience公司,美国),工作浓度1∶1 000;鼠抗人β-actin单克隆抗体(Sigma公司),工作浓度1∶1 000;辣根过氧化物酶标记的山羊抗小鼠及兔的IgG9(鼎国公司,上海),工作浓度1∶2 000,实验重复3次。
1.7 统计学处理
2 结 果
2.1 多细胞球形成增强MCF-7细胞对多柔比星的耐受能力
MCF-7细胞在体外三维培养3 d后形成直径约100 μm、较为致密的多细胞球体(图1A)。用不同浓度的多柔比星作用24 h,结果显示0.001、0.01 μmol/L多柔比星作用时,单层细胞组与多细胞球组的细胞抑制率差异没有统计学意义;随着药物浓度的增加,0.1、1及10 μmol/L多柔比星作用时,多细胞球组的细胞抑制率分别为单层细胞组的36.01%(t=9.72,P<0.01)、46.75%(t=8.27,P<0.01)和53.92%(t=7.01,P<0.01),组间比较差异有显著统计学意义 (图2)。
2.2 多细胞球形成对CAV1表达及FAK磷酸化水平的影响
MCF-7细胞形成多细胞球后,CAV1 mRNA及蛋白水平与单层细胞相比差异无统计学意义,总FAK蛋白水平未见明显改变,但磷酸化FAK(p-FAK)蛋白水平上调(图3);多细胞球组FAK相对磷酸化水平(p-FAK/总FAK)为单层细胞组的3.64倍(t=7.32,P<0.01)。
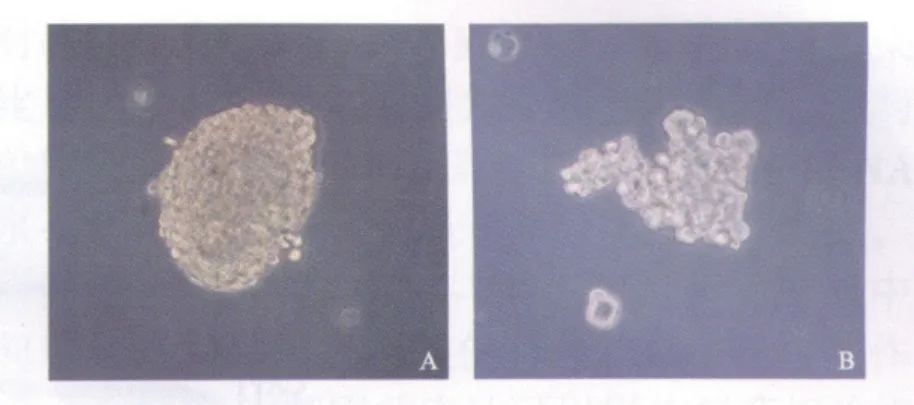
图1 MCF-7细胞三维培养3 d后形成的多细胞球体Fig.1 MCF-7 multicellular spheroids after 3-day 3D culture(×200)

图2 不同浓度的多柔比星处理24 h后的细胞抑制率Fig.2 Cell inhibitory rate after treatment with ADM at different concentrations for 24 h

图3 免疫印迹法检测蛋白水平Fig.3 Level of proteins expression assessed by Western blot
2.3 RNA干扰CAV1基因效率的鉴定
用脂质体法转染siRNA能明显抑制MCF-7细胞CAV1基因表达,RT-PCR扩增26个循环后未检测到CAV1 mRNA产物条带;转染组与未转染组相比,转染组CAV1蛋白水平下降67.6%(t=14.19,P<0.01);与RNA干扰对照组相比,差异有统计学意义(P<0.01,图4)。

图4 RNA干扰CAV1基因后的鉴定Fig.4 Effects of siRNA on the expression of CAV1 in both mRNA and proteins
2.4 RNA干扰CAV1基因降低多细胞球多柔比星耐药性
RNA干扰CAV1基因表达后,MCF-7细胞之间相互黏附能力下降,三维培养3 d后形成的多细胞球较小并且松散,球体增长缓慢(图1B)。用1 μmol/L的多柔比星作用24 h,单层细胞组细胞抑制率明显高于未转染多细胞球组(t=10.01,P<0.01);与未转染组多细胞球相比,干扰组多细胞球的细胞抑制率增加了1.07倍(t=5.77,P<0.01),干扰对照组未见明显改变(图5)。
2.5 RNA干扰CAV1基因降低FAK磷酸化水平
免疫印迹法检测结果显示,与未转染组多细胞球相比,RNA干扰组多细胞球总FAK蛋白水平未见明显变化,p-FAK蛋白水平明显下降,相对磷酸化水平下降68.7%(t=6.57,P<0.01),RNA干扰对照组未见明显差异(图3)。

图5 多柔比星(1 μmol/L)处理24 h后的细胞抑制率Fig.5 Cell inhibitory rate after treatment with ADM (1 μmol/L) for 24 h
3 讨 论
体内存在的实体肿瘤是一个三维的多细胞群体,细胞与细胞、细胞与外基质的相互作用以及肿瘤的微环境因素都会影响肿瘤的生物学特性。因此,三维培养的多细胞球比单层培养的细胞更接近于肿瘤的真实状态。目前研究发现肿瘤细胞形成多细胞球后,对多种化疗药物的敏感性降低,而这种耐受能力的增强不是由于药物不易进入到球体内所致,这种耐药现象被称为“多细胞耐药(multicellular resistance,MCR)”[3]。MCR现象在许多研究中被证实,例如卵巢癌[4]、结肠癌[5]及肺癌[6]等,其机制还不清楚,可能与细胞黏附分子及相关通路的激活有关[3]。黏着斑激酶(focal adhesion kinase,FAK)是一个多功能的非受体型酪氨酸激酶,在细胞之间及细胞与基质黏附中起关键的作用,FAK及下游信号通路的激活可以促进肿瘤细胞的生长和侵袭[7]。陈玉英等[5]用RNA干扰方法沉默FAK基因,发现可以下调Akt/NF-kB通路的活性水平,从而逆转大肠癌细胞的MCR现象,说明FAK在MCR的形成中起着重要的作用。
本研究成功建立了乳腺癌MCF-7细胞三维培养模型,比较多柔比星对单层培养和三维培养的MCF-7细胞的抑制率,结果显示多细胞球组对多柔比星的敏感性明显下降。通过免疫印迹法检测发现,虽然总FAK在形成多细胞球后没有明显改变,但FAK的磷酸化水平显著增加,提示FAK激活可能是MCF-7多细胞球耐药性增强的重要机制。
细胞质膜微囊是细胞膜上烧瓶样的小凹结构,聚集着许多信号转导相关蛋白,作为一个信号分子调节平台,一方面起着募集蛋白的作用,使它们之间更容易发生相互作用;另一方面也把各种蛋白隔离开来,使它们在特定的条件下才被激活,从而使细胞生命活动协调有序的进行,CAV1蛋白在其中扮演着非常重要的角色[2]。CAV1在肿瘤细胞黏附和相关信号通路中起着调节作用,可以稳定FAK的活性[8-9]。另外,不少研究发现CAV1在许多耐药的肿瘤细胞系中表达增强,说明CAV1可能与肿瘤耐药相关[2]。本研究用双链小RNA干扰的方法有效沉默了MCF-7细胞CAV1基因的表达后,细胞之间的黏附能力明显下降,形成的细胞球小而且松散,球体增长缓慢;FAK的相对磷酸化水平被抑制;MCF-7多细胞球对多柔比星的耐药性发生了很大程度上的逆转。但与单层细胞相比,多细胞球中CAV1无论在mRNA水平还是蛋白水平上都未见明显改变。因此,研究推测CAV1在MCF-7多细胞耐药的形成中起着细胞间黏附及相关信号通路调节平台的作用,干扰CAV1基因的表达可以影响耐药相关信号通路的活性,逆转多细胞球的耐药表型,其具体的机制还需要进一步深入研究。
综上所述,本研究结果表明,多细胞球的形成可以增强MCF-7细胞对多柔比星的耐受性;RNA干扰CAV1基因的表达可以逆转MCF-7多细胞球对多柔比星的耐药现象,FAK磷酸化水平的下调可能是其重要的机制。
[1] TIRADO O M, MACCARTHY C M, FATIMA N, et al.Caveolin-1 promotes resistance to chemotherapy-induced apoptosis in Ewing’s sarcoma cells by modulating PKC alpha phosphorylation [J]. Int J Cancer, 2010, 126(2): 426-436.
[2] GOETZ J G, LAJOIE P, WISEMAN S M, et al. Caveolin-1 in tumor progression: the good, the bad and the ugly [J].Cancer Metast Rev, 2008, 27(4): 715-735.
[3] 郑晨宏, 梁后杰, 周琪. 黏附分子在肿瘤多细胞耐药中的研究进展 [J]. 肿瘤, 2008, 28(07): 626-629.
[4] XING H, WANG S, HU K, et al. Effect of the cyclindependent kinases inhibitor p27 on resistance of ovarian cancer multicellular spheroids to anticancer chemotherapy[J]. J Cancer Res Clin Oncol, 2005, 131(8): 511-519.
[5] CHEN Y, WANG Z, CHANG P, et al. The effect of focal adhesion kinase gene silencing on 5-fluorouracil chemosensitivity involves an Akt/NF-kappa B signaling pathway in colorectal carcinomas [J]. Int J Cancer, 2010,127(1): 195-206.
[6] PONCE DE LEÓN V, BARRERA-RODRÍGUEZ R. Changes in P-glycoprotein activity are mediated by the growth of a tumour cell line as multicellular spheroids [J]. Cancer Cell Int, 2005, 5(1): 20-26.
[7] 胡章颜, 刘文庆, 刘康达. 黏着斑激酶与肿瘤 [J]. 基础医学与临床, 2007, 27(10): 1177-1180.
[8] JOSHI B, STRUGNELL S S, GOETZ J G, et al. Phosphorylated caveolin-1 regulates Rho/ROCK-dependent focal adhesion dynamics and tumor cell migration and invasion [J]. Cancer Res, 2008, 68(20): 8210-8220.
[9] BAILEY K M, LIU J. Caveolin-1 up-regulation during epithelial to mesenchymal transition is mediated by focal adhesion kinase [J]. J Biol Chem, 2008, 283(20): 13714-13724.

