血清拉曼光谱检测在鼻咽癌早期诊断中的应用价值研究
潘建基 陈奇松 黄伟 林少俊 苏颖 力超 冯尚源 陈荣
1.福建医科大学教学医院,福建省肿瘤医院放疗科,福建 福州 350014;2.福建师范大学物光学院,福建 福州 350007
拉曼光谱是印度物理学家拉曼在1928年研究纯苯溶液的光散射现象时发现的[1-2],能反映物质内部分子的振动和转动能级等结构信息。每一种物质分子都有自己特定的拉曼光谱,可根据不同样品特性选择不同的激发波长,且不受水溶液影响。将任何一种物质材料作为散射物质,几乎都可以得到相应的拉曼光谱。目前拉曼光谱技术已用于肺癌[3]、乳腺癌[4]、前列腺癌[5]、皮肤癌[6]等体内多种肿瘤的早期诊断。本研究探讨血清拉曼光谱的特点,并分析其在鼻咽癌早期诊断中的应用价值。
1 资料和方法
1.1 研究对象
收集2009年5月—2009年12月于本院诊治的29例经病理确诊为鼻咽癌的初诊患者(鼻咽癌组)和36例健康志愿者(健康对照组)的血清样品。鼻咽癌组患者的病理分类:非角化性未分化型癌27例,非角化性分化型癌1例,低分化鳞癌1例。入组标准:⑴经病理证实的鼻咽癌患者;⑵采血前未行抗肿瘤治疗;⑶无其他肿瘤;⑷能配合完成检查并签订知情同意书。健康对照组入组标准:⑴健康体检者,无肿瘤病史,且EB病毒血清学检查阴性及鼻咽镜检查正常者;⑵志愿并能配合完成检查,同时签订知情同意书(本研究符合人体试验伦理学标准,得到医院伦理委员会的批准)。
1.2 血清样品制备
所有入组的鼻咽癌患者和健康志愿者在禁食12 h后,于次日凌晨6~8时抽取外周静脉血2~4 mL,盛放于血常规管中。所有的血液样品经1 000 r/min,r=9.5 cm,离心10 min后去除血细胞,取上清液获得血清样品。在拉曼光谱测试之前,吸取20 μL血清样品,滴于干净的铝片上,在4 ℃冰箱中放置2 h左右至样品自然变干。
1.3 光谱测量
晾干后的血清样品采用inVia型共聚焦显微拉曼光谱仪进行测量。光谱范围是600~1 800 cm-1,激发光源为半导体激光器发出的785 nm波长的激光。拉曼光谱系统在测量前使用标准硅片的520 cm-1进行定标。激光照射在样品上的功率为50 mw,积分时间为30 s。每个样品测4~5个点。
1.4 光谱信号处理
将测量的所有拉曼光谱经平滑除去噪声,再将平滑后的光谱减去荧光背景,得到纯的拉曼光谱信号。此后,这些光谱均进行面积归一化,以消除激光功率波动和焦面偏移的影响。最后将同一样品的多条光谱进行平均以代表该患者或健康志愿者的血清拉曼光谱信号。
1.5 统计学处理
采用SPSS 13.0统计软件对数据进行处理与分析。计量资料用表示。对两组血清拉曼光谱数据进行主成分分析和判别分析。绘制判别分析结果的受试者工作特性曲线(receiver operator characteristic curve,ROC),并进行ROC曲线分析。
2 结 果
2.1 两组血清的平均拉曼光谱的外形比较
为了更直观地比较两组光谱的差异,分别取两组血清的平均拉曼光谱。
结果显示,两组血清的平均拉曼光谱形态及谱峰位置相似,但在约900~1 000 cm-1及1 600~1 700 cm-1波段,健康对照组的血清拉曼光谱的谱峰强度高于鼻咽癌组,而在1 200~1 400 cm-1波段,健康对照组的血清拉曼光谱的谱峰强度低于鼻咽癌组(图1)。

图1 鼻咽癌患者、健康志愿者血清的平均拉曼光谱图及两者光谱差异图Fig.1 The mean and difference spectrum of the two groups
2.2 两组血清光谱的主成分分析结果
多元统计方法主成分分析(principal components analysis,PCA)[7]是将多个实测原始变量转换为少数几个不相关的综合指标的多元统计方法,其主要过程如下:⑴指标数据标准化(SPSS统计软件自行处理);⑵各指标间相关性判定;⑶确定主成分个数(累积贡献率通常以>70%为宜) ;⑷计算各样品主成分得分。主成分分析后,首先比较两组血清样品主成分得分情况(表1)。
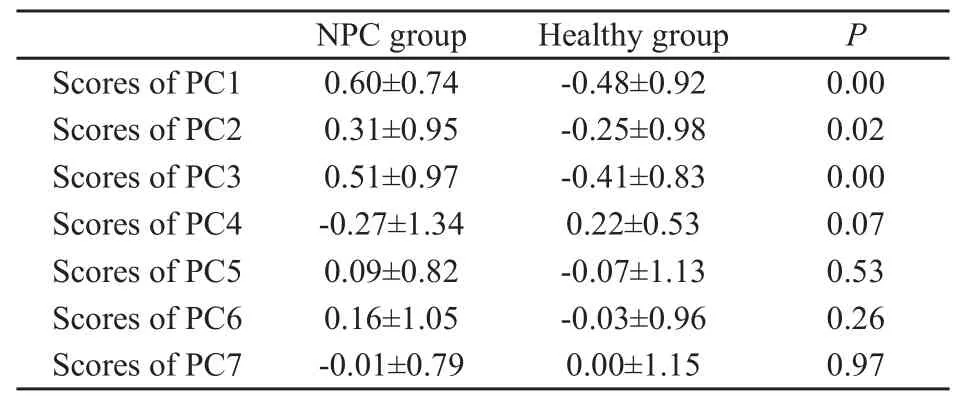
表1 两组血清样品的主成分得分比较Tab.1 Comparison of scores of PC for the serum samples of the two groups
取两组血清样品的第1、2、3主成分得分制作散点图(图2、图3)。结果提示各血清样品的第1、2、3主成分对两组的血清均具有较好的聚类作用。
2.3 两组血清光谱的判别分析结果
经主成分分析降维处理后,选取两组血清样品中累积贡献率为69.69%的前7个主成分得分进一步进行判别分析,同时作交叉检验。结果显示两组血清样品判别得分健康对照组为-1.27±0.92,鼻咽癌组为1.57±1.10(P=0.00)。两组血清样品阳性预测值为89.7%(26/29),阴性预测值为91.7%(33/36,表2)。

图2 两组血清主成分分析二维散点图Fig.2 2D plot using scores of PC1 and PC2
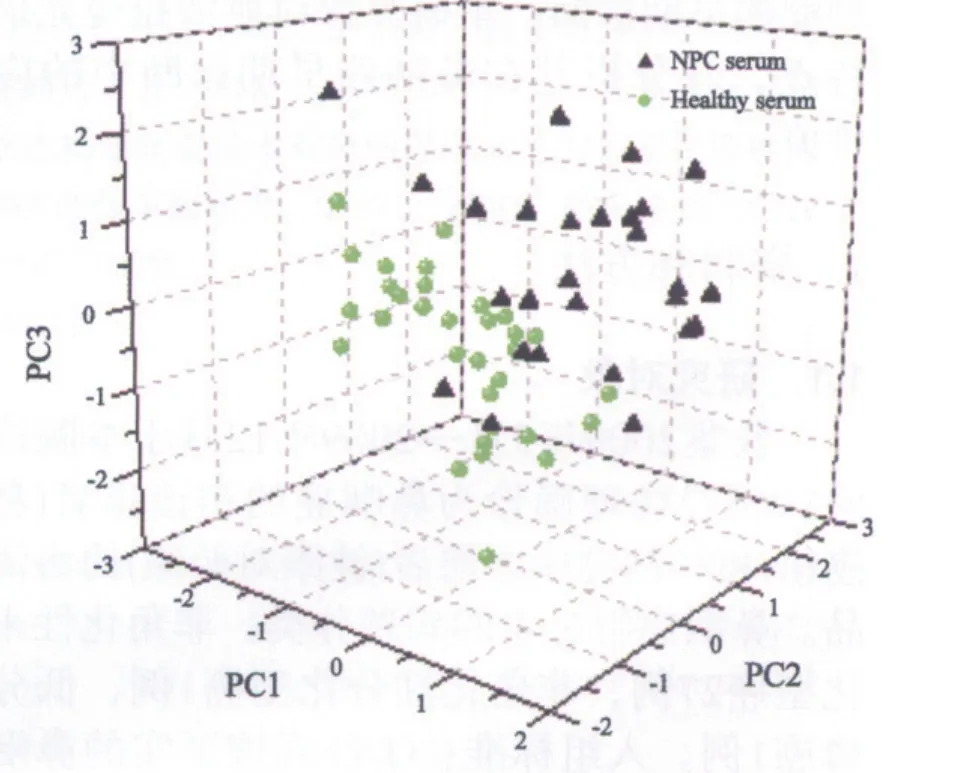
图3 两组血清主成分分析三维散点图Fig.3 3D plot using scores of PC1, PC2 and PC3
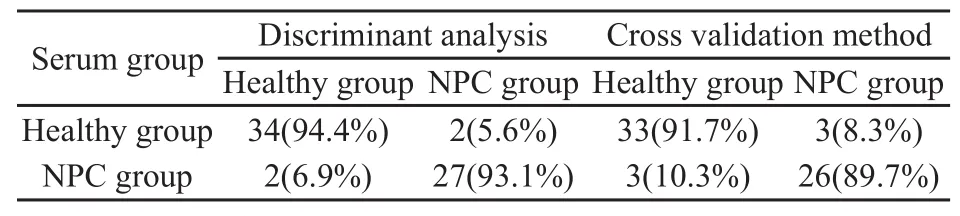
表2 两组血清样品的判别结果Tab.2 The discrimination result for the serum samples of the two groups[n(%)]
2.4 ROC曲线分析
以两组血清的判别得分来构建ROC曲线,纵座标为灵敏度,横座标为1-特异度。其ROC曲线下面积为:0.971,提示判别分析结果准确性高(图4)。
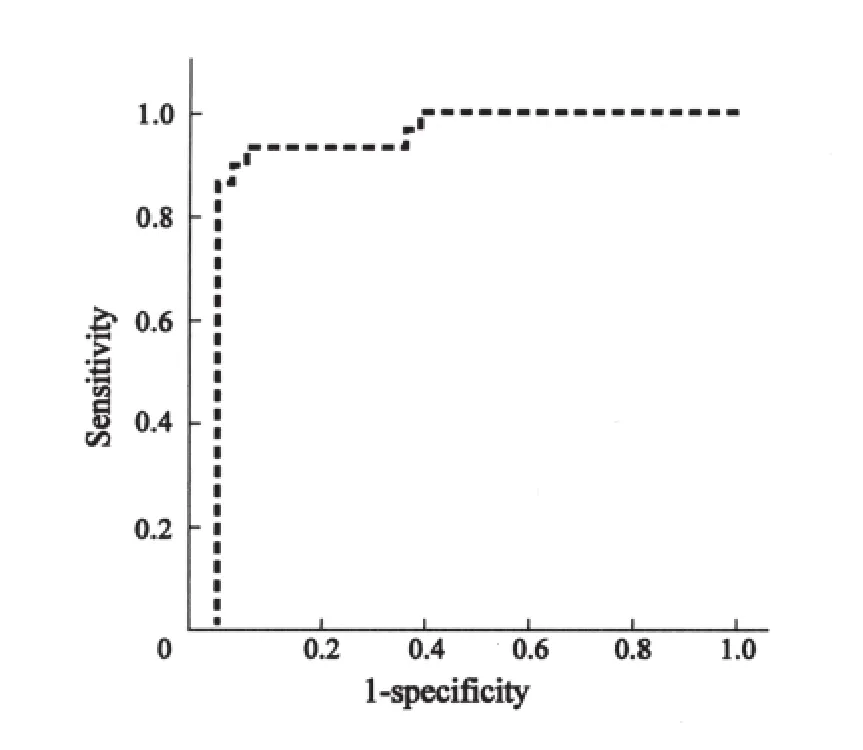
图4 两组血清判别得分构建ROC曲线Fig.4 The ROC cruve of the discrimination result for the serum samples of two groups
3 讨 论
鼻咽癌流行病学具有明显的地域特征,我国南方地区高发。目前EB病毒抗体及DNA酶血清学检测已在临床筛查诊断中普遍应用,由于其敏感性和特异性欠佳[8],故应用价值有限。Tsang[9]等在评价EB病毒壳抗原抗体(EBVCA-IgA)及早期抗原抗体用于筛查鼻咽癌的研究中发现EB-VCA-IgA灵敏度可达89%,但假阳性高达50%,而EB-EA-IgA的灵敏度只有63%。作者认为在鼻咽癌高发地区EB-VCAIgA不宜单独用于鼻咽癌的早期筛查诊断。虽然近年来文献报道鼻咽癌患者血清EBV-DNA浓度对鼻咽癌的诊断、预后等判断具有一定意义,但目前血清EBV-DNA的检测在不同的实验室之间检出率不一致[10],重复性欠佳,单独作为鼻咽癌早期筛查诊断方法仍不理想。鼻咽癌的治疗效果与临床分期密切相关,笔者[11]在回顾性分析1995年—1998年1 706例鼻咽癌的远期疗效表明,Ⅰ期患者5年生存率为100%,Ⅱ期为75.9%,Ⅲ期为66.5%,Ⅳ期为49.3%。因此早期发现、早期诊断、早期治疗是非常重要的,可显著提高鼻咽癌患者生存率和生活质量。
激光拉曼光谱技术是利用激光与样品内部粒子(如分子、原子、电子等)相互作用后产生的特征性峰谱来鉴别样品的一门光谱技术。它具有高分辨率、无损、快速等优点[1-2],可以探测到组织细胞中蛋白质、核酸、脂类等生物大分子的结构信息及含量的变化。通常一条拉曼光谱所包含的物质成分信息可通过对谱峰的组成、峰位、峰宽及峰强等的变化表现出来,谱峰组成及强度高低一般与待测样品内成分的性质与含量多少密切相关。2006年Pichardo-Molina等[4]利用拉曼光谱技术及主成分分析与判别分析等多元统计方法研究乳腺癌患者及健康人血清样品的拉曼光谱,结果显示其灵敏度为97%,特异度为78%。
本研究结果提示两组血清成分存在质或量的差异,这也成为进一步利用多元统计方法来区别两者的依据之一。Hanlon等[1]报道多元统计方法主成分分析(principal components analysis,PCA)可用于对光谱数据进行处理。通常一个样品的拉曼光谱含有的变量(即波数)均为上千个,而主成分分析法PCA[7]是从多个数值变量之间的相互关系入手,利用降维的思想,将多个变量化为少数几个互不相关的综合变量的一种统计方法。这些综合指标不仅保留了原始指标的主要信息,且又互不相关。故该法适合于分析拉曼光谱数据。
总之,激光拉曼光谱技术是一种无创、快速、高灵敏度的光谱检测方法。本研究结果显示,激光拉曼光谱技术能很好地鉴别鼻咽癌患者及健康人血清,但在临床应用方面目前需解决以下的问题:⑴本研究通过主成分及判别分析虽能有效区分鼻咽癌与健康人的血清,但目前尚未知区分二者的血清成分或生物大分子;⑵本研究中血清样品的数量尚偏少,虽然研究结果令人鼓舞,但需大宗样本来检验可能存在的结果偏倚;⑶本研究未将多元癌或其他癌症患者的血清样本纳入对比研究,故结果较局限,今后需开展其他肿瘤的血清拉曼光谱对比研究。
[1] HANLON E B, MANOHARAN R, KOO T W, et al. Prospects for in vivo Raman spectroscopy[J]. Phys Med Biol, 2000,45(2): 1-59.
[2] http://cbst.ucdavis.edu/education/courses/winter-2008-eadbim-289/burger_jan_24_bioraman_afm.pdf.
[3] YAMAZAKI H, KAMINAKA S, KOHDA E, et al. The diagnosis of lung cancer using 1064-nm excited near-infrared multichannel Raman spectroscopy[J]. Radiat Med, 2003,21(1): 1-6.
[4] PICHARDO-MOLINA J L, FRAUSTO-REYES C,BARBOSA-GARCIA O, et al. Raman spectroscopy and multivariate analysis of serum samples from breast cancer patients[J]. Lasers Med Sci, 2007; 22(4): 229-236.
[5] CROW P, BARRASS B, KENDALL C, et al. The use of Raman spectroscopy to differentiate between different prostatic adenocarcinoma cell lines[J]. Br J Cancer, 2005, 92(12):2166-2170.
[6] NIJSSEN A, BAKKER SCHUT T C, HEULE F, et al.Discriminating basal cell carcinoma from its surrounding tissue by Raman spectroscopy[J]. J Invest Dermatol, 2002,119(1): 64-69.
[7] 孙振球, 徐勇勇. 医学统计学[M]. 第2版. 人民卫生出版社, 2006: 415-421.
[8] 洪明晃. 鼻咽癌的筛查问题[J]. 实用肿瘤学杂志, 2004,19(4): 275-276.
[9] TSANG R K, VLANTIS A C, HO R W, et al. Sensitivity and specificity of Epstein-Barr virus IGA titer in the diagnosis of nasopharyngeal carcinoma: a three-year institutional review[J]. Head Neck, 2004, 26(7): 598-602.
[10] 杨德辉, 柳青. 鼻咽癌患者血浆游离EBV DNA检测的研究现状[J]. 中山大学研究生学刊(自然科学与医学版),2006, 27(1): 1-6.
[11] 潘建基, 张瑜, 林少俊, 等. 1706例鼻咽癌放疗远期疗效分析[J]. 中华放射肿瘤学杂志, 2008, 17: 247-251.

