山楂叶总黄酮对缺血性脑卒中活血化瘀作用研究*
胡敏 张晓丹 涂映 陈敏 万云辉
(江西护理职业技术学院 南昌330029)
心脑血管疾病是目前发病率最高、对人类健康威胁最为严重的疾病之一。山楂叶总黄酮(flavone mixture of crataegus leaves,FMCL)为花期山楂叶中提取的抗自由基组分,浅棕色至黄色粉末,味涩微苦,含黄酮苷类、葡荆牡黄酮、荭草素、异荭草素、山楂纳酰及去乙酰山楂纳酰等。已有研究证实山楂叶总黄酮具有扩张冠状动脉、降血压、强心、降血脂等心血管方面的作用[1]。我们采用血瘀大鼠实验模型,观察山楂叶总黄酮对血栓形成、血小板聚集、全血和血浆黏度的影响,探讨山楂叶总黄酮通过改善凝血状态发挥其脑保护作用的机理,为其进一步深入研究和开发提供了理论依据。
1 材料与方法
1.1 药品及试剂 注射用山楂叶总黄酮(益心酮注射液)批号:090510,由长春三九生物制药提供;舒血宁注射液(银杏叶提取物注射液)万荣三九药业有限公司提供,批号090620。
1.2 动物 Wistar大鼠,由南昌大学实验动物部提供。
1.3 仪器 CNOOOO5256型6010紫外分光光度计(安捷伦分析仪器);GF-D200型半自动生化分析仪(山东高密彩虹分析仪器有限公司);BV-100型血液流变测试仪,北京泰诺德新技术研究所;D-37520型超速冷冻离心机,德国索孚。
1.4 分组及造模 取60只雄性大鼠,体重280~300 g,按体重随机分为六组,每组10只,分别为:空白对照组、血瘀模型组、阳性对照组(注射舒血宁注射液0.9 mL/kg)、山楂叶总黄酮高剂量组(60 mg/kg)、山楂叶总黄酮中剂量组(30 mg/kg)、山楂叶总黄酮低剂量组(15 mg/kg)。阳性对照组及山楂叶总黄酮高、中、低剂量组连续给药7 d,空白对照组及模型组腹腔注射等剂量的生理盐水。于末次给药30 min后,造血瘀模型。造模方法:皮下注射0.1%肾上腺素0.07 mL/100 g,共两次,每次间隔4 h,并在此两次间(前后各2 h)将大鼠浸入冰水中5 min,然后动物禁食不禁水[2]。空白对照组动物不造血瘀模型。
1.5 观察及检测指标
1.5.1 血瘀大鼠的全血黏度和血浆黏度的测定造模后次晨,动物腹腔注射水合氯醛350 mg/kg麻醉,腹主动脉取血,肝素抗凝置血液黏度计上测定不同切变率时的全血黏度。上述抗凝血测完全血黏度所余血液以2 000 r/min离心10 min,取上清测血浆黏度。
1.5.2 血瘀大鼠体内血栓形成时间的测定 麻醉后将大鼠固定于固定台上,切开颈部皮肤,分离右侧颈总动脉约15 mm,将实验性体内血栓形成测定仪的刺激电极及温度传感器探头置于动脉上,用2 mA的电流刺激血管7 min以损伤动脉内皮细胞,随着动脉管腔内血栓逐渐形成,血流逐渐被阻断,动脉远端温度逐渐下降,当血流完全阻断时,温度突降,仪器报鸣,此时仪器显示时间即为体内血栓形成时间。
1.5.3 ADP诱导的血小板聚集率的测定 取50只雄性大鼠,体重200~220 g,随机分为五组(每组10只):空白对照组(给予生理盐水),阳性对照组(阿司匹林7.0 mg/kg),山楂叶总黄酮高、中、低剂量组连续给药7 d。末次给药后禁食不禁水12~18 h,腹腔注射水合氯醛350 mg/kg麻醉,腹主动脉取血注入放有枸橼酸钠溶液的硅化离心管中(枸橼酸钠与血比例1:9),将血液与抗凝剂混合后1 000 rpm离心10 min,得富血小板(PRP),然后再3 000 rpm离心15 min,得贫血小板(PPP)。于血小板聚集仪上测定ADP诱导的血小板最大聚集率。
1.6 统计学分析 采用SPSS 11.5 for windows统计软件包分析数据,所有数据均表示为均值±标准差(±S),采用t检验法进行显著性检验,P<0.05为差异具有统计学意义,P<0.01为差异具有显著统计学意义。
2 结果
2.1 山楂叶总黄酮对血瘀大鼠全血黏度及血浆黏度的影响 与空白对照组比较,模型组全血高、中、低切黏度均明显增加(P<0.01或P<0.001),表明血瘀模型成立。与模型组比较,阳性对照组及山楂叶总黄酮大剂量、中剂量组的全血黏度均有所下降,阳性对照组和山楂叶总黄酮组的血浆黏度也有所下降。见表1。
表1 山楂叶总黄酮对血瘀大鼠全血黏度与血浆黏度的影响 (±S) mPa·s
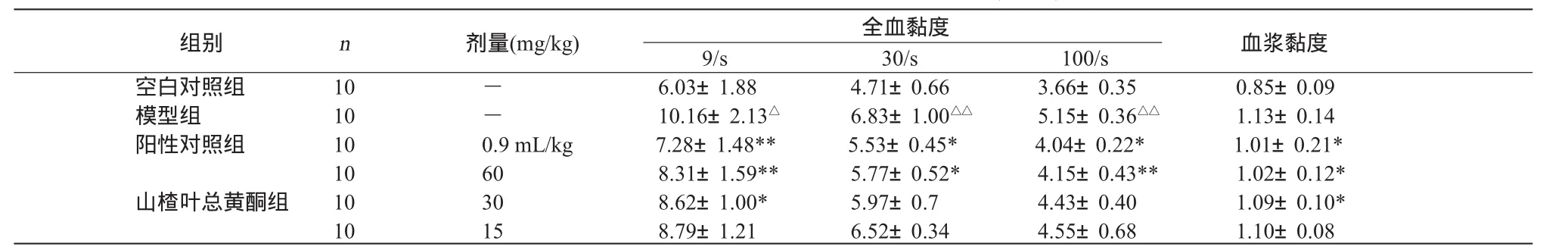
表1 山楂叶总黄酮对血瘀大鼠全血黏度与血浆黏度的影响 (±S) mPa·s
注:与模型组比较,*P <0.05,**P <0.01;与空白对照组比较,△P <0.001,△△P <0.01。
全血黏度组别 n 剂量(mg/kg)血浆黏度9/s 30/s 100/s空白对照组 10 - 6.03±1.88 4.71±0.66 3.66±0.35 0.85±0.09模型组 10 - 10.16±2.13△ 6.83±1.00△△ 5.15±0.36△△ 1.13±0.14阳性对照组 10 0.9 mL/kg 7.28±1.48** 5.53±0.45* 4.04±0.22* 1.01±0.21*10 60 8.31±1.59** 5.77±0.52* 4.15±0.43** 1.02±0.12*山楂叶总黄酮组 10 30 8.62±1.00* 5.97±0.7 4.43±0.40 1.09±0.10*10 15 8.79±1.21 6.52±0.34 4.55±0.68 1.10±0.08
2.2 山楂叶总黄酮对血瘀大鼠体内血栓形成时间的影响 与空白对照组比较,模型组血栓形成时间明显缩短(P<0.001)。与模型组比较,阳性对照组及山楂叶总黄酮大、中剂量组均能明显延长体内血栓的形成时间,山楂叶总黄酮小剂量组也能延长血栓形成时间,但无统计学意义。见表2。
表2 山楂叶总黄酮对血瘀大鼠体内血栓形成时间的影响 (±S)

表2 山楂叶总黄酮对血瘀大鼠体内血栓形成时间的影响 (±S)
注:与空白对照比较,△P<0.001;与模型组比较,*P <0.05,**P <0.01。
组别 n 剂量(mg/kg) 体内血栓形成时间(min)空白对照组 10 - 13.51±2.15模型组 10 - 10.15±1.31△阳性对照组 10 0.9 mL/kg 12.90±2.31**10 60 12.01±1.34**山楂叶总黄酮组 10 30 11.85±1.66*10 15 11.36±1.50
2.3 山楂叶总黄酮对大鼠血小板聚集率的影响与空白对照组比较,阳性对照组可以明显抑制血小板聚集,山楂叶总黄酮大剂量和中剂量对血小板的聚集也有一定程度的降低。见表3。
表3 山楂叶总黄酮对大鼠血小板聚集率的影响 (±S)

表3 山楂叶总黄酮对大鼠血小板聚集率的影响 (±S)
注:与空白对照组比较,*P<0.05,**P <0.01。
组别 n 剂量(mg/kg) 血小板聚集率(%)空白对照组 10 - 67.33±11.86阳性对照组 10 0.9 mL/kg 49.22±15.01**10 60 52.41±7.96*山楂叶总黄酮组 10 30 57.53±9.07*10 15 61.25±9.24
3 讨论
中医理论认为,缺血性中风的发展演变主要是由于瘀血痹阻脑脉并进一步派生出痰饮、风热、瘀毒等病理毒素,从而加剧脑脉病变,闭塞不通从而引发或加重各种临床症状,甚至成为不可逆的脑缺血损伤[3]。血液流变学的研究内容涵盖了血栓形成的三种要素:血液成分、血液状态和血管壁状况,因此与缺血性脑血管病有着密切的联系。血液流变学因素与血液的高凝状态和脑血流灌注不良有关,大多数的脑缺血患者血液流变学各项指标异常。随着病情的好转,脑缺血患者的血液流变学各项指标也逐渐好转。在血液流变学中,全血黏度是反映血液流变性的一个重要指标,患者脑缺血后全血黏度和血浆黏度皆升高,尤其全血黏度低切升高更为显著[4~5]。说明全血黏度对临床诊断缺血性脑血管病及判断其严重程度具有重要意义。脑缺血时,由于脑组织的缺血缺氧,造成脑内能量物质的缺乏,细胞膜的流动性下降,膜的脂质过氧化作用增强,红细胞变形性下降,在毛细血管内的流动性降低,血流速度减慢,红细胞聚集,最终导致血黏度上升,血流淤滞,引起一系列病理变化。除了红细胞的作用外,血小板的粘附和聚集增强也可造成血黏度的上升。有研究显示[6]血小板功能变化是脑梗死发病的因素之一,还是造成脑梗死之后缺血性加重的主要原因之一。Uchiyama[7]报道脑梗死、一过性脑缺血患者不仅血小板粘附性、聚集性增加,而且参与粘附反应的凝血因子增多,因此认为血小板的高反应性(粘附、聚集、释放增强)与缺血性脑血管病的发生有关。本实验结果显示山楂叶总黄酮高、中剂量对ADP诱导的血小板聚集有一定的抑制作用,表明山楂叶总黄酮有降低血小板聚集、抗血栓形成的作用。综上所述,山楂叶总黄酮对缺血性脑卒中具有保护作用,其机制是通过降低血黏度、抑制血小板聚集实现的。
[1]董英杰,张乃先,张明垒.大果山楂叶黄酮成分研究[J].沈阳药科大学学报,1996,13(1):31
[2]徐叔云,卞如濂,陈修.药理实验方法学[M].第 3 版.北京:人民卫生出版社,2002.1 042
[3]胡国恒,祝美珍.活血化瘀法防治脑缺血损伤的理论探讨[J].中华中医药杂志,2008,23(6):514-515
[4]王援朝,徐贵燕,戴惠婷,等.耳针治疗大鼠实验性缺血性中风症的研究[J].中国针灸,2001,21(4):235-236
[5]王健,胡健鹏.缺血性中风气虚血瘀证动物模型的初步研究[J].安徽中医学院学报,1999,18(2):46-48
[6]张新江,周大柱.血小板形态变化与脑梗死[J].国外医学·脑血管疾病分册,1997,5(4):197
[7]Uchiyama S,Takeuchi M,Osawsa M,et al.Platelet function tests in thromboic cerebrovascular disorders[J].Stroke,1983,14(4):511-517

