菟丝子醇提液对衰老模型大鼠肝细胞p16和cyclinD1基因表达的影响
孙 洁 李 晶 欧 芹 魏晓东 朴金花 葛堂栋 王迪迪
(佳木斯大学基础医学院生物化学教研室,黑龙江 佳木斯 154007)
细胞在周期时相的变迁中进入增殖、分化、衰老和死亡等生理状态。细胞周期运转沿着G1期、S期、G2期和M期有序进行。近年来研究表明,细胞周期调控的核心为细胞周期蛋白依赖性激酶(CDK)的活性表达与调控和不同周期时相之间的转变的生物学意义,其中以G1/S、G2/M关卡的调节最为重要〔1〕,而细胞周期的完成依赖于一系列正负调节因子的相互作用顺利渡过G1/S、G2/M两个关卡的转变。菟丝子常用作补益中药,药理学研究表明其具有补肾壮阳、提高机体免疫能力、调节内分泌、抗氧化等作用〔2~4〕。本实验旨在观察细胞调控因子p16和cyclinD1的表达,研究菟丝子醇提液的抗衰老机制。
1 材料与方法
1.1 药品及实验动物 选用 Wistar大鼠50只,雌雄各半,体重180~220 g。由佳木斯大学实验动物中心提供(许可证号:SYXK黑20030014)。菟丝子购自佳木斯宝泰医药,由本校生药教研室鉴定。以8倍乙醇回流提取,旋转蒸发器回收乙醇,将菟丝子制成生药浓度为0.15/ml的菟丝子醇提物水溶液,采用盐酸-镁粉实验鉴定菟丝子醇提液中所含成分。
1.2 动物分组及处理 50只大鼠随机分为青年组10只;衰老模型组10只;给药组30只,又分15 d、30 d和45 d组,每组各10只,雌雄各半。各组正常饮食,衰老模型组和给药组按48 mg/kg注射 D-gal,连续注射45 d后,衰老模型组按0.5 ml/100 g体重灌服温开水;给药组按0.8 g/kg体重灌服菟丝子醇提液。连续给药后分别于灌服后第 15、30、45天处死动物,提取肝组织,液氮保存备用。
1.3 指标的测定 采用Trizol法提取肝组织RNA,核酸蛋白分析仪测定RNA浓度及纯度。采用电泳凝胶成像系统观察mRNA表达量。RT-PCR法检测p16、cyclin D1 m RNA表达水平:cDNA反应体系:引物选择Oligo d T18-Adaptor Primer,5×RNA PCR buffer 5 μ l,无 RNA 酶水 6.5 μ l,dNTP 混 合物 4 μ l,RNA 酶抑 制剂 0.5 μ l,AMV 逆 转录 酶 1 μ l,Oligo-dT 引 物 1 μ l,RNA 样 品2 μ l,混匀,移入 PCR 仪,42℃ 60 min;95℃ 5 min;1 次循环。PCR反应:采用GAPDH和 β-actin作内参,GAPDH引物5'-CTGAATTCGGGCTCTCCAGAACATCAT C-3',5'-CAGGATCCC CAGCGTCAAAGGTGGA-3'(扩增产物 300 bp);β-actin引物5'-CTACAATGAGCTG CGCGTGGC-3′,5'-CAGGTCCAGACGCAGGATGGC-3'(扩增产物242 bp);p16引物5'-GATGATGGGCAACGTCAAA-3',5'-AGAGTAGATACCGCAAATACCG-3'(扩增产物248 bp);cyclinD1引物5'-GGAGCAGAAGTGCGAAGA-3',5'-GGGTGGGTTGGA AAT GAA-3'(扩增产物394 bp)。94℃5 min,1循环,94℃40 s,55℃45 s,72℃45 s;35个循环,72℃7 min。PCR产物经琼脂糖电泳分离后以凝胶成像系统扫描,测定光密度值,并计算p16/GAPDH和cyclinD1/β-actin光密度比值。采用免疫组化SABC法检测p16和cyclinD1蛋白的表达。
1.4 统计学处理 采用SPSS12.0统计分析软件,实验数据用±s表示,进行方差分析,q检验。
2 结 果
2.1 菟丝子醇提液对衰老模型大鼠肝组织p16基因表达的影响 扩增后得到GAPDH 300 bp和p16 248 bp两个片段,GAPDH和p16扩增条件完全一致。图像分析结果(见表1,图1,图2)显示:与青年组相比衰老模型组及各给药组大鼠p16 m RNA及蛋白表达显著增高(P<0.01);与衰老模型组比较,菟丝子30 d、45 d给药组mRNA及蛋白表达明显降低(P<0.01),并且两给药组间相比较表达无差别(P>0.05)。
2.2 菟丝子醇提液对衰老模型大鼠肝组织cyclinD1基因表达的影响 扩增后得到 β-actin 242 bp和cyclinD1 394 bp两个片段,β-actin和cyclinD1扩增条件完全一致。图像分析结果(见表2,图3,图4)显示:与青年组比较,模型组及各给药组 cyclinD1 mRNA及蛋白表达显著降低(P<0.05);与模型组比较,菟丝子15 d、30 d、45 d给药组 cyclin D1 mRNA及蛋白表达明显升高(P<0.05),并且各给药组间相比较表达有差别(P<0.05)。
表1 菟丝子醇提液对衰老模型大鼠肝组织p16基因表达的影响( ±s,n=10)

表1 菟丝子醇提液对衰老模型大鼠肝组织p16基因表达的影响( ±s,n=10)
与青年组比较:1)P<0.01;与模型组比较:2)P<0.01;给药30 d、45 d组间比较:3)P<0.05;下表同
组别 p16/GAPDH 阳性细胞数(%)青年对照组 0.82±0.05 8.62±4.69衰老模型组 1.32±0.09 1) 53.70±6.951)给药15 d组 1.25±0.06 1) 48.13±5.151)给药30 d组 1.06±0.071)2) 36.23±4.911)2)给药45 d组 1.04±0.101)2) 32.17±7.871)2)
表2 菟丝子醇提液对衰老模型大鼠肝组织cyclinD1基因表达的影响(±s,n=10)

表2 菟丝子醇提液对衰老模型大鼠肝组织cyclinD1基因表达的影响(±s,n=10)
组别 cyclinD1/β-actin 阳性细胞数(%)青年对照组 1.22±0.10 48.45±7.39衰老模型组 0.71±0.141) 9.40±3.141)给药15 d组 0.96 ±0.121)2) 26.39 ±5.251)2)给药30 d组 1.03 ±0.141)2)3) 29.40±5.34 1)2)3)给药45 d组 1.15 ±0.131)2)3) 44.34±4.57 1)2)3)

图1 各组大鼠肝组织p16 mRNA的表达

图2 肝细胞p16蛋白表达(×400)
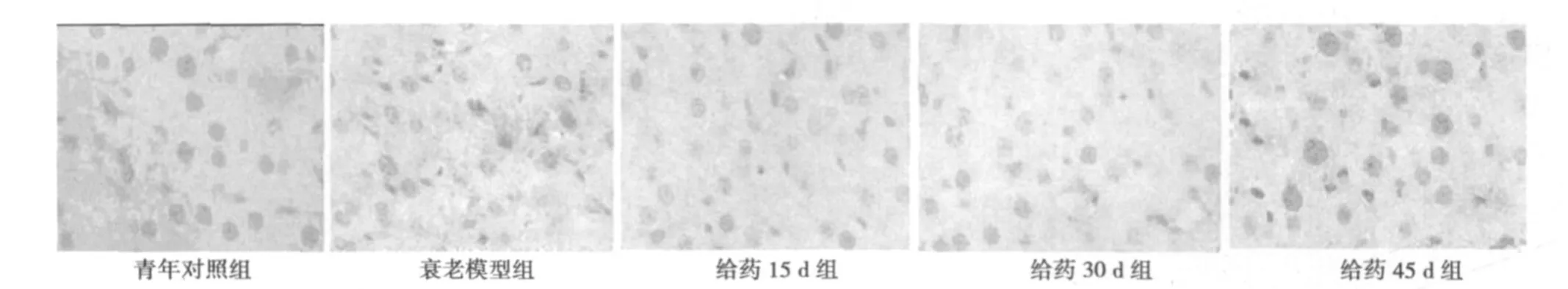
图3 各组肝细胞cyclinD1蛋白表达(×400)

图4 各组大鼠肝组织cyclinD1 mRNA的表达
3 讨 论
目前研究发现哺乳动物cyclin有9大类,主要有 cyclinA、B(1、2)、C、D(1、2、3)和 E 等,其中以 D1 的作用最为重要〔5〕,是大多数组织增殖所必需的。关于CyclinD1与衰老的关系已成不争的事实,它通过与CDK结合成复合物,在细胞周期各相应时期发挥调节作用。本实验研究结果说明D半乳糖衰老模型大鼠cyclinD1的表达水平明显降低,而各菟丝子组则较模型组显著提高。多数学者研究发现,细胞周期停滞是细胞衰老的一个关键特征,衰老细胞主要停滞于G1期,不能顺利进人S期。Cyclin D1作用于G1/S期转换过程,促使细胞从G1期进入S期。在G1期,cyclinD与 CDK4/CDK6结合,使后者激活,活化的CDK4可使Rb磷酸化,特别是磷酸化组蛋白Rb。在细胞的G1期,Rb与 E2F-DP1杂二聚体结合,在cyclin D-CDK作用下,磷酸化的Rb与杂二聚体分离,结合状态的E2F变成游离状态即可发挥启动DNA合成的作用,从而促使细胞由 G1期进入S期〔6~10〕。衰老时 cyclin D1表达的下降,可能通过减少 CDK4活化,进而抑制Rb的磷酸化,从而减少E2F的游离,减慢细胞从G1进入S期,菟丝子醇提液通过上调cyclinD1的表达而增加cyclinD1的表达,可能通过 CDK4/CDK6的活化,催化 Rb磷酸化而加速 E2F与Rb分离,促使细胞进入 S期,而发挥延缓细胞衰老的作用。
p16是细胞周期依赖性激酶抑制因子(CDKI),是细胞周期的负调节因子,通过抑制CDK的活性使Rb正常地行使G1期阻滞功能,使细胞周期停止,阻断细胞增殖〔11~13〕。衰老时的p16表达增加,可通过与cyclin D竞争性结合CDK4/CDK6,P16-CDK复合物不能使Rb磷酸化,抑制cyclin D1-CDK复合物的活性,使细胞阻滞在G1期。而菟丝子醇提液可以通过降低p16的表达,减少其与Cyclin D竞争结合CDK,而使cyclin D1激活CDK4的过程不受抑制,从而促进细胞从G1进入S期,发挥延缓衰老的作用。
1 Nielson NH,Loden M,Cajander J,et al.G1-S transition defects occur in most breast cancers and predict outcome〔J〕.Breast Cancer Res,1999;56(2):105-12.
2 柯江维,王建红,赵 宏 .菟丝子黄酮对心理应激雌性大鼠海马-下丘脑-垂体-卵巢轴性激素受体的影响〔J〕.中草药,2006;37(1):90-2.
3 杨 欣,丁彩飞,张永华,等 .菟丝子水提物对人精子顶体和超微结构的保护作用〔J〕.中国中药杂志,2006;31(5):422-5.
4 朴金花,欧 芹,王 昭,等 .生菟丝子、盐菟丝子对D-半乳糖所致衰老模型小鼠免疫功能影响〔J〕.中国老年学杂志,2005;25(2):452-3.
5 Grana X,Heddy EP.Cell cycle control in mammalian cells:role of cyclins,cyclin dependent kinases(CDKs),growth suppressor genes and cyclin-dependent kinase inhibitors(CKIs) 〔J〕.Oncogene,1995;11(1):21-9.
6 Serrano M,Hannon GJ,Beach D.A new regulatory modify in cell cycle control causing specific inhibitor of cyclinD/CDK4 〔J〕.Nature,1999;366:704.
7 Dreyling MH,Bullinger L,Ott G,et al.Alteration of the cyclinD1/p16-pRb pathway in mantle cell lymphoma〔J〕.Cancer Res,2005;57:4608-14.
8 Easton J,Wei T,Lahti JM,et al.Disruption of the cyclinD/cyclin-dependent kinase/INK4 l retinoblastoma protein regulatory pathway in human neuroblastoma〔J〕.Cancer Res,1998;58:2624-32.
9 Fong LY,Nguyen VT,Farber JL,et al.Early deregulation of the pl6ink4a-cyclinD1/cyclin-dependent kinase 4-retinoblastoma pathway in cell proliferation-driven esophageal tumorigenesis in zinc-deficient rats〔J〕.Cancer Res,2000;60(16):4589-95.
10 Serrano M,Gregory J,Hannon S,et al.A new regulatory motif in cell-cycle control causing specific inhibition of cyclinD/CDK4〔J〕.Nature,2004;366:704-7.
11 郑文婕,童坦君,张宗玉 .细胞衰老的重要通路:p16INK4a/Rb和p19ARF/p53/p21cip1信号途径〔J〕.生命的化学,2002;22(4):314.
12 Rues M,Peters C.The p1611 NK4a/CDKN2.4 tumor suppressor and its relatives〔J〕.Biochim Biophys Acta,1998;14:115-77.
13 Geradts J,Kratzke RA,Niehans GA,et al.Immunohistochemical detection of the cyclin-dependent kinase inhibitor2/multiple tumor suppressor gene1(CDKN2/MTS1)product p16ink4a in archival human solid tumors:correlation with retinoblastoma protein expression〔J〕.Cancer Res,2005;55:6006-11.

