原花青素脑保护作用的研究
张 艳,刘珊丽,曹志斌,张建东,崔 明,2
(郑州大学1.基础医学院药理学教研室、2.第五附属医院,河南 郑州 450052)
脑缺血是临床上常见的急性脑血管疾病,具有高致残率和高致死率。目前临床缺乏理想的治疗药物,因此寻找有效的神经保护药物从而降低后遗症的发生率仍然是当前脑缺血研究的重点。原花青素(Procyanidin,PC)是一种广泛存在于植物中的天然抗氧化药物,研究表明,它具有减轻脑缺血大鼠的脑组织水肿、保护神经元的作用。而近年来研究发现酸敏感离子通道(acid-sensing ion channels,ASICs)在缺血性脑损伤中发挥了重要的作用。本研究旨在探讨PC的脑保护作用及机制,为脑缺血的防治提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 实验采用健康成年♂ SD大鼠,体质量(300±50)g,购自河南省实验动物中心。
1.1.2 试剂 原花青素(安阳晶森天然产物有限公司);iNOS测定试剂盒(南京建成生物工程研究所);MPO测定试剂盒(南京建成生物工程研究所);ASIC1a抗体(美国Sant Cruz公司,批号:C2808);免疫组化试剂盒(北京博奥森试剂公司)。
1.2 方法
1.2.1 分组及给药 将80只SD大鼠随机分为5组,每组16只,即假手术组、模型组及PC低、中、高剂量(50、100、200 mg·kg-1)组。PC 各组分别在缺血前30 min和缺血后2 h腹腔注射相应浓度的PC溶液,假手术组和模型组给与等体积的NS。
1.2.2 脑缺血再灌注模型的制作 采用改良的线栓法[1]建立大鼠左侧脑缺血/再灌注模型。
1.2.3 免疫组化测定ASIC1a的表达 采用抗生物素-生物素-过氧化物酶复合物(ABC)法。按免疫组化试剂盒提供的方法操作,DAB显色,脱水,透明封片。光镜下根据阳性细胞数的多少对染色结果进行半定量分析,分别评为Ⅰ-Ⅳ级。阳性细胞数≤10%(Ⅰ级);11% ~25%(Ⅱ级);26% ~50%(Ⅲ级);≥50%(Ⅳ级)。
1.2.4 iNOS和MPO活性的测定 冰盒上将大鼠断头处死,迅速取出缺血脑组织。按1 g∶9 ml的比例加入4℃的生理盐水,制成10%的脑组织匀浆,按试剂盒说明书,用比色法分别测定iNOS和MPO的活性。
1.3 数据处理与统计分析 应用SPSS13.0统计软件进行数据分析。定量资料以±s表示,定量资料采用单因素方差分析,其中两组间的比较采用q检验。
2 结果
2.1 缺血区脑组织中ASIC1a的表达 与假手术组相比,模型组脑片ASIC1a的表达明显升高(P<0.01);与模型组相比,PC低剂量组的ASIC1a表达无明显变化(P>0.05),而 PC中剂量组的ASIC1a表达降低(P<0.05),PC高剂量组的ASIC1a表达明显降低(P<0.01);且PC各组之间差异无显著性(P>0.05)。Fig 1和Tab 1。
2.2 iNOS活性 与假手术组相比,模型组的iNOS活性明显升高(P<0.01);与模型组相比,PC各组的iNOS活性明显降低(P<0.01);与PC低剂量组相比,PC中高剂量组的iNOS活性明显降低(P<0.01),且中、高组之间差异无显著性(P>0.05)。见Tab 2。

Fig 1 Representative photomicrographs of positive cells of ischemic brain tissue after focal cerebral ischemia-reperfusion injury in rats (400×)
Tab 1 Effects of PC on ASIC1a expression of ischemic brain tissue after focal cerebral ischemia-reperfusion injury in rats(±s,n=8)
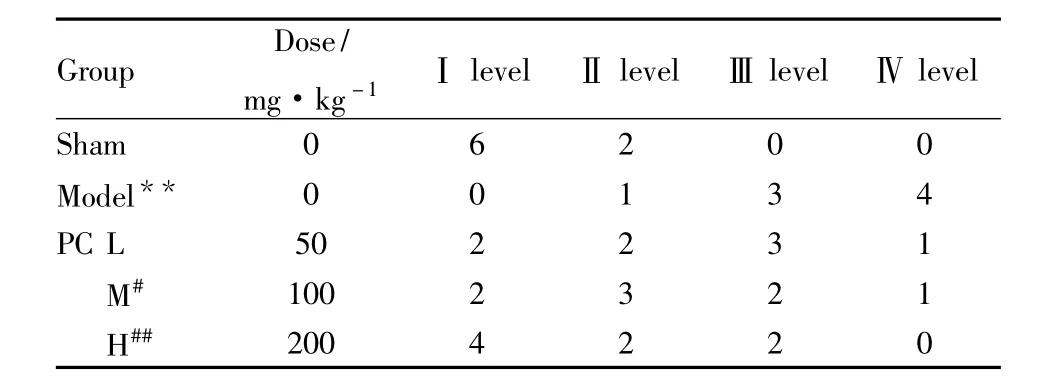
Tab 1 Effects of PC on ASIC1a expression of ischemic brain tissue after focal cerebral ischemia-reperfusion injury in rats(±s,n=8)
**P <0.01 vs sham;#P <0.05,##P <0.01 vs model
Group Dose/mg·kg-1 Ⅰlevel Ⅱlevel Ⅲlevel Ⅳlevel Sham 0 6 2 0 0 Model** 0 0 1 3 4 PC L 50 2 2 3 1 M# 100 2 3 2 1 H##200 4 2 2 0
Tab 2 Effects of PC on activities of iNOS after focal cerebral ischemia-reperfusion injury in rats(±s,n=8)

Tab 2 Effects of PC on activities of iNOS after focal cerebral ischemia-reperfusion injury in rats(±s,n=8)
**P<0.01 vs sham;##P<0.01 vs model
Group Dose/mg·kg-1 iNOS activity/U·g-1Pro Sham 0 0.458 ±0.010 Model 0 1.267 ±0.010**PC L 50 0.844 ±0.008##M 100 0.801 ±0.009##H 200 0.803 ±0.011##
2.3 MPO的活性 与假手术组相比,模型组的MPO活性明显升高(P<0.01);与模型组相比,PC各组的MPO活性明显降低(P<0.01),且PC各组的MPO活性差异无显著性(P>0.05)。见Tab 3。
Tab 3 Effects of PC on activity of MPO after focal cerebral ischemia-reperfusion injury in rats(±s,n=8)

Tab 3 Effects of PC on activity of MPO after focal cerebral ischemia-reperfusion injury in rats(±s,n=8)
**P<0.01 vs sham;##P<0.01 vs model
Group Dose/mg·kg-1 MPO activity/U·g -1 Sham 0 0.405 ±0.010 Model 0 0.604 ±0.011**PC L 50 0.509 ±0.009##M 100 0.501 ±0.008##H 200 0.501 ±0.009##
3 讨论
研究证实,白细胞及炎症因子触发的炎症反应在脑缺血损伤中起关键作用。参与脑缺血后损伤反应的炎症细胞,早期以中性粒细胞为主。研究发现[2],MPO活性能反映中性粒细胞在脑组织中的浸润程度。MPO的主要功能[3]是在吞噬细胞内杀灭微生物,利用过氧化氢和氯离子-产生次氯酸盐,并形成具有氧化能力的自由基,在特定条件下,MPO催化反应生成过量的自由基,超过局部抗氧化的防御线时,就会导致氧化损伤。本研究结果显示:脑缺血/再灌注损伤后,缺血区脑组织MPO活性明显升高,而PC各组均可抑制 MPO的升高,从而对抗MPO所产生的炎症反应。
NO是脑缺血/再灌注损伤中一个重要的炎症介质。NO是由一氧化氮合酶(nitric oxide synthase,NOS)催化L型精氨酸生成的。生物体内的NOS为一组同功酶,根据其来源可分为脑神经性NOS、内皮细胞性NOS和白细胞/巨噬细胞性NOS(iNOS)。现已明确,NO在脑缺血中既有神经保护作用,又有神经毒性作用[4-7]。较早期研究发现,nmol水平的NO主要起细胞毒性作用,而pmol或者fmol水平的NO则参与了免疫及炎性反应过程中的信息传递[8]。进一步研究表明,缺血亚急性期源于iNOS的NO可导致神经元损伤。本实验中,PC各组均能抑制iNOS活性而间接降低NO含量,减轻NO导致的神经元损伤,并且PC中、高剂量组的抑制效果要优于PC低剂量组。
近年来研究发现ASICs在缺血性脑损伤中发挥了重要的作用。Xiong等[9-11]研究表明,在缺血性脑损伤过程中,ASIC1a被激活,导致细胞内钙、钠离子的增加,导致神经元损伤,并用脑缺血动物模型实验证明,用ASIC1a的阻断剂或敲除该通道的基因能减少脑缺血损伤,发挥神经保护作用,这种作用远远超过谷氨酸受体拮抗剂的作用,且使用阻断剂能明显延长时间治疗窗。Chen等[12]的研究发现,脑中风伴随的神经退化与ASIC1a的激活有着密切的关系。组织酸化可激活Ca2+可透性的ASIC1a,引起神经毒性损伤。该损伤可被ASICs抑制剂所抑制,缺乏内源性ASICs的细胞能够耐受该损伤,但转染Ca2+可透性ASIC1a则可重建其敏感性。本实验中,PC能抑制缺血脑组织ASIC1a的表达,从而保护神经元,并且PC中、高剂量组的抑制效果要优于PC低剂量组。
PC是由数量不同的儿茶素或表儿茶素缩合而成的二到十聚体。其中最简单的是儿茶素、表儿茶素或儿茶素与表儿茶素形成的二聚体。在课题组的前期研究中已经证实[13],儿茶素通过抑制MPO和NOS的活性,减轻缺血后脑组织中性粒细胞的浸润,抑制炎性反应和自由基引起的继发性脑损伤,保护缺血神经元。课题组对PC研究已表明[14],PC能够降低脑水肿的发生,降低乳酸含量,增加Na+,K+-ATPase和Ca2+-ATPase活性,从而发挥神经保护作用。
在本研究中进一步证实PC可以有效减轻大鼠脑缺血/再灌注损伤,保护缺血脑组织。PC的脑保护作用机制可能与其减轻脑水肿、抗炎、抗氧化及抑制缺血脑组织ASIC1a的表达有关。
[1] 吴 莹,陈文荣,吴春泽,等.栓线法大鼠局灶性脑缺血模型的建立与改进[J].汕头大学医学院学报,1999,12(1):23-5.
[1] Wu Y,Chen W R,Wu C Z,et al.Establishment and improvement-A rat's model of focal cerebral ischemia(FCI)by nylon suture embolization[J].J Shantou Univ Med Coll,1999,12(1):23-5.
[2] Barone F C,Schmidt D B,Hillegass L M,et al.Reperfusion increases neutrophils and leukotriene B4 receptor binding in rat focal ischmia[J].Stroke,1992,23(9):1337 -47.
[3] 蒋 辛,赵良中,张海龙,等.原花青素对大鼠实验性血栓形成的影响[J].中国实验血液学杂志,2007,15(3):617-21.
[3] Jiang X,Zhao L Z,Zhang H L,et al.Effects of Procyanidin oligomers on experimental thrombosis in rats[J].J Exp Hemato,2007,15(3):617-21.
[4] Pütter M,Grotemeyer K H,Würthwein G,et al.Inhibition of smoking-induced platelet aggregation by aspirin and pycnogenol[J].Thiomb Res,1999,95(4):155 -61.
[5] 黄晓瑾,毛峻琴.葡萄籽原花青素抗大鼠脑缺血再灌注损伤的研究[J].中国药师,2005,8(7):541-2.
[5] Huang X J,Mao J Q.Protective effect of procyanidins on cerebral ischemia-reperfusion injury in rats[J].China Pharmacist,2005,8(7):541-2.
[6] 贾玉洁,闵连秋,季占胜,刘 畅.原花青素对大鼠局灶性脑缺血的保护作用[J].中国脑血管病杂志,2005,2(12):558-60.
[6] Jia Y J,Min L Q,Ji Z S,Liu C.The protective effect of procyanidins on focal cerebral ischemia in rats[J].Chin J Cenebrovascul Dis,2005,2(12):558 -60.
[7] 贾玉洁,闵连秋,季占胜,刘 畅.原花青素对脑缺血后抑凋亡基因蛋白Bcl-2和促凋亡基因蛋白Bax的影响[J].中国临床康复,2006,10(23):65-72.
[7] Jia Y J,Min L Q,Ji Z S,Liu C.Influence of procyanidin on Bcl-2 and Bax after cerebral ischemia[J].Chin J Clin Rehabil,2006,10(23):65-72.
[8] 吴秀香,卢晓梅,杜莉莉,等.原花青素对脑缺血再灌注小鼠脑组织细胞因子、一氧化氮合酶和血脑屏障的影响[J].中国动脉硬化杂志,2006,14(8):665-8.
[8] Wu X X,Lu X M,Du L L,et al.Effects of grape seed procyanidins on cytokines,nitric oxide synthase and blood-brain barrier after cerebral ischemia-reperfusion in mice[J].Chin J Arterioscl,2006,14(8):665-8.
[9] Xiong Z G,Zhu X M,Chu X P,et al.Neuroprotection in ischemia:blocking calcium-permeable acid-sensing ion channels[J].Cell,2004,118(6):687 -98.
[10] Xiong Z G,Chu X P,Simon R P.Ca2+-permeable acid-sensing ion channels and ischemic brain injury[J].J Membr Biol,2006,209(1):59-68.
[11] Pignataro G,Simon R P,Xiong Z G.Prolonged activation of ASIC1a and the time window for neuroprotection in cerebral ischemia[J].Brain,2007,130(1):151 -8.
[12]Chen X,Kalbacher H,Grunder S.The tarantula toxin psalmotoxin 1 inhibits acid-sensing ion channel(ASIC)1a by increasing its apparent H+affinity[J].J Gen Physiol,2005,126(1):71 -9.
[13]刘珊丽,刘宗文,卢沛琦,等.儿茶素对大鼠脑缺血/再灌注损伤的保护作用及机制[J].中国药理学通报,2010,26(2):255-7.
[13] Liu S L,Liu Z W,Lu P Q,et al.Protective effects of catechin on cerebral ischemia-reperfusion injury in rats and its mechanism[J].Chin Pharmacol Bull,2010,26(2):255 -7.
[14]陈香红,张 艳.原花青素对大鼠脑缺血再灌注损伤代谢障碍的影响[J].中国实用神经疾病杂志,2010,13(22):15-7.
[14] Chen X H,Zhang Y.Influence of procyanidine on the dysmetabolism after cerebral ischemia-reperfusion in rats[J].Chin J practical Nervous Dis,2010,13(22):15 -7.

