知母皂苷元对体外培养皮层神经元树突发育的影响及信号转导机制
王金宁,董 燕,隋海娟,张永兴
(1.辽宁医学院药理学教研室,辽宁锦州 121001;2.苏州大学医学部,江苏苏州 215000;3.厦门大学医学院预防医学系,福建厦门 361005)
神经元树突是神经元接收、加工和整合输入信息的基本部位,树突的功能主要取决于树突树的分支类型和树突分化成的树突棘。近年研究发现神经元树突形成过程受多种细胞外和细胞内因素的调控[1-2]。在多种神经退行性疾病中都伴有树突树和树突棘损伤导致神经环路的功能障碍,如海马和皮层神经突触的丢失和神经突起的功能障碍被认为是阿尔采末病(AD)病人记忆力下降的主要原因[3]。因此,提高脑损伤病人的脑功能的关键是重构神经网络结构,如促进神经突起再生和突触形成。因此,寻找基于重建损伤脑神经网络结构是抗痴呆药物研究的热点之一。
越来越多的证据表明磷脂酰肌醇3激酶(phosphoinositide-3 kinase,PI3K)/蛋白激酶 B(Akt)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)和细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号转导通路参与树突的形成和控制神经元胞体生长[4-5]。PI3K/Akt通过或与mTOR协同调节着突触可塑性和记忆形成[6]。
知母皂苷元(Sarsasapogenin,SAR)为中药知母的主要活性成分,已有研究表明知母皂苷具有提高多种拟痴呆动物的学习记忆功能[7]和对抗淀粉样β蛋白(amyloid β-protein,Aβ)引起的神经细胞凋亡的作用[8]。但关于SAR对神经元树突发育是否有促进作用,目前尚未见报道。本研究应用体外培养神经元观察SAR对正常树突发育是否有促进作用,并探讨其可能的信号转导机制。
1 材料与方法
1.1 药品和试剂 SAR,黄色粉末,纯度>98%,购于成都普瑞法科技开发有限公司,临用时用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解。DMEM、F12培养基购于 Invitrogen公司;DMSO、胰蛋白(Trypsin,1 ∶250)、L-多聚赖氨酸(Poly-L-lysine)均购于Sigma公司;新生胎牛血清、马血清购于广州蕊特生物科技有限公司;HEPES购于Calbiochem公司;阿糖胞苷购于意大利SPA公司;LY294002(#S1737)和Rapamycin(#S1842)购于碧云天生物技术研究所;mTOR Substrates Antibody Sampler Kit(#9862)、Phospho-Akt Pathway Antibody Sampler Kit(#9916)购于 CellSignaling公司;Triciribine(#SC200661)、山羊抗兔和山羊抗鼠二抗均购自Santa Cruz公司;β-肌动蛋白(β-actin)抗体购于 Beyotime试剂公司;SuperSignal West Pico化学发光底物购于美国Thermo Scientific公司。其他相关试剂均由辽宁医学院药理实验室提供。
1.2 大脑皮层神经元原代培养 取出生24 h以内的SD大鼠乳鼠(辽宁医学院动物实验中心提供),75%乙醇浸泡消毒,无菌条件下取出大脑皮层,置于培养基中,剔除血管和软脑膜,剪成1 mm3左右的小块。加入0.125%胰蛋白酶37℃消化10 min。待细胞分散后,加入含10%胎牛血清和10%马血清的DMEM/F12培养基终止消化。200目筛网过滤,1 000×g离心10 min,用含10%胎牛血清和10%马血清的DMEM/F12培养基制成细胞悬液,调整细胞密度为1 ×105~107·L-1,接种在铺有 L-多聚赖氨酸培养皿或6孔培养板中,置于37℃、5%CO2培养箱中培养。培养48 h后加入含阿糖胞苷(终浓度为5 mg·L-1)的培养基,抑制非神经细胞增殖。以后每3天换液1次。应用抗特异性稀醇化酶(NSE)多克隆抗体和抗神经丝蛋白(NF200)抗体免疫荧光染色进行神经元纯度鉴定,结果表明神经元纯度在90%以上。
1.3 神经元处理及树突形态学观察分析 实验分为正常对照组,培养4 d神经元加入0.1%的DMSO作用 48 h;SAR(10、30、100 μmol·L-1)组,培养 4 d神经元加入不同剂量的SAR,作用48 h;LY组,培养4 d神经元单独加入 LY294002(30 μmol·L-1)作用48 h;SAR 30+LY组:培养4 d神经元加入LY294002(30 μmol·L-1)作用 1 h,再加入 30 μmol·L-1的SAR共同作用48 h;TCBN组,培养4 d神经元单独加入 Triciribine(5 μmol·L-1)作用48 h;SAR 30+TCBN组:培养4 d神经元加入Triciribine(5 μmol·L-1)作用 1 h,再加入 30 μmol·L-1的SAR共同作用48 h;Rapa组,培养4 d神经元单独加入 Rapamycin(100 nmol·L-1)作用 48 h;SAR 30+Rapa组:培养4 d神经元加入Rapamycin(100 nmol·L-1)作用 1 h,再加入 30 μmol·L-1的 SAR共同作用48 h。
体外培养神经元用配置CCD和Tsview软件的Olympus CKX41型倒置相差显微镜,用10倍或20倍物镜观察以确保将一个神经元拍摄到一个视野中,用40倍物镜观察树突分支以确保能够清楚显示所有树突分支。分析时采取了Ohara和Havton的命名法[9]:从胞体直接伸出的树突分支为一级分支,从一级分支伸出的为二级分支,依次类推。用Image J软件测量随机选取的神经元,测量树突分支总长度(total dendrite branch length,TDBL),神经元一级树突分支数目(PDN)、神经元树突总分支数(maximum branch order,MAO)和神经元胞体面积。计数样本来自3个不同批次培养的神经元,每批次随机选取10~15个细胞。为了减少实验误差,实验采取双盲方法进行。
1.4 Western blot法检测磷酸化 PDK1、磷酸化Akt和磷酸化mTOR蛋白表达水平 原代培养的皮层神经元,经各种药物处理不同时间后,用冷的PBS冲洗,立即放入预冷的裂解缓冲液中(1%Triton,0.1%SDS,0.5%Deoxycholate,1 mmol·L-1EDTA,20 mmol·L-1Tris(pH 7.4),150 mmol·L-1NaCl,10 mmol·L-1NaF,0.1 mmol·L-1PMSF),4℃超声粉碎后,12 000×g离心30 min,取上清,用Lowry法测定蛋白质含量,以牛血清白蛋白(BSA)为标准品,将各组蛋白浓度调成一致。用10%SDSPAGE分离蛋白质,每个泳道蛋白上样量为20 μg。为了准确判断目的蛋白带的位置,一个泳道加See Blue Plus 2预染蛋白标记物,电泳后将PAGE凝胶中的蛋白质电转移至硝酸纤维素膜上,取出后将膜放入3%BSA阻断缓冲液中,封闭60 min,再用TBS〔10 mmol·L-1Tris(pH 8.0),150 mmol·L-1NaCl〕洗膜3次,每次10 min。将膜放入一抗中(抗体1∶1 000稀释),4℃过夜。TTBS冲洗后,将膜放入二抗(二抗均1∶1 000稀释)中,室温孵育1~2 h,用TTBS洗膜3次,每次10 min,将膜在SuperSignal West Pico底物工作液中孵育5 min,吸干多余试剂,放置化学发光凝胶系统分析仪中进行Ecl化学发光。测定p-PDK1、p-Akt(Ser473)和p-mTOR的蛋白表达的改变。然后应用蛋白漂洗液洗掉相应的蛋白,再应用总 PDK1、Akt、mTOR 抗体进行 PDK1、Akt、mTOR蛋白表达测定。同样应用蛋白漂洗液洗掉相应的蛋白,再应用β-肌动蛋白抗体进行β-肌动蛋白测定,以保证蛋白上样量的一致性。利用Visionworks 6.3.3图像采集及分析软件对蛋白带进行分析。实验重复3次。
2 结果
2.1 SAR促进皮层神经元树突发育作用 SAR(10、30、100 μmol·L-1)加入培养 4 d 神经元作用48 h后,可明显促进神经元树突发育,表现为神经元树突总长度明显增加、一级树突数目明显增多、最大分支级数明显增多及胞体面积增大,并呈明显浓度依赖性(Tab 1,Fig 1)。应用 PI3K阻断剂LY294002(30 μmol·L-1)、Akt阻断剂 Triciribine(5 μmol·L-1)及 mTOR 阻断剂 Rapamycin(100 nmol·L-1)加入培养4 d神经元作用1 h后,再加入SAR(30 μmol·L-1)共同作用 48 h,相差显微镜观察神经元树突发育结果显示:SAR 30+LY组、SAR 30+TCBN组、SAR 30+Rapamycin组的神经元树突总长度、一级树突数目、最大分支级数及胞体面积较SAR 30 μmol·L-1组 明显 降低;单 独应 用LY294002、Rapamycin组的神经元树突总长度、一级树突数目、最大分支级数及胞体面积较正常对照组没有明显的变化,但单独应用Triciribine可以使神经元的胞体变小(Tab 1,Fig 1)。

Fig 1 Effect of SAR on dendritic development in cortical neurons(×400)
2.2 SAR对皮层神经元磷酸化PDK1蛋白表达水平的影响 Fig 2 结果显示,SAR(30、100 μmol·L-1)组可明显增加神经元p-PDK1的蛋白表达水平。SAR 30+LY组明显降低神经元p-PDK1的蛋白表达水平。单独应用LY294002组使神经元p-PDK1的蛋白表达水平有所降低,但差异无统计学意义(Fig 2)。

Fig 2p-PDK1 protein expression increased by SAR(±s,n=3)
2.3 SAR对皮层神经元磷酸化Akt473蛋白表达水平的影响 Fig 3结果显示,SAR可明显增加神经元p-Akt473的蛋白表达水平。SAR 30+LY组及SAR 30+TCBN组明显降低神经元p-Akt473的蛋白表达水平。单独应用 LY294002组对神经元 p-Akt473的蛋白表达水平没有影响,而单独应用TCBN组完全抑制神经元p-Akt473的蛋白表达水平(Fig 3)。
2.4 SAR对皮层神经元磷酸化mTOR蛋白表达水平的影响 Fig 4结果显示,SAR可明显增加神经元p-mTOR的蛋白表达水平。SAR 30+LY组,SAR 30+TCBN组及SAR 30+Rapa组明显降低神经元 p-mTOR的蛋白表达水平。单独应用LY294002组及TCBN组对神经元p-mTOR的蛋白表达水平没有影响,而单独应用Rapa组完全抑制神经元p-mTOR的蛋白表达水平(Fig 4)。
3 讨论
神经元具有形态复杂的树突结构,一个神经元有一个或多个树突,呈光滑的锥体状从胞体发出,树突干一般呈锐角反复分支,越分越细,多数树突干附有树突棘。树突的功能是接收整合临近神经细胞的传入信息,树突分支结构和生物物理特性决定了突触输入输出的过程,分支的长度、数目、直径等可反映细胞的功能状态,而许多营养因子和应激可影响树突发育,进而影响神经环路的形成和功能。已有研究表明,在多种神经退行性疾病中都伴有树突树和树突棘损伤导致神经环路的功能障碍,如AD病人记忆力下降的主要原因被认为是海马和皮层神经突触丢失及神经突起功能障碍。
Tab 1 Dendritic development in cortical neurons increased by SAR(±s,n=30)

Tab 1 Dendritic development in cortical neurons increased by SAR(±s,n=30)
*P <0.05,**P <0.01 vs control;#P <0.05,##P <0.01 vs SAR 30 μmol·L-1
Group Dose/μmol·L -1 TDBL/μm PDN MBO Soma area/μm2 Control 258 ±22 3.36 ±0.92 2.12 ±0.45 51.6 ±5.5 SAR 10 369 ±25** 4.67 ±0.90** 2.28 ±0.81* 63.3 ±4.9**30 420 ±23** 5.18 ±0.93** 2.78 ±0.45** 89.9 ±16.2**100 503 ±58** 5.89 ±0.13** 3.16 ±0.52** 100.3 ±8.5**LY 30 267 ±26 2.94 ±0.21 2.15 ±0.34 45.3 ±7.7 SAR 30+LY 362 ±38# 4.13 ±0.2## 2.42 ±0.24# 39.9 ±13.4##TCBN 5 262 ±27 3.48 ±0.24 2.09 ±0.54 41.5 ±5.1 SAR 30+TCBN 302 ±23## 3.42 ±0.25## 2.34 ±0.19## 36.8 ±8.3##Rapa 0.1 273 ±24 3.54 ±0.7 2.11 ±0.29 49.6 ±5.7 SAR 30+Rapa 327 ±25## 3.28 ±0.19## 2.46 ±0.36# 57.9 ±7.2#
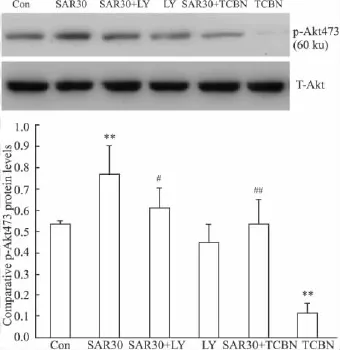
Fig 3p-Akt protein expression increased by SAR(±s,n=3)

Fig 4p-mTOR protein expression increased by SAR(±s,n=3)
PI3K/Akt通过或与mTOR协同调节着突触可塑性和记忆形成。PI3K[10]是由调节亚基p85和催化亚基p110组成的异源二聚体,静息状态下普遍存在于胞质中,当接受来自酪氨酸激酶和G蛋白偶联受体的信号后被激活,聚集到细胞膜上把底物Ptd Ins(4,5)P2(PIP2)转化为 Ptd Ins(3,4,5)P3(PIP3)。PIP3作为第二信使,激活下游的Akt蛋白等。Akt蛋白为细胞内反转录病毒v-Akt的同源物所编码一种蛋白激酶,在静息细胞中大部分位于胞质中。由于与PKA和PKC有相似性,所以又被称为蛋白激酶B(PKB)。活化后的PI3K在膜上生成PIP3,PIP3通过与Akt蛋白的PH结构域的相互作用,聚集Akt蛋白到膜上,在3-磷脂酰肌醇依赖性蛋白激酶(PDK1)的帮助下,通过使Akt蛋白上的苏氨酸磷酸化位点(Thr308)和丝氨酸磷酸化位点(Ser473)磷酸化而使其激活。激活后的Akt蛋白再转位到胞质中或胞核内,通过对一系列底物的磷酸化,使其下游的mTOR激活,它们共同调节突触的形成与连接。
随着国际老龄化,老年性痴呆患者逐渐增多,世界医学界越来越重视采用天然药物防治老年性痴呆。SAR是从中草药知母中提取分离的有效成分,对老年性痴呆有一定治疗作用,能改善患者学习记忆能力。我们实验室研究已表明SAR可通过抑制Akt/PKB信号转导通路,发挥抑制炎症因子的释放而起到保护神经细胞的作用[11]。本研究表明,SAR可明显促进神经元树突发育,表现为神经元树突总长度明显增加、一级树突数目明显增多、最大分支级数明显增多及胞体面积增大,并呈明显浓度依赖性。而应用各阻断剂后,SAR 30+各阻断剂组的神经元树突总长度、一级树突数目、最大分支级数及胞体面积明显降低,结果表明SAR促进树突发育的作用可能与PI3K/Akt/mTOR信号转导通路有关。通过测定p-PDK1、p-Akt473及p-mTOR的蛋白表达变化进一步说明SAR对树突发育的促进作用与PI3K/Akt/mTOR信号转导通路有关。我们将更深入的探讨研究,为AD病人的治疗提供更广阔的思路。
[1] Miller F D,Kaplan D R.Signaling mechanisms underlying dendrite formation[J].Curr Opin Neurobiol,2003,13(3):391 -8.
[2] Kumar V,Zhang M X,Swank M W,et al.Regulation of dendritic morphogenesis by Ras-PI3K-Akt-mTOR and Ras-MAPK signaling pathways[J].J Neurosci,2005,25(49):11288 - 99.
[3] McKee A C,Kosik K S,Kowall N W.Neuritic pathology and dementia in Alzheimer's disease[J].Ann Neurol,1991,30(2):156-65.
[4] Dijkhuizen P A,Ghosh A.BDNF regulates primary dendrite formation in cortical neurons via the PI3-kinase and MAP kinase signaling pathways[J].J Neurobiol,2005,62(2):278 - 88.
[5] Jaworski J,Spangler S,Seeburg D P,et al.Control of dendritic arborization by the phosphoinositide-3'-kinase-Akt-mammalian target of rapamycin pathway[J].J Neurosci,2005,25(49):11300-12.
[6] Cammalleri M,Lütjens R,Berton F,et al.Time-restricted role for dendritic activation of the mTOR-p70S6K pathway in the induction of late-phase long-term potentiation in the CA1[J].Proc Natl Acad Sci USA,2003,100(24):14368-73.
[7] 刘 卓,金 英,刘婉珠,等.知母皂苷对脂多糖引起的大鼠学习记忆障碍和炎症反应的影响[J].中国药理学通报,2010,26:1362-6.
[7] Liu Z,Jin Y,Liu W Z,et al.Effects of SAaB on LPS-induced learning and memory disorders and inflammatory reaction in rat hippocampus[J].Chin Pharmacol Bull,2010,26(10):1362 -6.
[8] Liu Z,Jin Y,Yao S Y,et al.Saponins from Anemarrhena asphodeloides Bge protects neurons from amyloid β-protein fragment 25-35-induced apoptosis[J].Chin J Pharmacol Toxicol,2006,20:295-304.
[9] Havton L A,Ohara P T.Quantitative analyses of intracellularly characterized and labeled thalamocortical projection neurons in the ventrobasal complex of primates[J].J Comp Neurol,1993,336(1):135-50.
[10] Shankar S,Srivastava R K.Involvement of Bcl-2 family members,phosphatidylinositol 3'-kinase/AKT and mitochondrial p53 in curcumin(diferulolylmethane)-induced apoptosis in prostate cancer[J].Int J Oncol,2007,30(4):905 -18.
[11]刘 卓,金 英,隋海娟,闫恩志.知母皂苷对Aβ25-35引起的巨噬细胞炎症介质释放的抑制作用及信号转导机制[J].中国药理学通报,2011,27(5):695 -700.
[11] Liu Z,Jin Y,Sui H J,Yan E Z.Effect and signaling mechanism of SAaB on the Aβ25-35-induced release of inflammatory mediators in cultured macrophages[J].Chin Pharmacol Bull,2011,27(5):695-700.

