扇贝多肽对UVA损伤HaCaT细胞UCP2表达及线粒体功能的影响
王春波,孙 霞,李金莲,韩彦弢,陈雪红,谢 靖
(1.青岛大学医学院,山东青岛 266071;2.滨州医学院,山东 烟台 264003)
线粒体是细胞生命活动的控制中心,它不仅是细胞呼吸链和氧化磷酸化的中心,而且是细胞凋亡的调控中心。解偶联蛋白2(uncoupling protein 2,UCP2)是线粒体内膜质子转运蛋白家族的成员之一,在哺乳动物多种组织中广泛表达,通过使氧化磷酸化解偶联,降低线粒体内膜电势,减少细胞内活性氧(reactive oxygen species,ROS)的产生,参与多种组织的抗氧化应激损伤[1-2]。研究已证实[3],UVA主要是通过诱导角质形成细胞内ROS过度积累而引发凋亡的,高浓度的ROS极易氧化损伤线粒体内膜、DNA等超微结构,导致线粒体功能丧失,最终引起细胞氧化损伤。紫外线照射对UCP2是否会有影响,UCP2在UVA诱导的HaCaT细胞损伤中有何作用?目前国内外尚未见报道。本实验旨在观察UVA照射后HaCaT细胞UCP2表达的变化,并应用海洋抗氧化剂扇贝多肽(polypeptide from Chlamys farreri,PCF),观察其对 UVA照射后 ROS释放、UCP2表达及线粒体凋亡途径、线粒体呼吸链复合酶活性的影响,探究扇贝多肽对UVA损伤HaCaT细胞线粒体功能的保护作用。
1 材料与方法
1.1 主要试剂和器材 PCF由中国水产科学研究院黄海水产研究所分离纯化;DMEM培养基、胰蛋白酶购自Gibco公司;胎牛血清购自杭州四季青公司;UCP2多克隆抗体购自Millipore公司;Apaf-1、Cyt C多克隆抗体购自Cell Signaling公司;β-actin抗体购自北京博奥森生物技术有限公司;线粒体提取试剂盒购自北京索莱宝科技有限公司;线粒体呼吸链复合物I活性定量检测试剂盒购自Genmed公司。紫外辐照仪由北京师范大学光电仪器厂制造。
1.2 细胞培养 永生化人角质形成细胞株HaCaT由韩国延世大学医学院病理教研室惠赠。HaCaT细胞用DMEM培养液(含体积分数为0.10的胎牛血清、1 ×105U·L-1青霉素钠、1 ×105U·L-1硫酸链霉素),置于37℃、含体积分数为5%CO2的细胞培养箱中常规培养。
1.3 实验分组及UVA照射 将处于指数生长期的细胞随机分组:① 对照组:正常培养的细胞;②模型组:UVA辐射损伤的细胞;③PCF组:预先在细胞培养液中加入不同浓度的PCF预孵育2 h后再经UVA照射。PCF设有 5.69、2.84和 1.42 mmol·L-13个浓度。
UVA照射剂量为8 J·cm-2。将细胞接种于6孔板进行培养,待细胞进入指数生长期,融合达0.80以上时,用铝箔盖住对照组细胞进行UVA照射。照射时弃去旧培养液,用D-Hanks冲洗2次,每孔入2 ml D-Hanks液覆盖细胞。照射结束后,换新鲜培养液根据实验需求置于培养箱培养适宜时间。
1.4 电子自旋共振 (electron spin resonance,ESR)检测ROS释放量 每组取1×108细胞,用含10 mmol·L-1PBN、2 mmol·L-1DETAPAC 的磷酸HEPES缓冲液冰浴匀浆,离心后取上清1.4 ml,分别加入0.5 mol·L-1Na2S2O4,0.6 mol·L-1DETC,10 mmol·L-1L-Arg,0.3 mol·L-1FeSO4各 30 μl,37℃水浴30 min;迅速放于冰上,加入0.3 ml乙酸乙酯,振荡后离心8 min,取上清测定。检测条件:中心磁场3385 G,微波功率20 mW,扫宽400 G,放大倍数4×105。
1.5 Western blot 细胞按实验分组经UVA照射处理后,弃去旧培养液用预冷的D-Hanks冲洗3次后将培养板置于冰上,每孔约1×106个细胞加100 μl裂解液冰上裂解30 min,裂解充分后,将细胞刮下置于1.5 ml离心管中,4℃、12 000×g离心 5 min,收集上清,即为细胞总蛋白质。线粒体及胞质蛋白的提取按说明书操作,用于Cyt C释放及线粒体UCP2表达、呼吸链复合酶Ⅰ活性的检测。
BCA法测定蛋白浓度,变性聚丙烯酰胺凝胶电泳,转膜,然后将NC膜置于封闭液中室温封闭1~2 h,一抗(β-actin 1 ∶400,Apaf-1、Cyt C、UCP2 均为 1∶1 000)4℃孵育过夜。TBST洗涤3次,每次5 min;按照1∶1 000的比例加入辣根过氧化物酶标记羊抗兔IgG,37℃孵育40 min;TBST洗涤3次,每次5 min。DAB显色,凝胶分析软件Quantity one进行灰度分析。
1.6 流式细胞仪测定线粒体膜电位 按实验设计分组并处理细胞后,收集各组细胞,加入终浓度10 mg·L-1的 Rh123,37℃ 避光孵育 30 min,PBS 洗涤2次以去除未结合的染料,加 PBS 300 μl,混匀,流式细胞仪测定其平均荧光强度。
1.7 紫外分光光度法检测呼吸链复合酶Ⅰ的活性
取线粒体蛋白 5~10 μg,于 -20℃/20℃ 反复冻融3次以达到最大反应速度,按照试剂盒说明书测定340 nm处NADH的吸收值表示呼吸链复合酶Ⅰ的活性。
2 结果
2.1 UVA照射HaCaT细胞后UCP2蛋白表达的变化 UVA 照射后不同时间点(1、3、6、8、12、24 h)收集细胞,Western blot检测UVA照射后HaCaT细胞线粒体中UCP2蛋白表达的经时变化。结果如Fig 1所示,正常组细胞线粒体UCP2表达很少,UVA照射后1 h未见明显变化,照射后3 h表达增加并达到高峰,随后又逐渐下降,24 h时表达水平与1 h基本一致。
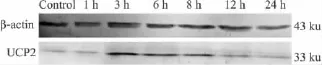
Fig 1 Changes of UCP2 protein expression after UVA radiation in mitochondria of HaCaT cells
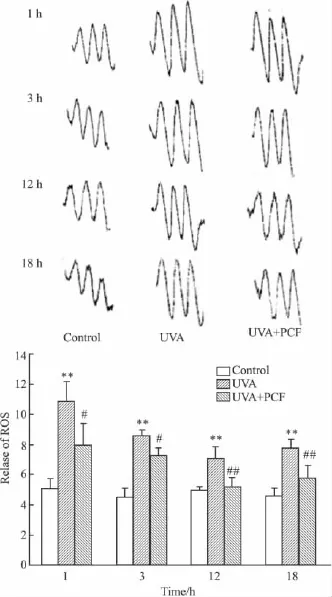
Fig 2 Effect of PCF on ROS release in HaCaT cells after UVA radiation(±s,n=3)
2.2 PCF对UVA照射后HaCaT细胞ROS释放的影响 分别于UVA照射后1、3、12、18 h收集细胞。PCF组于照射前 2 h加入 2.84 mmol·L-1PCF。ESR检测ROS的释放,ROS释放量以3个释放波峰值的平均值表示。结果如Fig 2所示,UVA照射后1 h ROS即迅速升高,随后有所降低。PCF对各检测时间点ROS的释放均有抑制作用,12 h和18 h作用最强。
2.3 PCF对UVA照射后HaCaT细胞UCP2蛋白表达的影响 根据上述实验结果,在UVA照射后3 h UCP2表达为高峰,因此实验选用3 h作为观察PCF作用的时间点。UCP2表达水平以UCP2与βactin光密度比值表示,结果如Fig 3所示,UVA照射后3h线粒体UCP2表达量明显增加,与正常组相比差异有显著性(P<0.01);PCF预孵育能降低UCP2的表达,与模型组相比差异有显著性(P<0.01),且有随剂量增加作用增强的趋势。ROS抑制剂NAC预孵育亦明显降低了UCP2的表达。

Fig 3 Effect of PCF on UVA-induced UCP2 protein
2.4 PCF对UVA照射后HaCaT细胞线粒体膜电位的影响 流式细胞仪分析结果显示(Fig 4),UVA照射后,HaCaT细胞内Rh123荧光强度明显下降(P<0.01),表明线粒体跨膜电位下降,提示UVA照射对HaCaT细胞线粒体膜造成了损伤,经过PCF预孵育的细胞线粒体跨膜电位有明显的提高。
2.5 PCF对UVA照射后HaCaT细胞Cyt C蛋白表达的影响 Western blot分别检测HaCaT细胞胞质和线粒体内Cyt C的蛋白表达水平。Fig 5结果显示,UVA照射HaCaT细胞后18 h,与正常对照组相比,模型组HaCaT细胞线粒体内Cyt C表达降低,而胞质内Cyt C表达明显增高(P<0.01),说明UVA照射诱导了HaCaT细胞CytC的释放。与模型组相比较,PCF抑制了UVA诱导的HaCaT细胞线粒体内Cyt C的减少和胞质内Cyt C表达的增加,表明PCF可抑制Cyt C从线粒体向胞质的转移。
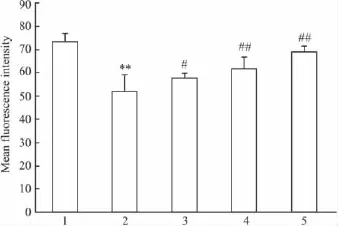
Fig 4 Effect of PCF on mitochondria membrane
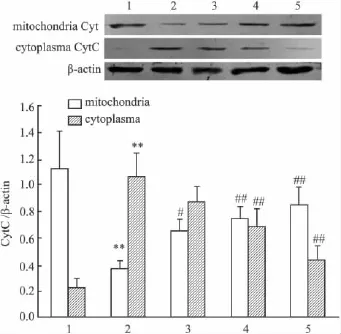
Fig 5 Effect of PCF on UVA-induced Cyt C release in HaCaT cells(±s,n=3)
2.6 PCF对UVA照射后HaCaT细胞Apaf-1蛋白表达的影响 UVA照射后18 h收集细胞,Western blot检测各组细胞Apaf-1蛋白表达水平,以Apaf-1与β-actin光密度比值表示。Western blot结果显示(Fig 6),UVA模型组与正常对照组相比较,Apaf-1蛋白水平明显增加(P<0.01),与UVA模型组相比,除低剂量PCF组(1.42 mmol·L-1)外,中、高剂量PCF均能明显抑制Apaf-1的表达(P<0.01)。
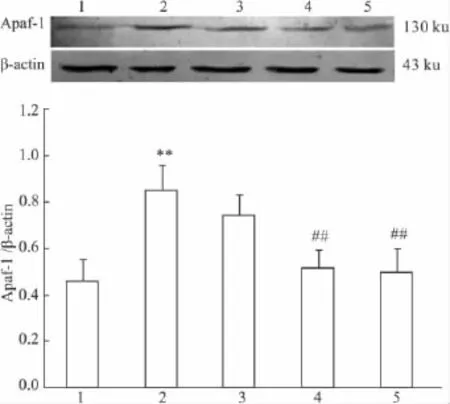
Fig 6 Effect of PCF on UVA-induced Apaf-1 expression in HaCaT cells(±s,n=3)
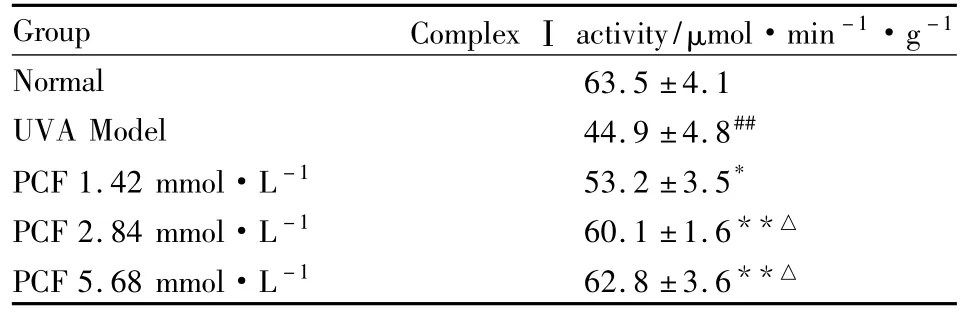
2.7 PCF对UVA照射后HaCaT细胞呼吸链复合酶Ⅰ活性的影响 紫外分光光度法检测呼吸链复合酶I的活性,结果显示,UVA模型组呼吸链复合酶I的活性明显下降(P<0.01),预先加入PCF孵育的各组细胞呼吸链复合酶I活性的下降被抑制,与模型组比较差异有显著性(P<0.05,P<0.01)。见Tab 1。
Tab 1 Effect of PCF on the activity of complexⅠof respiratory chain in HaCaT cells after UVA radiation(±s,n=9)
Tab 1 Effect of PCF on the activity of complexⅠof respiratory chain in HaCaT cells after UVA radiation(±s,n=9)
##P<0.01 vs control;*P<0.05,**P<0.01 vs UVA model;△P<0.05 vs 1.42 mmol·L-1PCF
Group Complex Ⅰ activity/μmol·min-1·g -1 Normal 63.5 ±4.1 UVA Model 44.9 ±4.8##PCF 1.42 mmol·L-1 53.2 ±3.5*PCF 2.84 mmol·L-1 60.1 ±1.6**△PCF 5.68 mmol·L-1 62.8 ±3.6**△
3 讨论
线粒体主要功能之一是通过氧化磷酸化作用,把各种能量转换成ATP。线粒体解偶联蛋白2(UCP2)是位于线粒体内膜上的质子转运体,具有使线粒体呼吸链与ADP的磷酸化解偶联的作用[1]。研究表明,UCP2参与了ROS的调控:外源产生的过氧化物能够在细胞体系中激活UCP2依赖的质子漏[4],导致线粒体内膜电势下降,降低了ROS的水平,限制了线粒体内过氧化物的产生,以保护机体免受过氧化损伤。
既然ROS在UVA照射后会大量产生,UVA照射是否会影响UCP2的表达还未见报道。本实验通过Western blot检测UVA照射HaCaT细胞后不同时间点线粒体中UCP2蛋白表达的变化,结果发现,正常HaCaT细胞表达UCP2很少,UVA照射后细胞线粒体UCP2表达升高,3 h即达最高值,随后逐渐下降。采用ROS抑制剂NAC预孵育HaCaT后再经UVA照射,UCP2表达明显降低。参考文献报道并分析认为[1-2,4],UVA 照射后产生的 ROS 或过氧化物是刺激UCP2表达的因素之一,UCP2表达的增高增强了线粒体呼吸链与ADP磷酸化的解偶联作用,从而降低线粒体内膜质子电化学梯度,ROS产生减少。HaCaT细胞通过增加UCP2的表达来抑制UVA诱导的ROS的产生,是一种自身负反馈调节机制。
扇贝多肽是自海洋贝类废弃物中提取的海洋抗氧化多肽,可抑制 UVA诱导的 HaCaT细胞凋亡[5-6]。实验中采用ESR技术直接检测ROS的释放情况,证实了PCF对 UVA引起的ROS的产生和释放有明显的抑制作用。Western blot检测PCF对UCP2表达的影响,发现应用不同剂量 PCF后,UCP2的蛋白表达量与UVA模型组相比都有明显降低,可能是由于PCF抑制了UVA照射后ROS的产生或过氧化物的生成从而减弱了ROS对UCP2表达的刺激作用。
UCP2的解偶联作用对细胞的影响是两方面的[7]:一方面降低了ROS的产生,起保护细胞的作用,如文献报道[8],UCP2高表达能够抑制细胞因ROS产生增多而引起的凋亡;另一方面也使得细胞内ATP合成减少,使细胞无法获得足够的ATP以抵御伤害性刺激。哪一方面起主要作用会根据细胞的种类和所受刺激的不同而不同,在某些情况下后者对细胞的影响可能更为明显[9]。前期实验证实应用PCF后UVA诱导的细胞凋亡是降低的,说明PCF并未因其减弱UCP2的表达而增加细胞凋亡,也说明UVA照射后UCP2的高表达对细胞的影响可能第二方面是主要的,这还需要进一步的实验证实。
线粒体是细胞内ROS来源的一个主要途径,也是ROS攻击的主要目标。本实验以流式细胞术检测HaCaT细胞线粒体膜电位,发现 UVA损伤HaCaT细胞引起线粒体膜电位明显下降,而PCF则剂量依赖性升高线粒体膜电位。同时,PCF对UVA照射引起的细胞色素C的释放及Apaf-1的蛋白表达也起到了有效的抑制作用。课题组前期实验结果已经证实了PCF对UVA诱导的caspase-3活化的抑制作用[10],综合本次实验结果可以表明,PCF能够抑制UVA照射后ROS的产生,从而保护线粒体膜,抑制线粒体Cyt C/Apaf-1/caspase-3凋亡通路。
线粒体内发生的主要代谢是氧化磷酸化,它是位于线粒体内膜上的呼吸链功能的主要表现,也是细胞内ROS来源的一个主要途径。呼吸链中复合酶Ⅰ(NADH-辅酶Q还原酶)和复合酶Ⅲ(辅酶Q-细胞色素C还原酶)是产生超氧阴离子的主要部位,复合酶Ⅰ是呼吸链中最大的、也是第一个复合体,早有研究证实线粒体呼吸链复合酶I的抑制剂可诱导细胞凋亡[11-12]。本实验通过紫外分光光度法检测线粒体呼吸链复合酶I的活性,进一步探讨UVA辐射对HaCaT细胞线粒体功能的影响及PCF是否具有调节作用。结果显示,UVA模型组呼吸链复合酶I的活性明显下降,而预先加入PCF孵育的细胞呼吸链复合酶I活性的下降被抑制,说明PCF也可以通过提高呼吸链复合酶I的活性,减少ROS的生成,从而抑制UVA引起的细胞损伤。
综合上述实验结果可以推测,PCF可以增强UVA照射后线粒体呼吸链复合酶的活性,抑制ROS的产生,减弱ROS对线粒体的损伤,抑制线粒体CytC/Apaf-1/caspase-3凋亡通路,最终达到抑制细胞凋亡的作用。虽然PCF也可抑制UVA照射引起的UCP2表达增加,减弱细胞的自身负反馈调节,但对细胞活性没有产生明显的影响。
[1] Mehta S L,Li P A.Neuroprotective role of mitochondrial uncoupling protein 2 in cerebral stroke[J].J Cereb Blood Flow Metab,2009,29(6):1069-78.
[2] Cannon B,Shabalina I G,Kramarova T V,et al.Uncoupling proteins:a role in protection against reactive oxygen species--or not[J].Biochim Biophys Acta,2006,1757(5-6):449 -58.
[3] Svobodova A,Zdarilova A,Maliskova J,et al.Attenuation of UVA-induced damage to human keratinocytes by silymarin[J].J Dermatol Sci,2007,46(1):21-30.
[4] Echtay K S,Roussel D,St-Pierre J,et al.Superoxide activates mitochondrial uncouplingproteins[J]. Nature,2002,415(6867):96-9.
[5] 窦 梅,初 晓,张 杰,等.扇贝多肽保护单次UVA氧化损伤HaCaT细胞[J].中国药理学通报,2006,22(4):416-20.
[5] Dou M,Chu X,Zhang J,et al.Polypeptide from chlamys farreri protect HaCaT cells from single UVA induced oxidative damages[J].Chin Pharmacol Bull,2006,22(4):416 -20.
[6] 王贞丽,李金莲,王春波.肿瘤坏死因子相关凋亡诱导配体及扇贝多肽在UVA诱导HaCaT细胞凋亡中的作用[J].中国药理学通报,2007,23(10):1375-9.
[6] Wang Z L,Li J L,Wang C B.The role of tumor necrosis factor related apoptosis inducing ligand and polypeptide from Chlamys farreri in UVA-induced apoptosis in HaCaT cells[J].Chin Pharmacol Bull,2007,23(10):1375 -9.
[7] Bodyak N,Rigor D L,Chen Y S,et al.Uncoupling protein 2 modulates cell viability in adult rat cardiomyocytes[J].Am J Physiol Heart Circ Physiol,2007,293(1):H829 -35.
[8] Collins P,Jones C,Choudhury S,et al.Increased expression of uncoupling protein 2 in HepG2 cells attenuates oxidative damage and apoptosis[J].Liver Int,2005,25(4):880 - 7.
[9] 万赤丹,王宏博,冯贤松,等.解偶联蛋白2过度表达对L02肝细胞缺血再灌注损伤的影响[J].华中科技大学学报(医学版),2008,37(4):469-72.
[9] Wan C D,Wang H B,Feng X S,et al.Effect of UCP-2 over-expression on ischemia-reperfusion-induced injury of human hepatocyte strain L02[J].Acta Med Univ Sci Technol Huazhong,2008,37(4):469-72.
[10] Li J L,Liu N,Chen X H,et al.Inhibition of UVA-induced apoptotic signaling pathway by polypeptide from Chlamys farreri in human HaCaT keratinocytes[J].Radiat Environ Biophys,2007,46(3):263-8.
[11] Wolvetang E J,Johnson K L,Krauer K,et al.Mitochondrial respiratory chain inhibitors induce apoptosis[J].FEBS Lett,1994,339(1-2):40-4.
[12] Higuchi M,Proske R J,Yeh E T.Inhibition of mitochondrial respiratory chain complex I by TNF results in cytochrome C release,membrane permeability transition,and apoptosis[J].Oncogene,1998,17(19):2515-24.

