中国被毛孢菌丝体提取物抗肾损伤作用体内外实验研究
沈龙海,安泳潼,杨庆尧,杨晓彤,沈 旭,丁 宏
(1.上海医药工业研究院创新药物与制药工艺国家重点实验室,上海 200437;2.上海芝草生物技术有限公司,上海 200233;3.中国科学院上海药物研究所,上海 201203)
冬虫夏草是我国传统的药用真菌,作为强壮滋补药物。但天然虫草产量很低,资源紧缺,价格高昂,利用液体深层发酵培养冬虫夏草菌丝体、提取物或发酵液,是解决冬虫夏草药源的一种有效途径[1]。中国被毛孢菌丝体提取物(HSW)是以发酵工艺生产而取得的冬虫夏草替代品。冬虫夏草可增强机体免疫力、减轻皮质线粒体损伤,从而改善肾功能[2]。本研究采用体外培养的人肾小管上皮细胞株(HK2)模型,观察HSW对于肾衰竭相关功能指标的影响,并在庆大霉素致急性肾衰竭(ARF)模型上验证HSW的作用。
1 材料与方法
1.1 药品与试剂 HK2:由中国科学院上海药物研究所沈旭课题组传代培养。中国被毛孢菌丝体提取物(Hirsutella sinensis extract,HSW),由上海芝草生物技术有限公司实验室保存菌株yy090701经深层发酵水提获得,批号:yyHs-E201005。马兜铃酸(aristolochic acid,AA)、黄亮硫罗丹明(SRB)购自Sigma 公司。Premix Ex Taq、RNAiso plus、Primescript RT reagent kit购自TaKaRa;DEPC水购自碧云天生物公司。庆大霉素注射液,上海现代哈森(商丘)药业有限公司生产,批号:10040512。
1.2 仪器 荧光定量实时检测PCR仪、PCR仪,购自MJ Rearch,酶标仪购自 Bio-red。HITACHI7080生化自动分析仪,和光(WAO)试剂,由和光纯药工业株式会社制造。
1.3 实验动物 50只♂ SD大鼠,体质量180~200 g,由上海西普尔-必凯实验动物有限公司提供[SCXK(沪)2008-0016],SPF 级。
1.4 方法
1.4.1 HSW基于HK2细胞模型肾损伤的体内研究
1.4.1.1 HSW对马兜铃酸造成的细胞损伤的逆转作用 HK2细胞点板于96孔细胞培养板中,过夜培养,加入 10、20 mg·L-1马兜铃酸,同时做空白对照,检测孔加入 HSW,浓度为 10、20 mg·L-1,置于细胞培养箱中孵育48 h,除去培养基,用10 μmol·L-1冰醋酸固定细胞,100 μl/孔,4 ℃ 1 h,去除晾干,用 SRB 进行染色,室温,15 min,用 0.17 mol·L-1冰醋酸洗除多余染料,10 mmol·L-1Tris溶解细胞,于酶标仪515 nm处测值。
1.4.1.2 肾衰竭相关指标基因 mRNA水平检测HK2细胞点板于6孔细胞培养板中,过夜培养,加入10 mg·L-1马兜铃酸,同时做空白对照,检测孔加入HSW,浓度为10、20 mg·L-1,置于细胞培养箱中孵育24 h,用RT-PCR法测定,按试剂盒说明提取细胞总RNA,并逆转录成cDNA,分别加TGFβ1(转化生长因子β1)、PAI-1(纤溶酶原激活物抑制物)与βactin引物(内参照)共扩增。反应条件如下:95℃预变性5 s,95℃变性5 s,60 ℃退火20 s,72 ℃ 10 s,80 ℃ 延伸1 s,39 个循环,72 ℃ 延伸 10 min。用Option Monitor2分析结果,以目的基因相对表达量表示实验结果。
1.4.2 HSW对庆大霉素诱导的大鼠肾衰竭的预防作用研究 SD大鼠50只,随机分为5组(n=10):为模型对照组、空白对照组(给予等量生理盐水)、HSW 低(0.2 g·kg-1)、HSW 中(1 g·kg-1)、HSW高(3 g·kg-1)剂量组。除空白对照组外其余各组肌肉注射庆大霉素造模,每天1次,连续7 d。造模的同时每天按分组灌服药物,末次给药后1 h将大鼠用3%速可眠麻醉、腹主动脉采血,测定血尿素氮(BUN)、血肌酐(SCr)。同时取肾脏组织标本,经固定液固定后,作常规组织切片,置光镜下作病理检查。
1.5 统计学处理 各项定量指标采用均数两组间t检验进行统计学检验,数据用±s表示。
2 结果
2.1 HSW基于HK2细胞模型肾损伤的体内药效研究
2.1.1 HSW对马兜铃酸造成的细胞损伤的逆转作用 HSW可以逆转马兜铃酸(10、20 mg·L-1)对肾细胞所造成的损伤(P<0.05),见Tab 1。
Tab 1 Reversal effects of HSW on the cell damage caused by AA(±s)
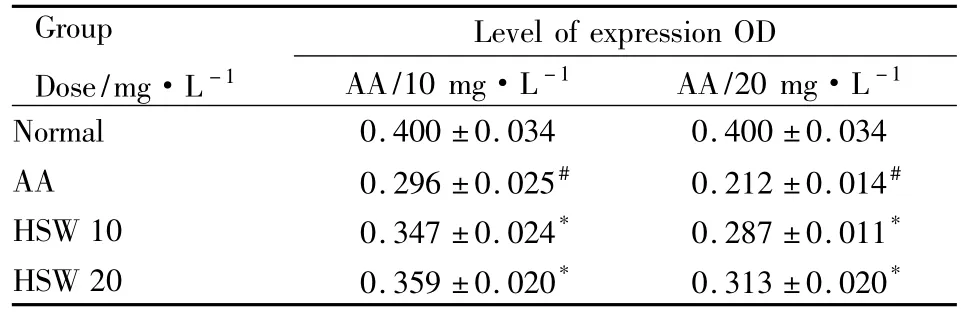
Tab 1 Reversal effects of HSW on the cell damage caused by AA(±s)
#P<0.05 vs normal;*P<0.05 vs AA
Group Dose/mg·L-1 Level of expression OD AA/10 mg·L -1 AA/20 mg·L -1 Normal 0.400 ±0.034 0.400 ±0.034 AA 0.296 ±0.025# 0.212 ±0.014#HSW 10 0.347 ±0.024* 0.287 ±0.011*HSW 20 0.359 ±0.020* 0.313 ±0.020*
2.1.2 肾衰竭相关指标基因mRNA水平检测结果HSW可使AA作用下的HK2细胞的TGFβ1、PAI-1水平的增加得以部分恢复(P<0.05),见Tab 2。
2.2 HSW对庆大霉素诱导的大鼠肾衰竭的预防作用
2.2.1 生化指标检测 模型对照组BUN、SCr较正常组明显地升高。HSW各给药组BUN、SCr明显下降。HSW 3个剂量组可明显地降低BUN、SCr水平(P<0.01),高剂量组作用最为明显。数据表明:HSW对庆大霉素诱导的急性肾衰竭有明显的预防作用(Tab 3)。
2.2.2 病理检测 肉眼观察:除正常组外,肾脏均呈苍白色,体积略增大,切面皮质增厚,质地尚可。
病理检测评价:模型组肾小管上皮细胞中度变性或坏死,管腔内出现蛋白或颗粒管型。肾间质出血灶及炎细胞浸润较多,提示造模成功。HSW低剂量组的肾小管上皮细胞有轻度的变性和坏死。高剂量组的肾小球无出血,球囊腔有少许纤维蛋白渗出,肾间质内有少量出血灶及炎细胞浸润。正常对照组的肾组织结构正常,肾小管上皮细胞无变性或坏死,管腔内无变形。肾间质内无出血及炎细胞浸润(Fig 1)。
Tab 2 Effects of HSW on the expressions of TGFβ1 and PAI-1 on HK2cells(±s)
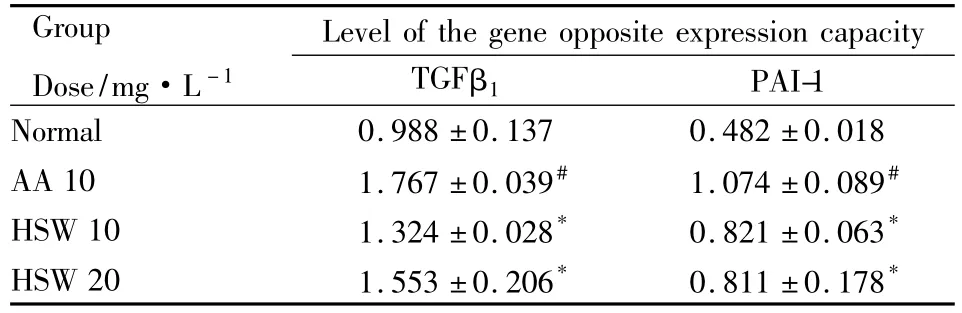
Tab 2 Effects of HSW on the expressions of TGFβ1 and PAI-1 on HK2cells(±s)
#P<0.05 vs normal;*P<0.05 vs AA
Group Dose/mg·L-1 Level of the gene opposite expression capacity TGFβ1PAI-1 Normal 0.988 ±0.137 0.482 ±0.018 AA 10 1.767 ±0.039# 1.074 ±0.089#HSW 10 1.324 ±0.028* 0.821 ±0.063*HSW 20 1.553 ±0.206* 0.811 ±0.178*
Tab 3 Preventive effects of HSW on ARF caused by gentamicin(±s,n=10)

Tab 3 Preventive effects of HSW on ARF caused by gentamicin(±s,n=10)
##P <0.01 vs normal;**P <0.01 vs control
Group Dose/g·kg-1BUN/mmol·L -1 SCr/μmol·L -1 HSW 0.2 17.1 ±9.2** 61.3 ±36.5**1 17.5 ±8.8** 61.4 ±36.3**3 8.4 ±1.0** 29.2 ±4.7**Control 45.1 ±15.6## 226.7 ±116##Normal 7.4 ±0.4 21.3 ±1.3

Fig 1 Effects of HSW on histomorphology change of kidney damaged by gentamicin under the inverted microscope (HE x200)A:Normal;B:Control;C:HSW(3 g·kg-1)
3 讨论
中国被毛孢为合格冬虫夏草的无性型[3],中国被毛孢菌丝体可经人工发酵的方式获取,在一定程度上缓解天然虫草药源短缺的问题。本研究中所用中国被毛孢菌丝体提取物,与冬虫夏草相比,色谱有效成分相似度为94%,DNA指纹图谱相似度达99%,为国内最高。
马兜铃酸所致的肾损害,即马兜铃酸肾病,其主要机制是直接损害肾小管上皮细胞,使其发生转分化、坏死或凋亡,进而导致肾间质纤维化。前期实验中,我们采用SRB细胞增殖实验法,发现HSW对HK2细胞增殖没有明显影响(P>0.05)。本实验观察HSW对AA造成的HK2细胞损伤的逆转作用,HSW显示出较好的作用。但“2.1”实验中,HSW高低剂量组未体现出明显量效相关性,提示在下一步研究中,需降低剂量,并进行半数有效剂量实验。
典型的马兜铃酸肾病肾脏病理特点为:肾小管间质纤维化(RIF),小管萎缩或缺失。TGFβ1主要分布在肾小管间质,是肾脏疾病时最重要的致肾纤维化细胞因子[4],它可被肾脏固有细胞和浸润白细胞产生,参与多种信号转导途径[5-6],以自分泌或旁分泌的方式参与细胞外基质(ECM)的合成而导致RIF[7]。PAI-1是纤溶酶原激活物的生理性抑制剂,使ECM降解受到抑制[8],所以PAI-1的高表达也可能是导致肾间质纤维化的另一个重要机制。在本研究中,HSW有效地抑制了AA引起的 HK2细胞TGFβ1、PAI-1 mRNA 表达的上调(P <0.05),提示HSW可通过下调以上指标基因来修复HK2模型损伤。
在体内外研究中,庆大霉素可造成肾小管损伤或死亡已得到充分证实。庆大霉素建立肾小管上皮细胞损伤的体外培养模型[9]和大鼠急性肾损伤模型也被广泛应用。本实验中HSW 3个剂量组均可明显地降低BUN、SCr水平(P<0.01),表明其对庆大霉素急性肾损伤具有良好防治作用,病理观察进一步验证了HSW的药效学作用。在防治庆大霉素肾毒性方面既往研究中,天然药物或其提取物显示了较好的治疗作用,蘑菇菌丝体提取物及五味子均可通过增强肾脏的抗氧化系统来对抗庆大霉素肾毒性[10-11]。提示我们在后期研究中,可以采用甘油诱导的实验性ARF模型,观察HSW的抗氧化活性,进一步探讨药物作用机制[12]。
中国被毛孢菌丝体提取物的开发,对于扩大冬虫夏草的药源、促进冬虫夏草制品在临床的推广应用,有一定的积极意义,本研究通过其在细胞和整体水平上对抗肾衰竭药效的初步研究,为研究人工发酵菌丝体相关产品的药用价值提供参考依据。
[1] 郭宏春,高继全,习欠云,李小红.冬虫夏草研究进展[J].微生物学杂志,2003,23(1):50-5.
[1] Guo H C,Gao J Q,Xi Q Y,Li X H.Research advance in the cordyceps sinensis[J].J Microbiol,2003,23(1):50 - 5.
[2] 高玉梅,刘国平.冬虫夏草对肾脏保护作用的研究进展[J].医学综述,2010,16(2):289-92.
[2] Gao Y M,Liu G P.Progress in cordyceps sinensis in protection of kidney[J].Med Recap,2010,16(2):289 -92.
[3] 蒋 毅,姚一建.冬虫夏草无性型研究概况[J].菌物系统,2003,22(1):161-76.
[3] Jiang Y,Yao Y J.Anamorphic fungi related to cordyceps sinensis[J].Mycosystema,2003,22(1):161-76.
[4] 许艳芳,吴异兰,万建新,王彩云.BMP-7对TGF-β1诱导人肾小管上皮细胞外基质表达的影响[J].中国药理学通报,2008,24(11):1453 -7.
[4] Xu Y F,Wu Y L,Wan J X,Wang C Y.Effects of BMP-7 on the expression of extracellular matrix in human renal proximal epithelial cells induced by TGF-β1[J].Chin Pharmacol Bull,2008,24(11):1453-7.
[5] Sam R,Wanna L,Gudehithlu K P.Glomerular epithelial cells transform to myofibroblasts:early but late removal of TGF-betal reverses transformation[J].Transl Res,2006,148(3):142 -8.
[6] Mishra R,Zhu L,Eckert R L,et al.TGF-regulated collagen type accumulation:role of Src-based signals[J].Am J Physiol Cell Physiol,2007,292(4):1361 -9.
[7] 万建新,尤丹瑜,许昌声.氟伐他汀对转化生长因子β1诱导的系膜细胞结缔生长因子和Ⅳ型胶原表达的影响[J].中国药理学通报,2007,23(11):1501 -5.
[7] Wan J X.You D Y.Xu C S.Effects of fluvastatin on the expressionof connective tissue growth factor and typeⅣcollagen in mesangial cells induced by transforming growth factor-β1 [J].Chin Pharmacol Bull,2007,23(11):1501 -5.
[8] 陈 叶,傅余芹,方华伟,等.冬虫夏草对糖尿病大鼠纤溶系统的影响[J].中国老年学杂志,2010,30(12):1674-6.
[8] Chen Y,Fu Y Q,Fang H W,et al.Effects of cordyceps sinensis on fibrinolytic system of diabetic rats[J].Chin J Gerontol,2010,30(12):1674-6
[9] 黄巨恩,黄全勇,陈维平,梁祖鼎.碱性成纤维细胞生长因子对庆大霉素肾损害保护作用的体外实验研究[J].中国药理学通报,2005,21(2):232-5
[9] Huang J E,Huang Q Y,Chen W P,Liang Z D.Protective efects of bFGF on rats’renal tubular epithelial cells damaged by gentamicin in vitro[J].Chin Pharmacol Bull,2005,21(2):232 -5
[10] Nitha B,Janardhanan K K.Aqueous-ethanolic extract of morel mushroom mycelium Morchella esculenta,protects cisplatin and gentamicin induced nephrotoxicity in mice[J].Food Chem Toxicol,2008,46(9):3193.
[11] Chiu P Y,Leung H Y,Ko K M.Schisandrin B enhances renal mitochondrial antioxidant status,functional and structural integrity,and protects against gentamicin-induced Nephrotoxicity in rats[J].Biol Pharm Bull,2008,31(4):602.
[12]凌智群,张晓辉,谢笔钧,曾繁典.原花青素的药理学研究进展[J].中国药理学通报,2002,18(1):9-12.
[12]Ling Z Q,Zhang X H,Xie B J,Zeng F D.Review on the pharmacological research of procyanidins[J].Chin Pharmacol Bull,2002,18(1):9-12.

