槲皮素长循环纳米脂质体的小鼠口服吸收研究*
王刚,常明泉,杨光义,曾南,叶方
(1.湖北医药学院附属太和医院药学部,湖北十堰 442000;2.成都中医药大学药学院,610075)
槲皮素(quercetin,QUE)为一种天然的黄酮类化合物,槐米、款冬花、高良姜、侧柏叶、桑寄生等许多中药均含有该成分。槲皮素能通过多种途径诱导肿瘤细胞凋亡,是目前最强的抗肿瘤药物之一[1]。国外I和II期临床试验证实,槲皮素在体内能抑制多种肿瘤进展,并且在美国和欧洲一些国家已经上市。然而,由于槲皮素不溶于水,导致吸收受限,生物利用度低,难以在脑组织中达到有效的治疗浓度[2],限制槲皮素抗脑胶质瘤应用。笔者在本实验采用乳化蒸发-低温固化法制备槲皮素长循环纳米脂质体(long circulating nano-liposomes of quercetin,QUE-LCL),以正交实验法优化的制备工艺制备QUE-LCL,并对其理化性质及小鼠口服吸收特性进行研究,报道如下。
1 材料
1.1 试药 山嵛酸甘油酯(武汉祥和精细化工有限公司,批号:100305),大豆卵磷脂(武汉祥和精细化工有限公司,批号:100310),胆固醇(武汉祥和精细化工有限公司,批号:100305),聚乙二醇-二硬脂酰磷脂酰乙醇胺(PEG2000-DSPE,武汉祥和精细化工有限公司,批号:100305)、聚山梨酯-80(上海化学试剂厂,批号:20081006),泊洛沙姆188(武汉祥和精细化工有限公司,批号:100310),槲皮素(自制,批号:20100714,纯度:89.8%),槲皮素对照品(中国药品生物制品检定所,批号:100081-200406),甲醇为色谱纯,水为纯化水,其他试剂均为分析纯。
1.2 仪器 戴安3000型高效液相色谱仪,DF-101S集热式恒温加热磁力搅拌器(巩义市英峪予华仪器厂),Zetasizer3000粒径测定仪(英国Malvem公司),TGL-16G台式高速离心机(上海安亭科学仪器厂),JEM-2010透射电子显微镜(日本电子公司),电子天平(熊猫集团南京电子计量有限公司)。
1.3 动物 昆明种小鼠,体质量(20±3)g,湖北医药学院实验动物中心提供,实验动物生产许可证:SCXK(鄂)2005-0008;实验动物使用许可证:SYXK(鄂)2005-0031。
2 方法与结果
2.1 QUE-LCL 的制备
2.1.1 水相溶液的制备 称取一定比例的泊洛沙姆和聚乙二醇-二硬脂酰磷脂酰乙醇胺(1∶1),加入适量聚山梨酯-80构成水相,水浴加热至(75±5)℃。
2.1.2 油相溶液的制备 精确称取适量山嵛酸甘油酯和胆固醇,80℃水浴熔融;精确称取适量槲皮素和大豆卵磷脂,共溶于适量丙酮∶三氯甲烷(1∶1)溶剂中,混合后成油相。
2.1.3 QUE-LCL制备 采用乳化蒸发-低温固化法制备,以正交实验法优化的处方与制备工艺制备QUELCL,其中大豆卵磷脂∶胆固醇∶PEG 2000-DSPE=(2∶1∶1),药脂质量比=1∶10。将水相置于75℃水浴中,以600~800 r·min-1转速搅拌0.5 h,采用6 号针头将油相注入水相中(注射速度2mL·min-1),进行包封,搅拌2 h。然后将搅拌的脂质体置于-2℃冰水浴中进行低温固化,加冰水约10mL,搅拌1 h,制得纳米脂质体混悬液[3]。
2.2 QUE-LCL包封率的测定
2.2.1 测定波长的选择 分别加入甲醇溶解并稀释空白纳米脂质体和含药纳米脂质体,制成澄清溶液,在200~400 nm波长紫外扫描,槲皮素在254 nm波长处有显著的吸收峰,而空白纳米脂质体无吸收峰。因此选择测定波长为254 nm。高效液相色谱(HPLC)图谱表明,槲皮素对照品和槲皮素纳米脂质体在254 nm处均有显著的吸收峰,保留时间约为10.31 min。
2.2.2 色谱条件 色谱柱:Diamonsil-C18柱(250mm×4.6mm,5 μm);流动相:甲醇-4.3% 乙酸溶液(55∶45);流速为1.0mL·min-1;检测波长为254 nm;柱温30 ℃[4];进样量 20 μL。
2.2.3 对照品溶液的制备 精密称取在105℃减压干燥至恒质量的槲皮素对照品2.0 mg,加甲醇超声溶解,定容至10mL的溶液,即得。
2.2.4 标准曲线的绘制 分别吸取槲皮素对照品溶液 0.1,2.0,4.0,6.0,8.0,10.0mL 至 10mL 棕色量瓶中,用甲醇稀释至刻度,即得 2.0,40,80,120,160,200 μg·mL-1的对照品溶液,精密吸取 20 μL 进样,按“2.2.2”项下色谱条件测定,重复操作3次,以峰面积(A)为纵坐标,浓度(C)为横坐标进行线性回归,标准曲线方程为:A=1.343 5C-1.490 4(r=0.999 6),结果表明:槲皮素在 2.0 ~200.0 μg·mL-1范围内呈良好的线性关系。
2.2.5 供试品溶液的制备 用高速离心法分离脂质体与游离药物。精密吸取槲皮素纳米脂质体混悬液1.0mL,置于塑料小管中,16 000 r·min-1高速离心15 min,取上清液进样测定,即得游离药物(W游)。精密量取槲皮素脂质体溶液1.0mL,置10mL棕色量瓶中,加入10%Triton X-100乙醇溶液0.5mL破乳,甲醇溶液定容至刻度,摇匀。HPLC法测定1.0mL脂质体混悬液中总药物量(W总)(空白脂质体混悬液在同样条件下处理,在药物峰位处无干扰)。HPLC法测定药物浓度,计算包封率。包封率计算方法如下:包封率=(1-W游/W总)×100%。按优化处方制备 QUELCL混悬液3批,测定其包封率,3次测定结果分别为91.37%,92.45%,91.49%,平均包封率为91.77%。
2.3 QUE-LCL粒径、形态的检测 以5%葡萄糖溶液稀释纳米脂质体混悬液,取上述稀释样品适量,经2%磷钨酸染色于透射电镜下观察粒子形态为球状或类球状粒子(图1)。在测量小杯中置激光粒度分析仪检测其粒径分布,结果制备的槲皮素纳米脂质体的平均粒径为172.6 nm,粒径范围为100~300 nm。
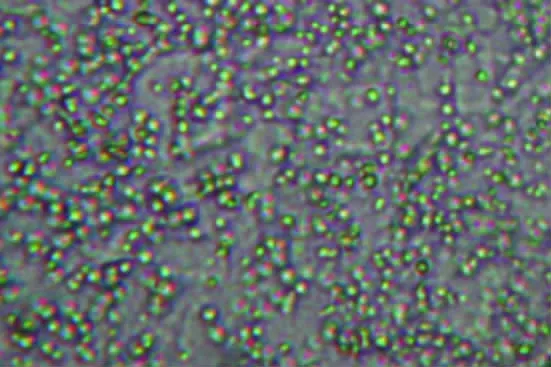
图1 槲皮素纳米脂质体的透射电镜照片(×1 000)Fig.1 Transmission electron image ofquercetin nanoliposomes(×1 000)
2.4 小鼠灌胃槲皮素纳米脂质体吸收实验 昆明种小鼠60只,体质量为(20±2)g,随机分为3组,槲皮素原料药组、QUE-LCL混悬液组、普通脂质体组,每组20只。将以上小鼠给药前禁食12 h,自由饮水。分别灌胃给予槲皮素原料药(槲皮素混悬于4%羧甲基纤维素钠)和槲皮素纳米脂质体混悬液,给药剂量均为50 mg·kg-1,给药后于 l,3,6,9,12 h 处死小鼠,每次处死4只,立即取出自食管下端至肛门的内容物,并用无水乙醇清洗胃肠道管壁,同时收集实验开始到取样时间的所有粪样,合并。
2.4.1 样品处理 取胃肠道内容物和粪样的混合物,加入无水乙醇约80mL,超声提取约1 h后,过滤,用无水乙醇洗涤残渣并定容至100mL。
2.4.2 测定波长的确定 按“2.4.1”项处理空白胃肠道内容物与粪样混合物,及含有QUE或含有QUELCL的胃肠道内容物及粪样混合物后,于200~500 nm波长范围内进行紫外扫描,含 QUE与 QUELCL的样品处理后在254 nm波长处有最大吸收,空白胃肠道内容物及粪样的混合物在此波长处无干扰,而空白纳米脂质体经乙醇处理后在254 nm处也无干扰,故在此波长处测定小鼠口服给药一定时间后在胃肠道中以及排出体外的药物。
2.4.3 色谱条件 色谱柱:Diamonsil-C18柱(250mm×4.6mm,5 μm);流动相:甲醇-4.3% 乙酸溶液(55∶45);流速为1.0mL·min-1;检测波长为254 nm;柱温30 ℃[4];进样量 20 μL。
2.4.4 线性关系考察 精密称取槲皮素对照品50 mg,置于50mL量瓶中,加无水乙醇溶解并稀释至刻度。分别精密吸取 0.2,2.0,4.0,8.0,10.0,20.0mL,加入空白胃肠道内容物和粪样的混合物中,样品处理方法按“2.4.1”处理,分别配置成 2.0,20.0,40.0,80.0,100.0,200.0 μg·mL-1标准应用液,精密吸取20 μL进样,以峰面积为纵坐标,浓度为横坐标进行线性回归,标准曲线方程为:A=0.090 8C+0.157(r=0.999 2),结 果 表明:槲 皮 素 在 2.0 ~200.0 μg·mL-1范围内呈良好的线性关系。
2.4.5 重复性实验 取槲皮素对照品按照“2.4.1”项下方法平行制备6份样品溶液,测定并计算含量,相对标准偏差(RSD)为1.86%。
2.4.6 精密度实验 槲皮素对照品按照“2.4.1”项下方法制备样品溶液,精密吸取20 μL连续进样6次,按照上述色谱条件,测定,计算含量,RSD为1.65%。
2.4.7 稳定性实验 取槲皮素对照品溶液,按照“2.4.1”项下方法制备,于室温(20~25℃)下放置,分别于0,2,4,6,8,10 h 精密吸取 20 μL 进样,测定峰面积,并计算含量,RSD为1.84%。
2.4.8 回收率实验 选择在 2.0 ~200.0 μg·mL-1范围内高、中、低3个浓度槲皮素对照品,添加槲皮素对照品溶液1.2,1.5,1.8mL,每个梯度平行 3 份;分别按“2.4.1”项下方法制备供试品溶液,按上述色谱条件测定,计算得槲皮素的平均回收率分别为98.9%(RSD 为1.71%),99.3%(RSD 为1.89%)和 97.4%(RSD 为1.91%)。
2.4.9 吸收百分率的测定 通过测定口服剂量(X1)及小鼠胃肠道及粪便中剩余的药物量(X2),利用公式:吸收百分率(%)=(X1-X2)/X1×100%,求得药物吸收百分率。见表1。结果表明槲皮素原料药吸收少,12 h的吸收不到60%;槲皮素普通脂质体吸收较少,12 h的吸收不到70%;而槲皮素制成长循环纳米脂质体后,吸收百分率明显提高,12 h的药物吸收>90%,吸收完全。
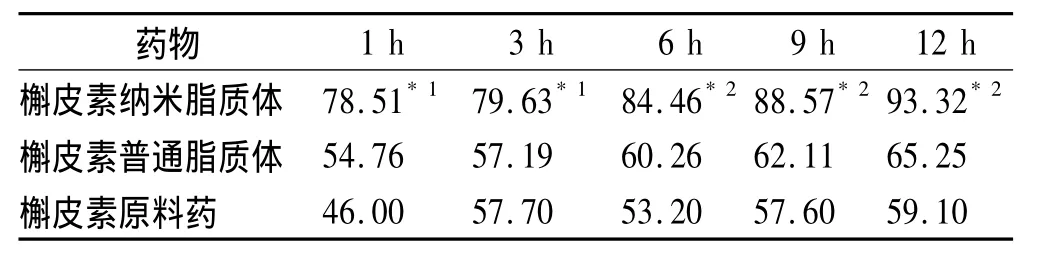
表1 槲皮素口服吸收百分率Tab.1 Oral absorption rate of quercetin %
3 讨论
研究表明,槲皮素水溶性与脂溶性均较差[5],本研究通过采用聚乙二醇-二硬脂酰基磷脂酰乙醇胺(PEG2000-DSPE)为修饰膜材,采用乳化蒸发-低温固化法制备QUE-LCL,实验结果表明以PEG2000-DSPE与聚山梨酯-80作为乳化剂可增加槲皮素纳米脂质体的包封率,此外,本实验采用山嵛酸甘油酯、大豆卵磷脂和胆固醇作为油相于80℃水浴熔融槲皮素,能更好地使药物熔融于油相中,与制备的槲皮素普通脂质体相比较,本实验制备方法在增加槲皮素溶解度的同时提高包封率。
由于槲皮素在吸收过程中存在生物转化[6],多种转化产物进入血液,在血液循环中药物的清除极快,槲皮素在2 h后就已检测不到,故不宜采用槲皮素血药浓度法考察其制剂的吸收情况。研究表明,槲皮素主要经胃肠易化扩散吸收分布于胃肠道[7]。本实验结果表明槲皮素制备成长循环纳米脂质体后在胃肠组织分布浓度很高,制剂中的槲皮素长时间黏附于小肠壁(10~12 h),且不易被排入大肠,而槲皮素原料药在小鼠肠道中迅速通过小肠进入大肠(约6 h),并随大便排出。说明槲皮素制备成长循环纳米脂质体有较好的胃肠黏附性,可有效延长药物与胃肠黏膜的接触时间,从而提高药物在肠道中的吸收。
综上所述,本实验通过研究槲皮素及其在胃组织的药物浓度和口服吸收百分率,为槲皮素的新制剂开发和应用垫定基础。
[1]MURAKAMI A,ASHIDA H,TERAO J.Mutitargeted cancer prevention by quercetin [J].Cancer Lett,2008,269(2):315-325.
[2]UPPUGUNDLA N,ENGELBERTH A,VANDHANA RAVINDRANATH S,et al.Switchgrass water extracts:extraction,separation and biological activity of rutin and quercetin[J].J Agric Food Chem,2009,57(17):7763-7770.
[3]XU F,YUAN Y,SHAN X,et al.Long-circulation of hemoglobin-loaded polymeric nanoparticles as oxygen carriers with modulated surface charges[J].Int J Pharm,2009,377(1-2):199-206.
[4]YANG X,ZHANG X,YUAN Z,et al.Simultaneous determination of myricitrin,hyperin,quercitroside,and quercetin in folium rhododendrimicranthibyRP-HPLC[J].J Chromatogr Sci,2009,47(8):714-717.
[5]LAN K,ZHANG Y,YANG J,et al.Simple quality assessment approach for herbal extracts using high performance liquid chromatography-UV based metabolomics platform[J].J Chromatogr A,2010,1217(8):1414-1418.
[6]MORAND C,CRESPY V,MANACH C,et al.Plasma metabolites of quercetin and their antioxidant properties[J].Am J Physiol,1998,275(1-2):212-219.
[7]孟德胜,汪士良.槲皮素及其苷类研究进展[J].中国药房,2000,11(5):232-233.

