缬草提取物8-羟基松脂醇苷对Kv1.5钾通道电流的影响*
方颖,段雪云,2,王宏飞,范恒,刘焱文
(1.湖北中医药大学湖北省中药资源与中药复方省部共建教育部重点实验室,武汉 430065;2.湖北省中医院药学部,武汉 430065;3.华中科技大学同济医学院附属协和医院中西医结合科,武汉 430022)
缬草(Valeriana officinalis L.)为败酱科缬草属植物,传统医学认为缬草有安心神、祛风湿、行气血、镇痛的功效;现代药理研究表明,缬草提取物对由乌头碱、哇巴因、肾上腺素等诱发的心律失常动物模型均有良好的对抗作用,延长动作电位时程和有效不应期,抑制心肌自律性[1];能明显对抗乙酰胆碱一氯化钙诱发的小鼠心房颤动(房颤)和三氯甲烷诱发的小鼠心室颤动(室颤),也能明显对抗大鼠由结扎左冠状动脉前降支诱发的早期缺血性心律失常[2]。
为了阐释缬草的抗心律失常物质基础,本实验室采用超临界二氧化碳(CO2)萃取法和系统溶剂法,将缬草分为不同提取部位,然后以乌头碱、三氯甲烷两种诱导剂诱导心律失常的模型进行药理实验,确定缬草抗心律失常的主要活性部位[3-4]。在活性部位筛选的基础上,采用色谱法,对主要活性部位的化学成分进行了初步分离,得到8-羟基松脂醇苷等十几个单体化合物,以转基因Kv1.5HEK293细胞为受试对象,采用膜片钳全细胞记录电流的方法对分离得到的化合物进行抗心律失常的作用筛选研究,旨在从细胞通道水平阐明其抗心律失常的作用机制。
1 仪器与试药
1.1 仪器 倒置显微镜 OLYMPUS IX71(日本Olympus公司),膜片钳放大器(HEKAEPC-9 Germen),PULSE 软件(HEKA lambrecht Germen),玻璃电极(南京六合泉水教学实验仪器厂),微电极拉制仪(P-97 Sutter Instrumentco,Norato,CA),恒流泵 HL-2B(上海沪西分析仪器厂)。
1.2 试药 缬草中分离的单体成分8-羟基松脂醇苷,其他试剂均为分析纯。
1.3 细胞株 转基因Kv1.5HEK293细胞由香港大学惠赠。
2 材料与方法
2.1 细胞培养与传代 将细胞约3×105个置培养瓶中(25 cm),加含10%胎牛血清(fetal bovine serum,FBS)达尔伯克改良必需基本培养基(Dulbecco's modified minimal essential medium,DMEM)5mL,置37℃,5%CO2恒温培养箱中培养,当细胞生长80% ~90%融合时,即可进行传代。将磷酸盐缓冲液(phosphate buffered solution,PBS)、培养基、胰酶等液体在37℃水浴预热。先弃去培养瓶中培养基,再用PBS冲洗,后加入胰酶消化液约2.5mL,并轻柔摇动,使消化酶流遍所有细胞表面,在显微镜下观察到贴壁生长的转基因Kv1.5细胞回缩,胞体趋于变圆,细胞间缝隙变大时,立即终止消化,加入含血清的培养基约2.5mL,并用吸管反复吹打,使细胞从培养瓶壁上脱离下来成单个悬浮细胞,将细胞接种于培养瓶或培养皿中于37℃,5%CO2恒温培养箱培养。
2.2 细胞冻存与复苏 细胞冻存时采用逐步降温,依次在4℃冰箱放置0.5 h,-20℃冰箱放置0.5 h,然后放入-80℃冰箱24 h,即可转移到液氮罐(-170℃)中长期保存;首先按细胞传代方法将培养瓶中的细胞消化下来,转移到离心管中,低速离心留取细胞沉淀。然后用预先配制的细胞冻存液重新悬起细胞,制成细胞悬液,分装入冻存管中,注明细胞名称和冻存日期。细胞复苏时,从液氮罐中取出冻存管,迅速放入37℃水浴中,不停地轻轻摇动冻存管,使细胞可以尽快解冻。复苏后24 h更换新鲜培养基。
2.3 溶液的配制 蒂罗德(Tyrode’s)液:氯化钠137mmol·L-1、氯 化 钾 5.4mmol·L-1、氯 化 镁1.0mmol·L-1、氯化钙 1.8mmol·L-1、磷酸二氢钠0.33mmol·L-1、4-羟乙基呱嗪乙磺酸 10mmol·L-1、葡萄糖10mmol·L-1,用氢氧化钠调pH至7.4;电极内液:天门冬氨酸钾 120mmol·L-1,氯化钾20mmol·L-1,4-羟乙基哌嗪乙磺酸5mmol·L-1,氯化镁 21mmol·L-1,ATP敏感性钾(ATP-sensitive potassium,K-ATP)4mmol·L-1,乙二醇-双-(2-氨基乙酸)四乙酸10mmol·L-1,磷酸肌酸二钠 2mmol·L-1,用氢氧化钾调 pH到7.3;所有电极内液均用孔径0.22 μm微孔滤膜过滤。供试品溶液:取适量从缬草中分离单体成分8-羟基松脂醇苷,临用前溶于100%二甲亚砜中,配成相应的浓度,备用。
2.4 全细胞膜片钳记录方法 采用全细胞膜片钳记录方法,在电压钳制模式下记录通道电流[5]。膜片钳放大器通过A/D和D/A数据转换器同计算机相连接,刺激信号及电压、电流输入信号的采集均由软件PULSE控制。
实验在室温(22~24℃)下进行,吸取少许细胞悬液于0.5mL的灌流槽中,静置5~10 min,待细胞贴壁后,用100% 氧气饱和的细胞外液进行表面灌流5~10 min,流速2mL·min-1。在倒置显微镜下选择边缘清晰,表面光滑,立体感强,无收缩的细胞进行实验。为了排除灌流对细胞电流的影响,整个实验过程中采用细胞外液进行表面持续灌流,流速2mL·min-1。玻璃电极充灌电极内液后入水电阻为1~2 ΜΩ。由于转基因Kv1.5细胞体积较小,记录通道电流时所用电极尖端开口较小,电极入液电阻2~3 ΜΩ。调节三维操纵器使电极尖端移向细胞表面,形成高阻封接,封接电阻>1 GΩ。补偿快电容并吸破细胞膜形成全细胞记录模式。调节慢电容补偿和串联电阻补偿70%~80%以减少瞬时充放电电流和钳位误差,然后在电压钳模式下记录电流,保持电压固定于-80 mV,阶跃电压10 mV,指令电位的步阶范围由-50 mV至60 mV,持续时间 300 ms,然后电压保持在-50 mV,150 ms,分别记录给予维拉帕米20 μmol·L-1前和5 min后稳定的电流,该电流的后部分被抑制达70%以上,该电流激活较快,基本不失活,呈电压依赖性,可被维拉帕米所阻断,与人心房肌细胞IKur类似[6],证实该电流系人Kv1.5通道的电流。
2.5 统计学方法 电生理资料由 Patch、Clampfit、Sigmaplot软件处理,所有数据以均数±标准差(±s)表示,通过SPSS 10.0软件进行数据分析,用药前后比较采用t检验,以P<0.05为差异有统计学意义。
3 结果
3.1 8-羟基松脂醇苷对转基因Kv1.5细胞电流时间依赖曲线的影响 采用上述实验方法和实验条件,分别用含 8-羟基松脂醇苷 0,10,30 μmol·L-1的电极外液灌流5 min,观察电流变化,在不同浓度下电流减小,记录不同浓度灌流前后,以及洗脱后的电流图,见图1。结果随着给药时间的推移,电流逐渐减小并渐趋稳定,洗脱后缓慢恢复,并逐渐稳定到最大值。见图2。
3.2 8-羟基松脂醇苷对转基因Kv1.5细胞电流单刺激曲线的作用 保持电压固定于-50 mV,然后电压保持在50 mV,持续300 ms的单刺激条件下所记录的电流图,与将分别用含8-羟基松脂醇苷0 μmol·L-1(对照组),10 μmol·L-1,30 μmol·L-1的电极外液灌流5 min后,所记录的电流进行曲线拟合,得出图3。给药10 μmol·L-1后的电流,较对照组明显有所减小;给药30 μmol·L-1后的电流,较对照组明显减小,且对整个电流的抑制作用较10 μmol·L-1增强。抑制率分别为27.3% 和 35.6%(n=8,P<0.05)。与串刺激下进行统计学所得结论一致。

图1 不同浓度的8-羟基松脂醇苷对转基因Kv1.5细胞的电流影响A 用药前;B.10 μmol·L-1;C.30 μmol·L-1;D 洗脱后Fig.1 The effects of different concentrations of 8-hydroxy resin glycosides on the currents of the Kv1.5 HEK293 cellsA.before the treatment of 8-hydroxy resin glycosides;B.10 μmol·L-1;C.30 μmol·L-1;D.after the elution
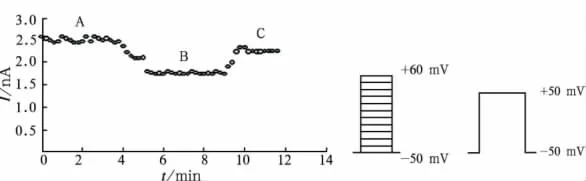
图2 8-羟基松脂醇苷对转基因Kv1.5电流时间依赖曲线的影响A.用药前;B.用药后;C.洗脱后Fig.2 The effects of 8-hydroxy resin glycosides on the time dependency curve of the Kv1.5 HEK293 cellsA.before the treatment;B.after the treatment;C.after the elution

图3 8-羟基松脂醇苷对转基因Kv1.5电流单刺激曲线的作用Fig.3 The effects of 8-hydroxy resin glycosides on the stimulus curve of the Kv1.5 HEK293 cells
3.3 8-羟基松脂醇苷对转基因Kv1.5细胞电流密度曲线的影响 保持电压固定于-80 mV,阶跃电压10 mV,指令电位的步阶范围由-50 mV至60 mV,持续时间300 ms,然后电压保持在-50 mV,持续150 ms,测定到Kv1.5通道电流,在指令电压+60 mV时,用含8-羟基松脂醇苷10,30 μmol·L-1的电极外液灌流5 min后,使 Kv1.5 通道电流值从(148.3±13.0)PA/PF 分别降至(109.4±4.0)PA/PF 和(78.6±11.3)PA/PF,与对照组比较抑制率分别为28.5% 和37.1%,差异有统计学意义(P<0.05,n=6)。见图4。

4 讨论
实验结果表明,8-羟基松脂醇苷对转基因Kv1.5细胞电流有抑制作用,洗脱后电流基本恢复正常(略较用药前偏低);不同浓度对转基因Kv1.5细胞电流影响不同,浓度越高抑制越明显。推测电流与浓度可能也呈现一定的依赖性,可能在一定范围内,药物浓度越高,细胞电流抑制作用越强;并且没有改变离子通道激活的特性。
基因Kv1.5细胞主要是电压门控钾通道(Kv1.5钾通道),其培养的细胞均为单钾通道,阻止该通道会影响钾电流,从而与心律失常密切相关。Kv1.5钾通道电流是引起心肌细胞动作电位复极的主要电流及Ⅲ类抗心律失常药的主要靶点。
本实验选取转基因Kv1.5 HEK293细胞进行观察研究,HEK293细胞来源于人胚胎肾上皮细胞,也是常用的人心肌细胞离子通道基因体外表达系统。研究表明,HEK293细胞无内源性 Kv1.5通道 mRNA的转录,其细胞膜上无 Kv1.5 通道表达[7-8],作为Kv1.5 钾通道体外细胞模型,可以排除内源性 Kv1.5电流对实验的干扰,超快速延迟整流钾电流(ultrarapid delayed rectifier current,IKur)离子通道的分子基础是Kv1.5钾通道[9],并且IKur是仅在心房肌发现的钾通道电流,房颤时Ikur的变化非常重要,是潜在的心房选择性抗房颤药物的高敏靶点。由于HEK293是源于人的细胞系,以其为模型取得的实验结果与人心肌细胞差异会更小。因此,药物对转基因Kv1.5钾通道HEK293的电流有抑制作用,那么它可能有抗房颤作用。
从本实验结果可以看出,8-羟基松脂醇苷对转基因Kv1.5钾通道电流有抑制作用,说明其可能通过抑制IKur,延长有效不应期,而达到抗房颤的作用,不致室性心律失常,有一定研究前景。当然人的心肌细胞主要有钠、钾、钙3种离子通道,不同于本实验只选用转基因Kv1.5细胞单个钾通道作研究,该药对人体心肌细胞多个通道作用机制还有待于进一步进行。
[1]王玉良,徐森根,范世藩.缬草抗心律失常的心肌细胞电生理学观察[J].中华心血管病杂志,1979,7(4):275-282.
[2]贾健宁,张宝恒.缬草提取物(V3d)对心血管系统的作用[J].广西中医学院学报,1999,16(1):40-42.
[3]文莉,周颖,周威,等.缬草各提取物抗实验性心律失常活性研究[J].中国医院药学杂志,2009,29(3):191-194.
[4]段雪云,方颖,龚占峰,等.缬草抗心律失常活性部位的筛选[J].中国药师,2009,12(7):842-844.
[5]李泱.离子通道与膜片钳技术[M].兰州:甘肃文化出版社,2001:151.
[6]TIAN M,DONG M Q,CHIU S W,et al.Effects of the antifungal antibiotic clotrimazole on human cardiac repolarization potassium currents[J].Br J Pharmacol,2006,147(3):289-297.
[7]PEUKERT S,BRENDEL J,PIRARD B,et al.Identification,synthesis and activity of novel blockers of the voltage-gated potassium channel Kv1.5 [J].J Med Chem,2003,46(4):486-498.
[8]JIANG B,SUN X,CAO K,et al.Endogenous Kv channels in human embryonic kidney(HEK2293)cells[J].Mol Cell Biochem,2002,238(122):69-79.
[9]张晓伟,李广平.Kv1.5钾通道与心房颤动[J].中华心血管杂志 ,2008,13(2):144-146.

