三明产柿叶总黄酮的微波提取研究
陈淑燕,周文富
(三明学院化学与生物工程系,福建 三明 365004)
柿叶为柿树科(Ebenaceae)的新鲜或干燥叶。我国是世界上主要的柿子生产国,南北各地普遍栽培、分布广泛。柿叶的有效成分主要是黄酮类化合物,目前已发现的有黄芪苷、山萘酚、山萘酚3-O-β-D-葡萄糖苷、山萘酚3-O-α-L-鼠李糖苷、山萘酚3-β-D-木糖苷、山萘酚3-O-α-L-阿拉伯糖苷、槲皮素、3-O-[ 2″-O-(3,4,5-三羟基苯甲基酰)]-葡萄糖苷、异槲皮素、芦丁、金丝桃苷(槲皮素-3-半乳糖苷)、杨梅树皮苷等[1~4]。柿叶中的黄酮具有抗氧化、清除自由基、抗过敏、保护肝脏、抗菌消炎、生津止渴、改善心脑血管循环、降低胆固醇、解痉孪、抗癌防癌等功能,在防治中老年人脑动脉硬化、预防脑血栓、防治老年痴呆和其它神经性疾病、皮肤抗衰老、美容等方面有广阔的开发应用前景[1~4]。因此,柿叶中黄酮类化合物的药用开发是近年研究的热点之一[4~20]。
目前,黄酮类化合物的提取方法主要有冷浸法、煎煮法、回流提取法、稀醇提取法、水提取法、传统乙醇提取法、超声波提取法、超临界CO2萃取法和微波法[11~18]。其中微波法具有穿透力强、选择性高、提取率高、能耗低、不产生噪音等优点,尤其适用于热不稳定生物质药物的提取[9,12,15]。
作者在此以三明地区柿叶为原料,采用微波法提取柿叶中总黄酮,并优化了提取工艺条件。
1 实验
1.1 原料、试剂与仪器
柿叶(七月下旬)采自福建三明三元地区。
芦丁标准品,中国药品生物制品检定所;95%乙醇、石油醚、硝酸铝、亚硝酸钠、氢氧化钠,均为分析纯;超纯水。
NJL07-3 型实验专用微波炉,南京杰全微波设备有限公司;360FTIR型傅立叶红外光谱仪,美国Nicolet 公司;UV-1100 型紫外可见分光光度计,北京瑞利仪器有限公司;DHG-9070A型电热恒温鼓风干燥箱,上海基玮实验仪器设备有限公司;722S 型可见分光光度计、FA1604N 型电子天平,上海精密科学仪器有限公司;SHB23型循环水式多用真空泵,郑州杜甫仪器厂;RE-52B型旋转蒸发仪,上海博经经贸公司。
1.2 方法
1.2.1 柿叶总黄酮的提取
准确称取1.00 g 柿叶粉末(过120 目筛)于三角锥形瓶中,加入一定质量浓度的乙醇溶液,摇匀,将瓶口用保鲜膜覆盖,浸泡1 h后,在一定的微波功率下辐射提取一定时间,趁热抽滤,将滤液移至梨形分液漏斗中加石油醚纯化脱除杂质。移至100 mL容量瓶定容后摇匀,作为供试品溶液备用。
1.2.2 柿叶总黄酮的测定[11,12,15]
1.2.2.1 标准溶液的配制
将芦丁标准品于120 ℃下干燥至恒重,准确称取10.0 mg 芦丁标准品,加60%(质量浓度,下同)乙醇溶解,定容至50 mL,得浓度为0.200 mg·mL-1的芦丁标准溶液。
1.2.2.2 最大吸收波长的选择
准确吸取芦丁标准溶液1.0 mL、供试品溶液1.0 mL,分别置于25 mL容量瓶中,加入5%NaNO2溶液1.0 mL,摇匀,放置6 min;加入10%Al(NO3)3溶液1.0 mL,摇匀,放置6 min;加入4% NaOH溶液10 mL,摇匀,用60%乙醇定容,摇匀。不加供试品溶液、不加标准溶液、只加显色剂同法制得空白对照液。将溶液静置15 min后用紫外可见分光光度计于波长400~600 nm范围进行扫描。测试结果表明供试品溶液及标准品溶液均在波长510 nm处有最大吸收峰。
1.2.2.3 标准曲线的绘制
准确吸取芦丁标准溶液0.0 mL、1.0 mL、2.0 mL、3.0 mL、4.0 mL、5.0 mL于25 mL容量瓶中,按1.2.2.2方法于510 nm 处测定吸光度,以芦丁浓度(x)为横坐标、吸光度(y) 为纵坐标绘制标准曲线,见图1。拟合线性回归方程为:y=0.0115x-0.0005,R2=0.9999。
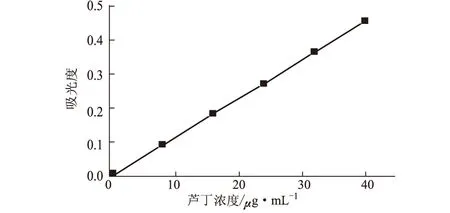
图1 芦丁标准曲线
1.2.2.4 样品含量的测定
精密吸取供试品溶液1.0 mL置于25 mL容量瓶中,按1.2.2.2方法测定吸光度。总黄酮的提取率依下式计算:
式中:mi为样品中总黄酮的含量(以芦丁计),%;c为样品中黄酮的质量浓度,μg·mL-1;W为样品的质量,g。
2 结果与讨论
2.1 柿叶提取物的结构表征
2.1.1 紫外光谱分析(图2)
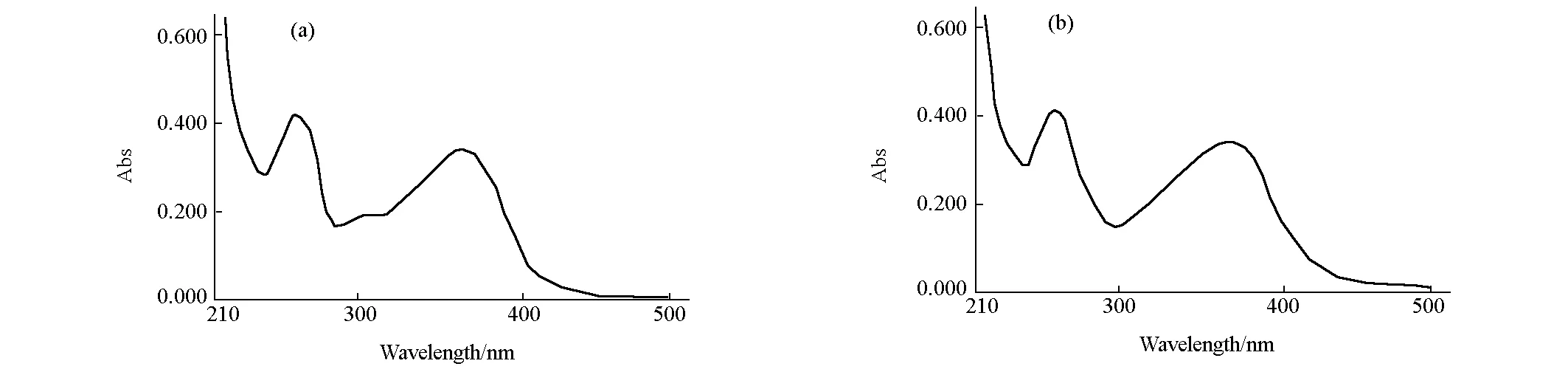
图2 芦丁标准品(a)与柿叶提取物(b)的紫外吸收光谱
由图2可知,芦丁标准品在240~290 nm 和300~400 nm 两波带各有一个吸收峰,柿叶提取物两吸收峰与芦丁标准品相似,证实柿叶提取物的骨架和官能团结构与芦丁相似,是黄酮类化合物。
2.1.2 红外光谱分析(图3)
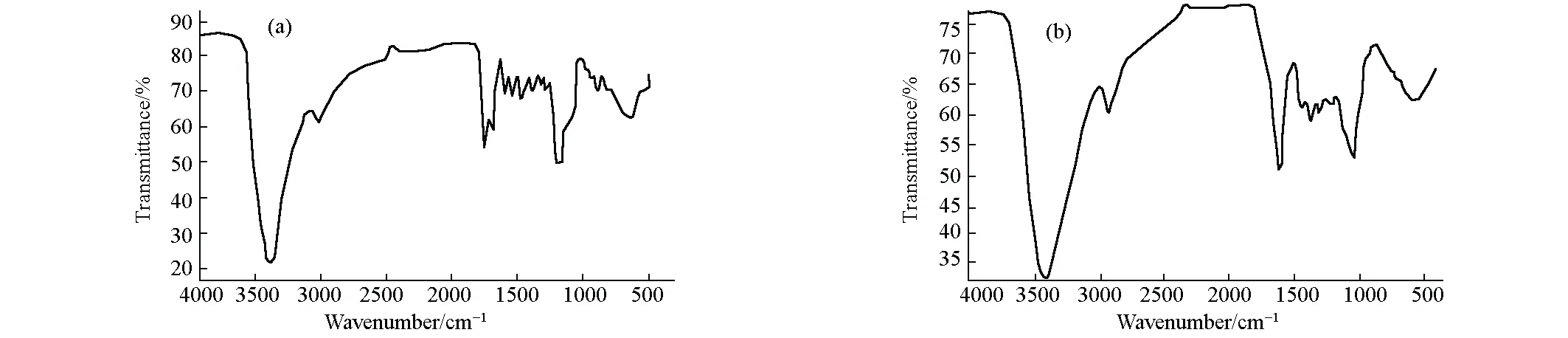
图3 芦丁标准品(a)和柿叶提取物(b)的红外光谱
由图3可知,芦丁标准品在3422.72 cm-1处为-OH的伸缩振动吸收峰,峰形宽大、强度较大,说明有酚羟基或缔合的羟基存在;2926.76 cm- 1处为C-H的伸缩振动吸收峰,强度较小,说明饱和碳上的氢较少;1663.56 cm- 1处为C=O的伸缩振动吸收峰;1596.00 cm- 1、1446.55 cm-1处为苯环C-C骨架伸缩振动吸收峰,说明有苯环存在;1200 cm- 1左右为C-O伸缩振动吸收峰。柿叶提取物特征峰与芦丁标准品基本相似,表明从柿叶中提取的成分与芦丁相似,进一步证实其确是黄酮类化合物。
2.2 单因素实验
2.2.1 乙醇质量浓度对柿叶总黄酮提取率的影响
固定固液比(g∶mL,下同)为1∶25、微波辐射功率为300 W,微波辐射间歇提取3次,每次3 min,考察乙醇质量浓度对柿叶总黄酮提取率的影响,结果见图4。
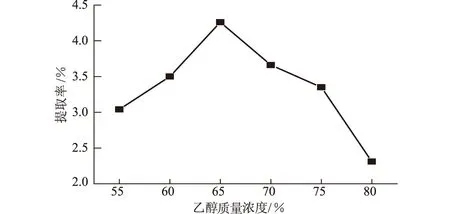
图4 乙醇质量浓度对柿叶总黄酮提取率的影响
由图4可知,随着乙醇质量浓度的增大,柿叶总黄酮提取率逐渐上升;当乙醇质量浓度为65%时,柿叶总黄酮提取率最高;但乙醇质量浓度继续增大时,柿叶总黄酮提取率反而降低。这可能与黄酮类化合物的极性相关,不同质量浓度的乙醇极性不同,增大乙醇质量浓度可以增强溶剂对柿叶粉末的渗透性,加大黄酮类化合物的溶解度。根据相似相溶原理,乙醇质量浓度为65%时柿叶总黄酮的提取率最高。乙醇质量浓度高于65%时,其对色素的溶解性提高,提取液中带入色素的量增加。本实验发现,未去除的色素(如叶黄素、叶绿素、胡萝卜素等)的基团可与显色剂显色,增大吸光度,导致提取率假性提高,因此粗产品的纯化、脂溶性物质去除等十分关键。
2.2.2 微波辐射时间对柿叶总黄酮提取率的影响
固定固液比为1∶25、乙醇质量浓度为65%、微波辐射功率为300 W,考察微波辐射时间(每次辐射3 min,辐射不同次数)对柿叶总黄酮提取率的影响,结果见图5。

图5 微波辐射时间对柿叶总黄酮提取率的影响
由图5可知,随着微波辐射时间的延长,柿叶总黄酮提取率不断上升;但辐射超过15 min后柿叶总黄酮提取率有所下降。这可能是因为,短时间的微波辐射对柿叶细胞膜的破碎率较大、浸出的总黄酮较多,提取率上升到一定的程度后就趋于平衡。
2.2.3 固液比对柿叶总黄酮提取率的影响
固定微波辐射功率为300 W、乙醇质量浓度为65%,微波辐射间歇提取3 次,每次3 min,考察固液比对柿叶总黄酮提取率的影响,结果见图6。
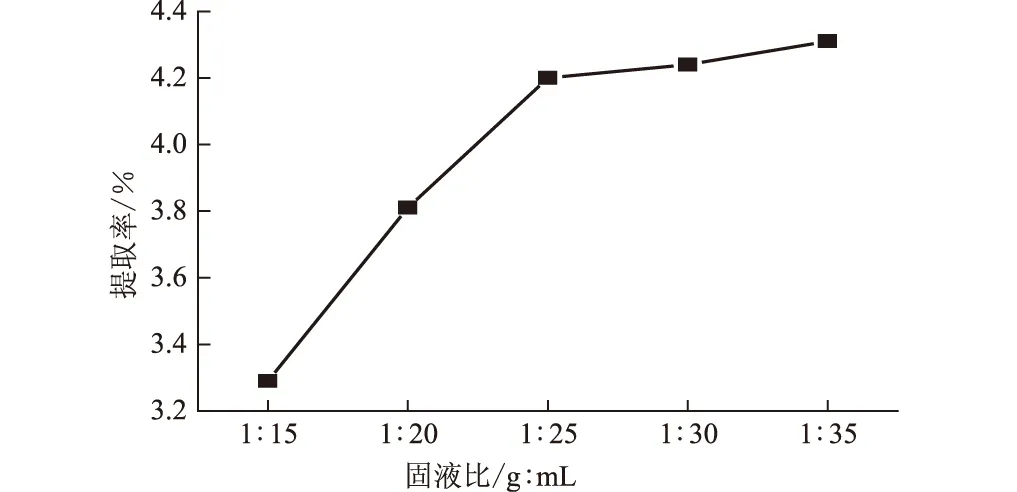
图6 固液比对柿叶总黄酮提取率的影响
由图6可知,随着固液比的减小(即溶剂量的增大),柿叶总黄酮的提取率不断提高;但固液比减小到1∶25 时,继续增加溶剂的量对柿叶总黄酮提取率影响不大。这可能是因为,溶剂量较小时,柿叶中的总黄酮没有完全溶解于溶剂中,因此提取率低;随着溶剂量的增加,柿叶总黄酮不断被溶解,提取率逐渐增大;但溶解至饱和、趋于平稳后再增加溶剂量就造成浪费。
2.2.4 微波辐射功率对柿叶总黄酮提取率的影响
固定固液比为1∶25、乙醇质量浓度为65%,微波辐射间歇提取3 次,每次3 min,考察微波辐射功率对柿叶总黄酮提取率的影响,结果见图7。
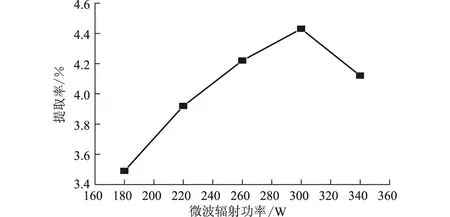
图7 微波辐射功率对柿叶总黄酮提取率的影响
由图7可知,柿叶总黄酮提取率随着微波辐射功率的增大先上升后下降,微波辐射功率为300 W时柿叶总黄酮的提取率最高。这可能是因为,微波辐射功率低时,分子运动不剧烈、对细胞破坏程度小,提取率低;随着微波辐射功率增大,分子运动加剧,对细胞破坏程度加大,渗透、溶解、扩散加强,浸出的总黄酮就越多;当微波辐射功率超过300 W后,大功率微波辐射产生的强热效应破坏了提取液中黄酮的结构并使蛋白质凝固、黄酮不易溶出,同时对细胞内物质选择性差异减小,易溶于溶剂的杂质先被溶出从而影响了提取率,且微波辐射功率过大易发生暴沸,不利于提取操作。
2.3 正交实验[16]
基于单因素实验结果,选择乙醇质量浓度、微波辐射功率、固液比和微波辐射时间作为考察因素,采用L9(34) 正交表设计实验。实验的结果与分析见表1。

表1 正交实验结果与分析
由表1可知,各因素对微波法提取柿叶总黄酮提取率的影响大小依次为:乙醇质量浓度>微波辐射时间>微波辐射功率>固液比。确定最佳提取工艺条件为:A2B3C2D3,即乙醇质量浓度为65%,微波辐射时间为15 min(间歇辐射5次,每次3 min),固液比为1∶25,微波功率为300 W。该条件下柿叶总黄酮提取率为5.22%。
2.4 不同提取方法的比较(表2)

表2 不同提取方法的比较
由表2可知,微波法提取柿叶总黄酮与其它提取法相比,提取率最高,为5.22%,而超声波法和乙醇浸提法分别为4.54%和3.72%。微波提取法高效、省时、节能、提取率高,与超声波法和乙醇浸提法相比具有一定的优势。
3 结论
(1)微波法提取柿叶总黄酮的最佳工艺条件为:乙醇质量浓度65%,固液比1∶25(g∶mL),微波辐射功率300 W,间歇辐射5次,每次3 min。该条件下柿叶总黄酮的提取率达5.22%。
(2)微波法提取柿叶总黄酮,高效、省时、节能、提取率高,与超声法和乙醇浸提法相比具有一定的优势。
(3)由于未去除的色素(如叶黄素、叶绿素、胡萝卜素等)的基团可与显色剂显色,增大吸光度,导致提取率假性提高,因此粗产品的纯化、脂溶性物质去除等十分关键。
参考文献:
[1] 郑皓,鲁周民,刘月梅,等.柿叶的药理作用研究进展及开发利用现状[J].西北农林科技大学学报(自然科学版),2007,35(12):81-86.
[2] 林娇芬,林河通,谢联辉,等.柿叶的化学成分、药理作用、临床应用及开发利用[J].食品与发酵工业,2005,31(7):90-96.
[3] 辛宁,丰杰,姚波.柿叶黄酮类提取分离及药理作用研究概况[J].中医药学报,2007,35(2):49-51.
[4] 张琳,陆维敏.黄酮类化合物抗氧化性能与其结构的关系[J].浙江大学学报,2006,33(2):187-191.
[5] 王树松,刘风云.不同生长期柿叶总黄酮和槲皮素的含量测定[J].药物鉴定,2007,16(9):22-23.
[6] 吴玉林,林娇芬,林河通,等.采收期对安溪油柿柿叶化学成分含量的影响[J].包装与食品机械,2007,25(6):19-22.
[7] 原江锋,杨建雄,张志琪,等.产地和季节对柿叶中总黄酮、芦丁和齐墩果酸含量的影响[J].中成药,2006,28(12):1757-1759.
[8] 岳红,赵晓莉,张颖.超临界二氧化碳萃取柿叶黄酮的工艺研究[J].化学研究与应用,2005,17(3):4228-4231.
[9] 张益娜,谢琼,李敏,等.新疆沙棘叶总黄酮的微波辅助提取和鉴定[J].新疆农业科学,2007,44(6):761-764.
[10] 卫静莉,高松平,董梅.柿叶提取黄酮类化合物方法及鉴定[J].林业科技开发,2007,21(3):47-49.
[11] 林燕铃,周文富.微波提取苹果渣中总黄酮的工艺研究[J].应用化工,2011,40(2):311-314.
[12] 余其凤,周文富.建宁产莲子心总黄酮的微波辅助提取研究[J].化学与生物工程,2011,28(2):32-37.
[13] 张岩,曹国杰,张燕,等.黄酮类化合物的提取以及检测方法的研究进展[J].食品研究与开发,2008,29(1):154-158.
[14] 钟方丽,王晓林,安媛.返魂草中总黄酮提取工艺研究[J].中国医院药学杂志,2008,28(22):1937-1939.
[15] 刘仙金,周文富.草珊瑚总黄酮的微波提取[J].化学与生物工程,2010,27(1):42-46.
[16] Li Y,Zhang D M,Yu S S,et al.A novel phenylpropanoid-substituted catechin glycoside and a new dihydrochalcone fromSarcandraglabra[J].Chin Chem Let,2006,17(2):207-210.
[17] 沈彤,贾忠建,郑尚珍.逆阿落中的黄酮化合物[J].天然产物研究与开发,2005,17(1):4-6.
[18] Akagi Takashi,Ikegami Ayako,Suzuki Yasuhiko,et al.Expression balances of structural genes in shikimate and flavonoid biosynthesis cause a difference in proanthocyanidin accumulation in persimmon(DiospyroskakiThunb.) fruit[J].Springer-Verlag,2009,230(5):899-915.
[19] Zgórka G,Hajnos A.The application of solid-phase extraction and reversed phase high-performance liquid chromatography for simultaneous isolation and determination of plant flavonoids and phenolic acids[J].Chromatographia Supplement,2003,57(Supp1):77-80.
[20] Ikegami Ayako,Akagi Takashi,Potter Daniel,et al.Molecular identification of 1-Cys peroxiredoxin and anthocyanidin/flavonol 3-O-galactosyltransferase from proanthocyanidin-rich young fruits of persimmon(DiospyroskakiThunb.)[J].Planta,2009,230(4):841-855.

