L-亮氨酸-U-13C6 的研制
张 亮,杜晓宁,李良君
(上海化工研究院 上海稳定同位素工程技术研究中心,上海 200062)
随着后基因组计划的到来,蛋白质组研究成为生命科学的最前沿。在用核磁共振(NMR)研究蛋白质结构以及定量蛋白质组学方面,13C标记的氨基酸和蛋白质都大有用武之地,已成为蛋白质组学领域不可或缺的重要工具[1]。13C标记L-亮氨酸产品在医药工业、生命科学、食品工业、分析测试等相关领域的广泛应用,特别是在医疗领域,其作用越来越突出。近年来,国内一些大医院也已开始利用13C标记L-亮氨酸对多种疾病进行诊断、治疗。如:北京协和医院利用13C标记的L-亮氨酸进行呼气实验[2],以判断氨基酸在肠道内的吸收是否异常,是否患有蛋白质吸收不良症;还可以通过给予口服氨基酸判断进行营养学治疗的可能性。天津第二医科大学附属医院以13C标记亮氨酸作为示踪剂跟踪蛋白质代谢是否异常,以此作为判断癌症的依据之一[3]。利用13C标记亮氨酸进行医学研究更是不胜枚举,如手术前后采用静脉输入13C标记亮氨酸的方法进行蛋白动力学研究[4],以亮氨酸-13C作为示踪剂测定兔子烧伤后整体蛋白代谢水平的改变[5]等。而这些13C标记L-亮氨酸试剂均从国外进口,昂贵价格。本工作拟通过生物发酵法,自行研制L-亮氨酸-U-13C6。
1 材料与方法
1.1 主要仪器设备
SCS-24型巡回式自动摇瓶机:上海市离心机械研究所提供;LS-B50L高压蒸汽灭菌锅:上海医用核子仪器厂提供。
1.2 主要试剂
13C标记葡萄糖:上海化工研究院自制;葡萄糖:AR级,中国医药集团上海化学试剂公司;H+型732阳离子交换树脂:上海树脂厂。
2 实验方法
2.1 培养基配方(g/L)
活化斜面培养基:葡萄糖1g/L、蛋白胨10g/L、牛肉膏10g/L、酵母膏5g/L、NaCl 2.5 g/L、琼脂条20g/L、pH7.0~7.2。在121℃下灭菌20min。
种子培养基:葡萄糖5g/L、蛋白胨10g/L、牛肉膏10g/L、酵母膏 5g/L、NaCl 2.5g/L、pH 7.0~7.2。在121℃下灭菌20min。
2.2 诱变选育
2.2.1 紫外诱变
取1环菌体,接种于液体完全培养基,在28℃下振荡(100r/min)培养9~10h。用灭完菌的移液器取1mL培养液,用无菌生理盐水稀释10倍后均匀涂布于保藏平板上,放入紫外照射箱进行诱变,诱变时间为30~100s。
2.2.2 DES诱变
取1环菌体,接种于种子培养基中,振荡培养6h,取10mL菌液,离心、去上清夜,菌体用磷酸缓冲液洗涤2次,之后加入一定量磷酸缓冲液配成菌液。向菌液中加入0.2mL DES诱变剂,搅拌诱变30min。用硫代硫酸钠溶液终止诱变。
2.2.3 紫外与DES复合诱变
将DES诱变完的菌体再进行紫外诱变,诱变条件与2.2.1节及2.2.2节相同。
2.2.4 营养缺陷型菌株的筛选
根据育种目标,本工作要选出“Met-+Ile-”突变株,即挑选仅能在添加蛋氨酸和异亮氨酸的平板上生长的突变株[6,7]。
2.2.5 抗性菌株的筛选
选育抗性突变株,可以解除亮氨酸合成途径上关键酶及限速酶的反馈抑制及反馈阻遏作用,进一步提高产酸累积量。通过在活化培养基中加入不同浓度不同种类的抗性药物制成抗性药物平板,将诱变后的突变株接入其中,挑选能够在高抗性药物浓度下生长的菌株。
2.3 发酵培养
2.3.1 种子液培养[8]
取1环活化后的菌体接入装有25mL种子培养基的500mL三角瓶中,9层纱布封口,30℃下,于巡回式摇瓶柜中培养15h,振摇速度为200r/min。
2.3.2 摇瓶发酵培养[9]
用移液枪取3mL上述培养好的种子液接入装有20mL发酵培养基的500mL三角瓶中,9层纱布封口,28℃下于巡回式摇瓶柜中培养,振摇速度为200r/min。培养期间定其检测残糖,当残糖下降到1%以下时,发酵反应停止。
2.4 提取方法
采用离子交换(732阳离子树脂)法进行分离,通过氯化铵、氨水两步洗脱法进行分离[10]。
2.5 分析方法
采用氨基酸自动分析仪[11]测定发酵液产酸量;采用凯氏定氮法测定L-亮氨酸纯度;采用同位素质谱仪测定13C丰度。
3 结果与讨论
3.1 目的突变株TS151的诱变选育[12]
育种谱图中各菌株的氨基酸积累情况列于表1。由表1可以看出,通过数次诱变选育,出发菌株ACTT39106逐渐带上蛋氨酸缺陷(Met- )、异 亮 氨 酸 缺 陷 (Ile- )和 带 磺 胺 胍(SGr)、α-氨基丁酸(α-ABr)、β-羟基亮氨酸(β-HLr)抗性标记等5种遗传标记,产酸也从原来的几乎没有提高到18.2g/L,满足了高丰度生产的需求。
3.2 目的突变株TS151的遗传稳定性检测
将高产菌株TS139和TS151在完全液体培养基上连续摇瓶培养10代。取第10代菌液用平板划线分离单菌落后转接斜面[13]。取斜面培养物制成经离心洗涤过的菌悬液。用滤纸片法验证缺陷型标记[14];各取0.2mL菌液均匀涂布在各个药物平板表面。28℃恒温培养72h,观察滤纸片周围和药物平板上有无菌体生长及生长情况,结果列于表2。
表2数据表明:TS139和TS151两株菌仍为双缺陷;TS139在8g/L磺胺胍抗性平板、8 g/Lα-氨基丁酸抗性平板上,TS151在8g/Lα-氨基丁酸抗性平板、4g/Lβ-羟基亮氨酸抗性平板上,均长出大小一致的小菌落。对每株菌随机挑取5个菌落的少量菌体涂片,用革兰氏染色,光镜下检查。结果显示,菌体形态与原始菌株ATCC39106的一致。
3.3 发酵工艺的优化
3.3.1 发酵配方的优化
1)不同氮源对L-亮氨酸发酵的影响
在发酵培养基中分别以硫酸铵、醋酸铵、尿素、硝酸铵和氯化铵(以硫酸铵用量为4%时的含氮量0.85g来计算其它氮源的添加量)为氮源培养36h,观察氮源对发酵的影响,结果列于表3。从表3可以看出,以醋酸铵为氮源时L-亮氨酸产量最高,其次为硫酸铵。醋酸铵在发酵中不仅起着氮源的作用,同时其醋酸根离子也参与了亮氨酸的合成代谢。
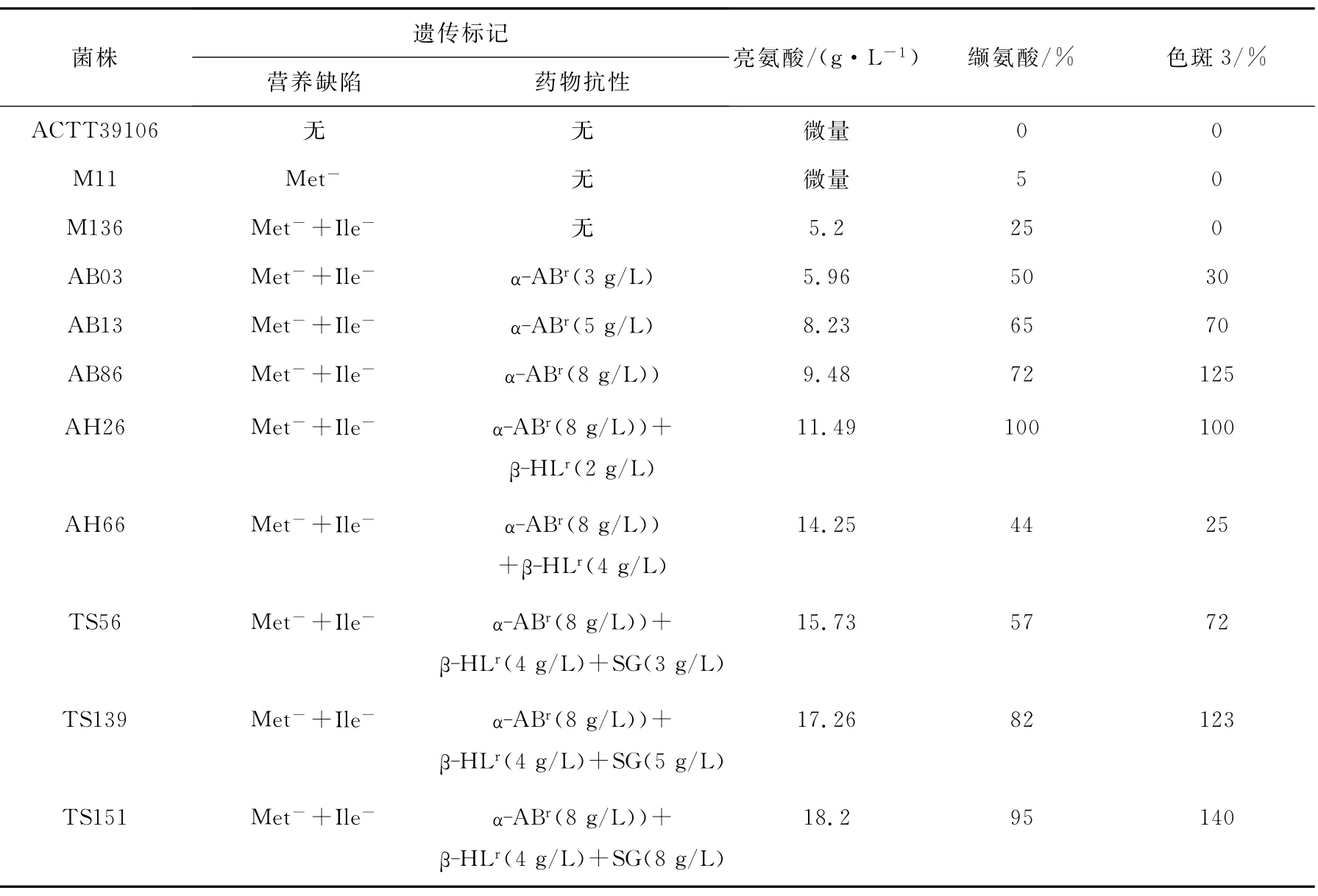
表1 育种谱图中各菌株的氨基酸积累情况
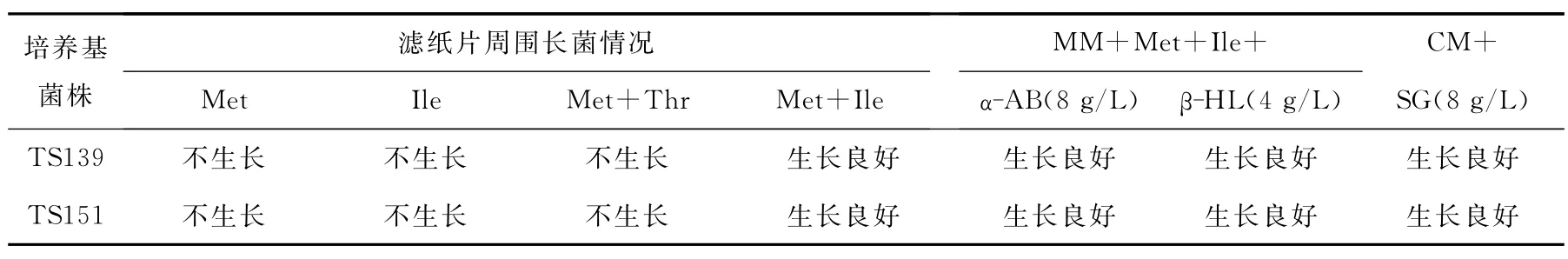
表2 遗传标记稳定性检验结果
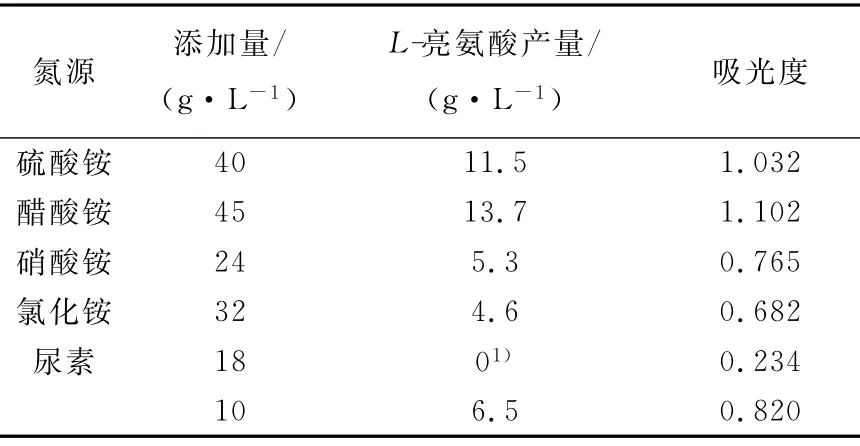
表3 不同氮源对L-亮氨酸发酵的影响
2)醋酸铵与硫酸铵配比对发酵的影响
在基础发酵培养基中,醋酸铵与硫酸铵的配比对发酵的影响列于表4。从表4可以看出,表中所列各种配比,都能满足菌体生长需要,但对产酸有不同的影响。当有20g/L醋酸铵时,添加20g/L硫酸铵,可以提高L-亮氨酸产量;只添加硫酸铵,含量即使高达40g/L,L-亮氨酸产量仍较低。
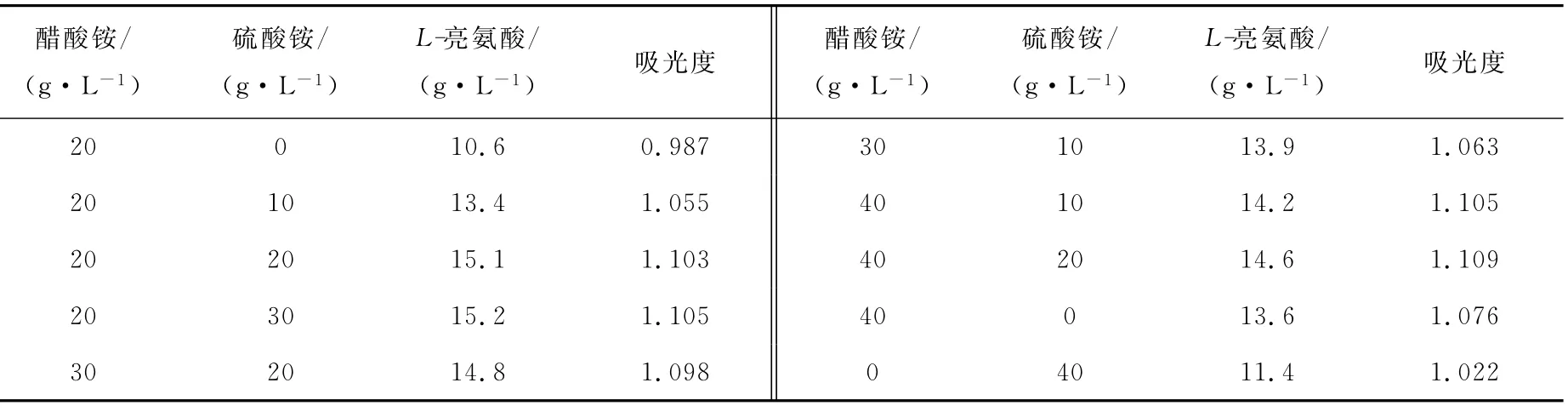
表4 醋酸铵与硫酸铵配比对L-亮氨酸发酵的影响
3)生物素对发酵的影响
为了研究生物素用量对L-亮氨酸发酵的影响,实验在不添加玉米浆(玉米浆中含生物素)的发酵培养基中进行,试验结果示于图1。由图1可知,生物素对L-亮氨酸发酵的影响很显著。生物素缺乏,菌体就不能生长;而当生物素的质量浓度提高到50~75μg/L时,菌体生长良好,可获得较高的L-亮氨酸产量。
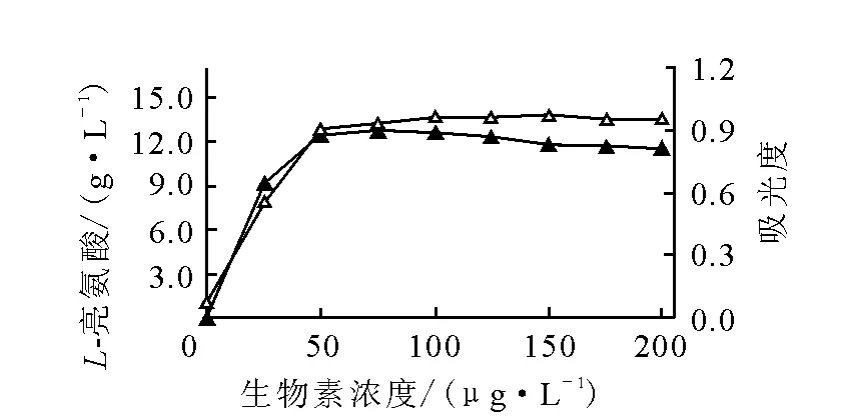
图1 生物素对L-亮氨酸发酵的影响
4)碳酸钙用量对发酵的影响
碳酸钙用量对发酵的影响结果示于图2。从图2可知,碳酸钙添加量为30g/L对发酵产酸最有利。
3.3.2 发酵条件的优化
1)温度对发酵的影响
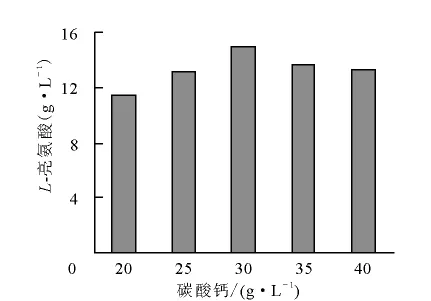
图2 碳酸钙用量对发酵的影响
温度对发酵的影响示于图3。由图3可知,在28~30℃时,菌体生长好、菌体浓度大,L-亮氨酸产量较高,尤以28℃最好,发酵产酸达到最大值18.53g/L。温度太低则菌体生长缓慢,难以完成对原料的转化;温度太高,菌体易衰老,菌体后劲不足,不利于高产L-亮氨酸。从图3数据来看,L-亮氨酸发酵温度控制在28℃为佳,最高不宜超过30℃。
2)装液量对发酵的影响
采用优化的培养基和相同的种子及接种比例,在同一摇床上,选择培养温度为28℃,在220r/min转速下振荡培养92h,考查250和500mL两种规格圆底三角瓶的不同装液量对L-亮氨酸发酵的影响,结果分别示于图4和图5。
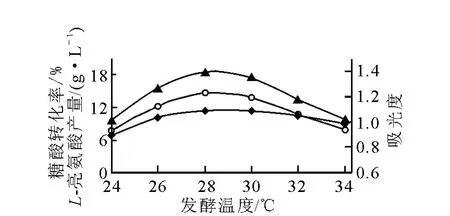
图3 温度对L-亮氨酸发酵的影响
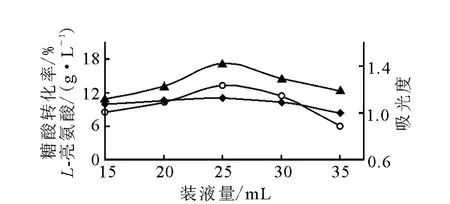
图4 250mL三角瓶装液量对L-亮氨酸发酵的影响
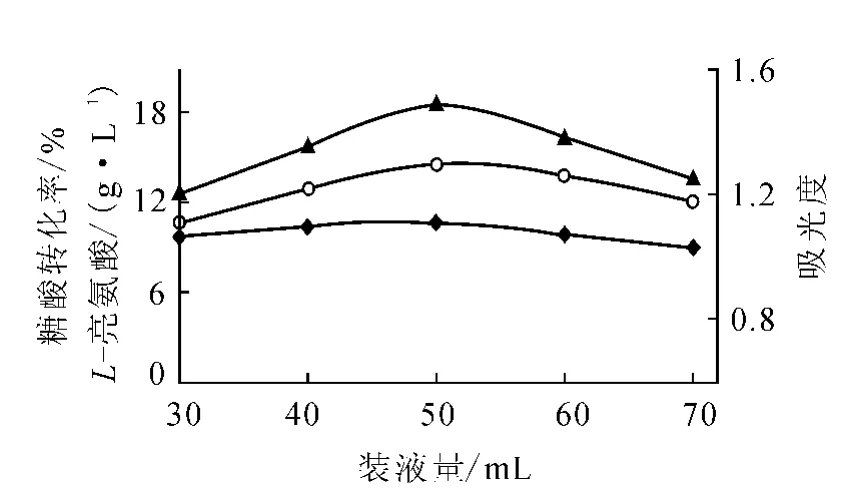
图5 500mL三角瓶装液量对L-亮氨酸发酵的影响
分析图4和图5可知,对相同规格三角瓶而言,由于固定了摇床转速,若装液量太少,在往复振荡时发酵液翻滚过于剧烈,使溶氧过大而导致产酸不高。而装液量过大则发酵液不易翻滚,使溶氧太少,导致产酸也不高。从本实验结果来看,500mL三角瓶装液50mL或250mL三角瓶装液25mL为佳。
3)pH对发酵的影响
在接种前用灭菌的5mol/L NaOH溶液重调发酵液pH,并在发酵过程中每隔4h调pH至所需值(±0.1)。实验在同一摇床上进行,发酵92h结束,结果示于图6。由图6得知,在发酵过程中控制pH7.0,有利于菌体生长和发酵产酸。实验中观测到,pH对发酵前期的菌体生长和中、后期发酵产酸影响都较大。pH7.0时菌体生长较快,培养至36~38h即结束对数生长进入稳定期。因此,发酵过程控制pH7.0,有利于菌体生长和发酵产酸。
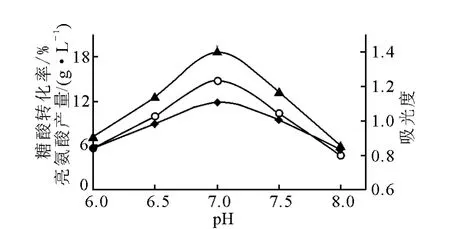
图6 pH对L-亮氨酸发酵的影响
3.4 同位素13C高丰度实验
将黄色短杆菌TS151从斜面接种于种子培养基中,每瓶接1环菌体,共接2瓶,置于摇床上,在28℃、220r/min下震荡培养20h。在无菌条件下按10%接种量将新鲜种子液接入发酵培养 基 中 (原 料 葡 萄 糖-13C 丰 度 为 99%),500mL三角瓶装液量50mL,置于巡回式摇床上,在28℃、220r/min下培养92h,直到发酵结束。发酵平均产酸16.6g/L。
将上述发酵液合并后用草酸调节pH至2~3,经离心分离(4 800r/min,30min),所得到的上清液用阳离子交换树脂(H+型)吸附。先用蒸馏水洗至中性,然后用0.2mol/L氯化铵溶液进行洗脱,收集L-亮氨酸-U-13C6单斑洗脱液;将上述洗脱液调pH至2.0后上阳离子交换树脂(H+型)脱盐;收集L-亮氨酸-U-13C6单斑洗脱液,放入活性炭脱色、结晶。真空干燥得到L-亮氨酸-U-13C6产品,产品丰度达97.03%,纯度98.5%,提取收率71.31%。
4 小 结
1)本研究以代谢控制发酵原理为基础,选育获得突变株黄色短杆菌TS151(带有5种遗传标记:Met-、Ile-、SGr、а-ABr、β-HLr),斜面连续转接10次,遗传标记稳定,高丰度产酸稳定在15g/L以上,空白产酸稳定在20g/L以上。
2)优化了L-亮氨酸-U-13C6生产的发酵配方和发酵工艺,通过高丰度实验进一步确认选育菌株TS151可应用于L-亮氨酸-U-13C6的生产。
[1] Len,Ching Hohn,Ho,et al.Synthesis of poly(L-leucine):United States,5541237[P],1996-07-30.
[2] 贝濂,江骥,胡蓓,等.13C-亮氨酸呼气实验与氨基酸吸收[J].质谱学报,2000(4):113.
[3] 王亮,李保义.胃肠外营养与肿瘤生长[J].肠外与肠内营养,1999,(4):228-230.
[4] 许勤.老年外科病人与生长激素的应用[J].实用老年医学,2000,(14):36-38.
[5] 林建华,吴国豪.以13C-亮氨酸作为示踪剂测定兔烧伤后整体蛋白代谢水平的改变[J].外科理论与实践,2007,(5):33-39.
[6] 宫景芗.L-亮氨酸产生菌的研究[J].微生物学杂志,1988,(1):22-26.
[7] Kisumi M.L-valine and L-leucine production by analogresistant mutants derived from serratia macesscens[J].J Bacteriol,1971,(107):824-830.
[8] Groeger U,Sahm H.Microbial Production of L-leucine from α-ketoisocaproate by Corynebacterioum glutaicum Appl[J].Microbiol Biotechnol,1987,(25):336-352.
[9] 张伟国,钱和.氨基酸生产技术及其应用[M].北京:中国轻工业出版社,1997:49-50.
[10]来彩霞,李福德.L-亮氨酸提取的研究[J].沈阳药学院学报,1991,8(4):285-286.
[11]常碧影,梁冬生,阎惠文,等.氨基酸分析技术的研究与现状[J].氨基酸杂志,1992,2:29-40.
[12]张素鑫 宛兰翠等.产L-白氨酸突变株的选育及发酵条件的研究[J].微生物学报,1979,19(2):180-186.
[13]李彤,黄和容.L-亮氨酸分批发酵稳定性探讨[J].微生物学通报,1991,18(2):91-96.
[14]Tsuchida T,Yoshinaga F,Kubota K.et al.Culture conditions for L-leucine production by strain No.218,a mutant of Brevibacterium lactofermentum 2 256[J].Agric Boil Chem,1975,39:1 149-1 153.

