整合三种教材 设计平衡教学
王 敏
(姜堰中学 江苏 姜堰 225500)
一、问题的提出
化学平衡是高中化学教学的一个难点,其理论性较强,对学生抽象思维能力要求较高,学生理解比较困难。因此,如何进行教学设计,既能使学生条理清晰地掌握好这部分知识,又能很好地培养学生的思维能力,触类旁通,为其他各类平衡的学习打好基础,值得化学教师思考。
二、设计的依据
根据最近发展区理论:人的思维是有弹性、有潜力的,在不同的社会环境中具有伸缩性。因此,对同一内容的学习,在不同时间分次进行,每次分别着眼于问题的不同侧面,使认识逐步深入。对于化学平衡这一内容,笔者整合了人教版、苏教版以及鲁科版三个版本的教材,按照这样的思路进行教学设计,收到了较好的效果。
三、化学平衡的教学设计
1.从实验的角度
第一课时根据人教版教材选修4《化学反应原理》26—28页,通过几组实验,让学生直观地感受到浓度、温度和压强的改变对平衡的影响,进而概括出平衡移动原理(即勒夏特列原理)。
2.从动力学的角度
第二课时从外界条件对正、逆反应速率的影响入手,借助“速率—时间”图象,分析平衡移动的方向和结果。
化学平衡状态是指系统内发生的化学反应既没有正向进行的推动力,又没有逆向进行的推动力,即正、逆反应速率相等。当条件改变后,如果正、逆反应速率不等了,平衡将向着速率大的反应方向移动,最终使正、逆反应速率再次相等,重新达到新的平衡状态。
(1)浓度对平衡的影响
如图1所示:
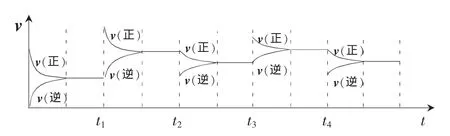
图1
t1时刻,增大反应物浓度,v正增大,v逆不变,从而使v正>v逆,平衡向正反应方向移动,最终v正和v逆均比原来大(说明反应物、生成物浓度均比原来大)。
t2时刻,减小反应物浓度,v正减小,v逆不变,从而使v正<v逆,平衡向逆反应方向移动,最终v正和v逆均比原来小(说明反应物、生成物浓度均比原来小)。
t3时刻,增大生成物浓度,v正不变,v逆增大,从而使v正<v逆,平衡向逆反应方向移动,最终v正和v逆均比原来大(说明反应物、生成物浓度均比原来大)。
t4时刻,减小生成物浓度,v正不变,v逆减小,从而使v正>v逆,平衡向正反应方向移动,最终v正和v逆均比原来小(说明反应物、生成物浓度均比原来小)。
(2)气体的压强对平衡的影响
气体压强的改变实质上也是改变气体的浓度。不同的是,前面所讲的浓度改变是改变平衡体系中单一组分的浓度,而压缩或扩容减压改变的是平衡体系中所有组分的浓度,因此v正和v逆均改变,平衡是否移动,向哪个方向移动取决于v正和v逆的变化幅度大小。
对于基元反应 aA(g)+bB(g)⇌dD(g)+eE(g)
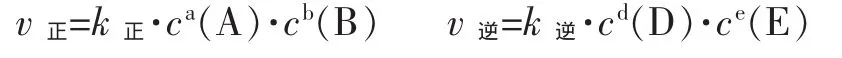
(式中k正是正反应的速率常数,k逆是逆反应的速率常数)
如图2所示:
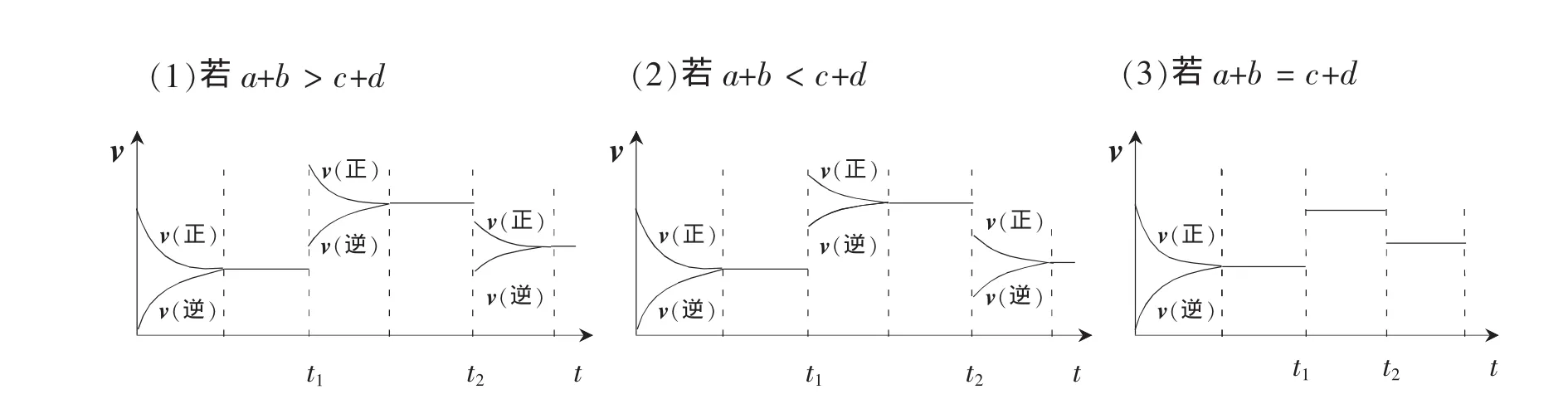
图2
当体积减小压强增大后,反应物和生成物浓度同等程度增大,v正和v逆均增大,增大幅度取决于a+b与c+d的相对大小。若a+b>c+d,则v正增大的幅度大于v逆,因而 v正>v逆,平衡向正反应方向移动;若 a+b<c+d,则 v正增大的幅度小于v逆,因而v正<v逆,平衡向逆反应方向移动;若 a+b=c+d,则 v正增大的幅度等于 v逆,因而 v正仍等于v逆,平衡不移动。
同理,当体积增大压强减小后,反应物和生成物浓度同等程度减小,v正和v逆均减小,减小幅度取决于a+b与c+d的相对大小。若a+b>c+d,则v正减小的幅度大于v逆,因而 v正<v逆,平衡向逆反应方向移动;若 a+b<c+d,则v正减小的幅度小于v逆,因而v正>v逆,平衡向正反应方向移动;若a+b=c+d,则v正减小的幅度等于v逆,因而v正仍等于v逆,平衡不移动。
(3)温度对平衡的影响
对于同一个可逆反应,由于吸热方向反应比放热方向反应的Ea大(如图3所示,显然,对于吸热反应,正反应比逆反应的Ea大),因此吸热方向反应速率随温度改变的幅度大。
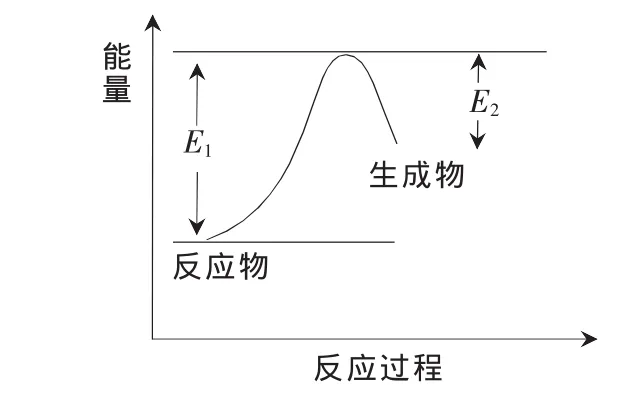
图3
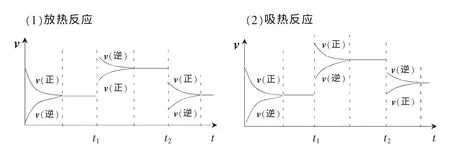
图4
如图4所示:
升高温度,v吸热和v放热均增大,但吸热方向的反应速率增大的幅度更大,因此v吸热>v放热,平衡向吸热反应方向移动;降低温度,v吸热和v放热均减小,但吸热方向的反应速率减小的幅度更大,因此v吸热<v放热,平衡向放热反应方向移动。
(4)催化剂
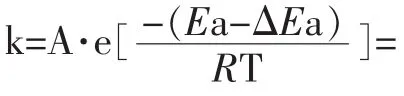
图5
3.从热力学的角度
第三课时从条件改变后,浓度商Qc和平衡常数K的关系入手,分析平衡的移动方向。
化学反应达到平衡状态是“热力学推动力”即反应的自由能△rGm等于零的状态。若定义:任一时刻的浓度商Qc为该时刻生成物浓度幂之积与反应物浓度幂之积的比值。平衡常数K为平衡时生成物浓度幂之积与反应物浓度幂之积的比值(平衡常数是温度的函数。温度不变,平衡常数不变。)当Qc=K时表示体系处于平衡状态;当Qc≠K,则体系会设法通过平衡的移动来改变Qc,从而使Qc=K,重新达到新的平衡状态。若Qc>K,平衡向逆反应方向移动使Qc降低;若Qc<K,平衡向正反应方向移动使Qc升高。
(1)浓度和压强对平衡的影响
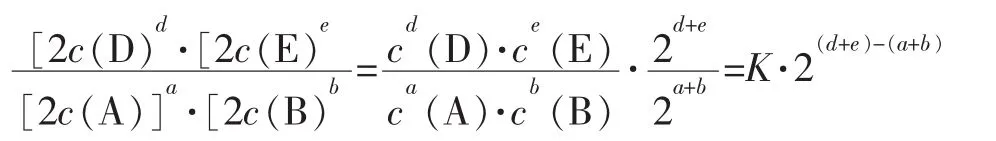
若 d+e>a+b,则 Qc 增大,Qc>K,平衡向逆反应方向移动,
若 d+e<a+b,则 Qc 减小,Qc<K,平衡向正反应方向移动,
若d+e=a+b,则Qc不变,平衡不移动。
即压强增大,平衡向气体分子数目减少的方向移动。
同理可得出,当体积扩大,压强减小时,平衡向气体分子数目增多的方向移动。
(2)温度对平衡的影响
温度改变时,平衡常数K也随之改变,而浓度商Qc不变。
对于放热反应,△rHθ<0,若 T2> T1,则 K2< K1,即升温,K减小,Qc>K,平衡向逆反应方向移动;对于吸热反应,△rHθ>0,若 T2>T1,则 K2>K1,即升温,K 增大,Qc<K,平衡向正反应方向移动。同理可得出,放热反应,降温平衡向正反应方向移动;吸热反应,降温平衡向逆反应方向移动。
(3)催化剂
催化剂的加入既不改变Qc,也不改变K,因此平衡不移动。
四、设计反思
本教学设计分三个课时,引导学生从三个不同的层面逐步深入地理解平衡的本质。这样设计目的是使学生对化学平衡移动原理不仅知其然,还知其所以然。同时每一课时又重点解决了不同的主题。第一课时重点是为了归纳总结出勒夏特列原理;第二课时重点是分析“速率—时间”图象,同时对前面学过的外界条件对反应速率的影响起很好的复习巩固作用;第三课时利用Qc和K的关系分析平衡移动方向是近两年江苏高考新增加的考点,这一方法对于解决一些条件改变后非单一物质浓度变化的情况(如:气体反应压缩体积、电离平衡和水解平衡中加水的问题等等)很有说服力。
强调一点:本教学设计中引入的阿累尼乌斯公式以及平衡常数和温度的定量关系公式只是作为工具帮助学生理解所用。比如提供了阿累尼乌斯公式,学生理解温度改变后,吸热方向比放热方向反应速率的变化幅度大便顺理成章。但公式本身不需要学生记忆,就如同题给信息一样,切勿人为增加学生负担。
[1] 北京师范大学等无机化学教研室.无机化学(上册)[M].北京:高等教育出版社,2006:279
[2] 北京师范大学等无机化学教研室.无机化学(上册)[M].北京:高等教育出版社,2006:257

