穴位埋线对糖尿病大鼠脂代谢紊乱及胰岛素敏感性的影响*
罗 雄,凌湘力
(贵阳医学院附属医院中医科,贵阳 550004)
糖尿病血管病变(DA)是糖尿病(DM)致死致残的主要原因,脂代谢紊乱是其重要危险因素,而胰岛素抵抗(IR)则是致血脂异常的主要发病机制[1]。因此,探讨IR与脂代谢紊乱之间的关系,并针对两者及早进行治疗对减少DA具有十分重要的意义。笔者观察穴位埋线对DM大鼠脂代谢紊乱和胰岛素敏感性等的影响并探讨其可能机制,为临床防治DA提供依据。
1 材料与方法
1.1 材料
1.1.1 动物 雄性Wistar大鼠48只,2~3月龄,体质量150~200 g,贵阳医学院动物中心提供,合格证号:SCXK(黔)2002-0001。
1.1.2 试剂及仪器 四氧嘧啶(Sigma公司美国)、血浆内皮素(ET)试剂盒、胰岛素试剂盒(天津九鼎医学生物工程有限公司)、一氧化氮(NO)试剂盒(南京建成生物工程研究所),载脂蛋白A(ApoAI)、载脂蛋白 B(ApoB)、载脂蛋白 a[Lp(a)]、空腹血糖(FBG)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白(HDL)、氧化低密度脂蛋白(ox-LDL)(上海荣盛生物试剂厂)、全自动生化分析仪(雅培2000,日本)。
1.2 方法
1.2.1 造模及分组 随机抽出10只大鼠作为正常组,其余空腹12 h后,按120 mg/(kg·d)的剂量腹腔注射2.5%四氧嘧啶柠檬酸缓冲液,连续2 d,正常组注射同等量柠檬酸缓冲液。48 h后尾静脉取血测血糖,以血糖值连续3 d≥11.1 mmol/L[2]者为造模成功。共成模24只,采用随机数字表法随机分为模型组和埋线组,每组12只,均用高脂饲料喂养,给予正常饮水。
1.2.2 治疗方法 造模成功第2天开始治疗。参照华兴邦大鼠穴位图谱[3],选取“胰俞”、“脾俞”、“足三里”。按照文献[4]取“4-0”号羊肠线剪成约0.3 cm的线段若干,穿入7号注射针的针尖中备用。大鼠经3%戊巴比妥钠腹腔麻醉后,右手持针于选定的穴位处以15°角斜向刺入,到达预定深度后缓慢将肠线推入穴位内,退出毫针,穴区用碘酒烧灼。4周埋线1次,左右交替。
1.2.3 标本采集 治疗16周后,模型组大鼠死亡5只,治疗组大鼠死亡3只。各组大鼠空腹12 h后称质量,经3%戊巴比妥钠腹腔麻醉后,右心室采血8~10 mL,取2 mL血液注入含7.5%乙二胺四乙酸二钠(EDTA·2Na)30μL和抑肽酶40μL的试管内混匀,4℃3600 r/min离心10 min分离血浆,-20℃保存待测ET;余血静置30 min后,常温下以3000 r/min离心 10 min,分别吸取血清待测 ApoAI、ApoB、Lp(a)、TG、TC、ox-LDL、HDL、NO、空腹胰岛素(FINS)、FBG。
1.2.4 指标检测 FINS、ET用放免法测定,NO用硝酸还原酶法测定,胰岛素敏感指数(ISI)采用李光伟等方法测算[5],因其为非正态分布,分析时取其自然对数,即ISI=Ln[1/(FBG×FINS)];ApoAI、ApoB、Lp(a)、TG、TC、HDL、ox-LDL、FBG 用全自动生化分析仪测定。
2 结果
2.1 血清 FBG、FINS、NO、血浆 ET含量及 NO/ET、ISI的比较 见表1。从表1可知,模型组较对照组血清FBG 含量显著升高(P<0.01),说明 DM 模型成功;血清FINS、血浆ET含量显著增高(P<0.01或P<0.001),ISI、血清 NO 含量及 NO/ET 比值显著降低(P<0.01或 P<0.001)。经治疗后,血清 FBG、FINS 和血浆 ET均显著下降(P<0.05,P<0.01或P<0.001),NO含量及ISI、NO/ET比值则明显升高(P<0.05,P<0.01或P<0.001)。直线相关分析显示,ET与ISI呈显著负相关(r=-0.967,P<0.001 或 r=-0.986,P<0.001),NO 与ISI呈正相关(r=0.959,P<0.001)。
表1 各组血清FBG、FINS、NO、血浆ET含量及NO/ET、ISI的比较(±s)Tab.1 Comparison of serum FBG,FINS,NO,plasma ET and NO/ET,ISI between different groups(±s)
注:与模型组相比 *P<0.05,**P<0.01;△P<0.001。
组别 n FBG(mmol/L) FINS(μg/L) ISI正常组 10 5.19±0.64** 10.80±1.68** -4.00±0.15**模型组 7 18.54±0.97 16.66±1.24 -5.72±0.08埋线组 9 10.02±0.54** 14.62±1.08* -4.98±0.07**组别 n NO(μmol/L) ET(ng/L) NO/ET正常组 10 56.37±2.78△ 46.33± 9.36△ 1.26±0.26△模型组 7 28.82±3.76 119.17± 8.03 0.24±0.02埋线组 9 39.02±4.46△ 83.88±13.87△ 0.48±0.11△
表 2 各组血清 TG、TC、HDL、ox-LDL、ApoAI、ApoB、Lp(a)含量比较(±s)Tab.2 Comparison of serum TG,TC,HDL,ox-LDL,ApoAI,ApoB,Lp(a)among different groups(±s)
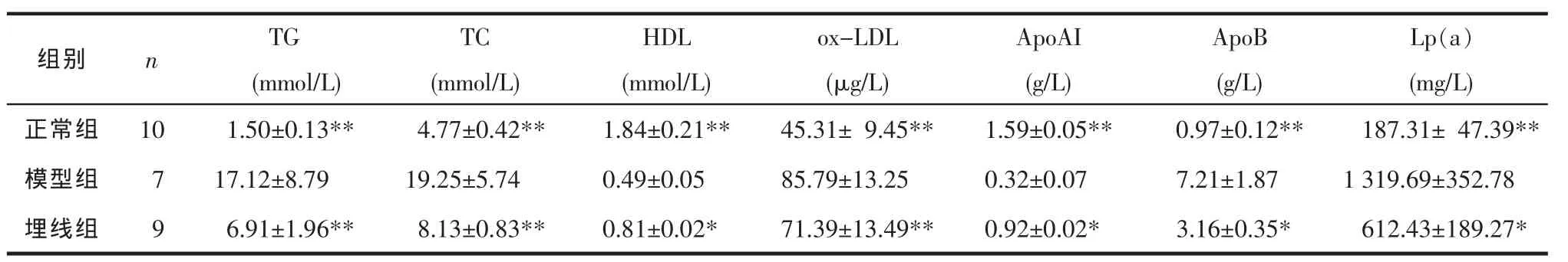
表 2 各组血清 TG、TC、HDL、ox-LDL、ApoAI、ApoB、Lp(a)含量比较(±s)Tab.2 Comparison of serum TG,TC,HDL,ox-LDL,ApoAI,ApoB,Lp(a)among different groups(±s)
注:与模型组相比*P<0.05,**P<0.01。
ApoAI ApoB Lp(a)(mmol/L) (mmol/L) (g/L) (g/L) (mg/L)正常组 10 1.50±0.13** 4.77±0.42** 1.59±0.05** 0.97±0.12** 187.31± 47.39**模型组 7 17.12±8.79** 19.25±5.74** 0.32±0.07** 7.21±1.87** 1319.69±352.78**埋线组 9 6.91±1.96** 8.13±0.83** 0.92±0.02** 3.16±0.35** 612.43±189.27**组别 n TG TC HDL(mmol/L)1.84±0.21**0.49±0.05**0.81±0.02**ox-LDL(μg/L)45.31±9.45**85.79±13.25**71.39±13.49**
2.2 血清 TG、TC、HDL、ox-LDL、ApoAI、ApoB、Lp(a)含量的比较 见表2。从表2可知,模型组较正常组血清 TG、TC、ox-LDL、ApoB 和 Lp(a)含量均显著升高(P<0.01),HDL、ApoAI则明显降低(P<0.01),说明DM大鼠出现脂代谢紊乱。埋线治疗后,血清TG、TC、ox-LDL、ApoB、Lp(a)均明显下降(P<0.05,P<0.01),HDL、ApoAI含量明显上升(P<0.05,P<0.01)。
3 讨论
研究认为,IR可能是引起脂代谢紊乱的中心环节。IR时由于激素敏感脂酶(HSL)活性增强、脂蛋白酯酶(LPL)活性降低,使TG及极低密度脂蛋白(VLDL)的合成增加而代谢缓慢,致使水平升高[6]。VLDL不断分解为LDL,且IR使LDL经受体通路代谢受阻,使血中LDL升高。高浓度的LDL灭活内皮衍生松弛因子或NO,降低其清除氧的能力,从而导致了ox-LDL水平升高[7]。IR时,高胰岛素通过激活 β-羟基-β-甲基戊二酰辅酶 A(HMG-CoA)还原酶的活性、增加肝甘油三酯酶(HTGL)的活性及使ApoAI浓度显著降低等途径,降低血浆HDL浓度及功能;IR使卵磷脂胆固醇酯酰转移酶(LCAT)活性减弱也是HDL水平降低的机制。同时,脂代谢紊乱可通过抑制胰岛素分泌、使胰岛素受体减少和活性降低、干扰胰岛素与受体结合等,使胰岛素生物效应降低,促成和加重IR[8]。
脂代谢紊乱和IR在DA的发生发展中具有重要的作用。脂代谢紊乱产生的大量游离脂肪酸(FFA)可明显抑制NO合成,从而间接导致内皮功能障碍,同时聚集在血管内皮细胞附近,使各种细胞因子的合成和表达增加,导致血管内皮损伤[9]。ox-LDL被巨噬细胞吞噬后形成泡沫细胞,滞留于血管壁上,使血管内皮细胞坏死脱落,内皮保护屏障遭到破坏;ox-LDL还与特异性抗体结合,激活补体系统产生免疫应答,提高单核巨噬细胞促凝血活性,从而促进血管病变的形成[10]。ApoAI和ApoB分别是HDL和LDL的主要载脂蛋白,ApoB被认为是最具有致动脉硬化的因子,ApoAI则是防止动脉粥样硬化的保护因子,两者影响着血浆HDL、LDL含量,调整两者至正常水平对于防治DA具有重要意义。HDL能清除脂质在血管壁内的沉积,可促进TC逆转运及防止LDL聚集于动脉壁,还通过其自身所含的对氧磷脂酶抑制LDL氧化,从而影响AS的产生和进展。高Lp(a)血症是导致动脉粥样硬化性的一个独立危险因素。IR能使内皮依赖性的舒血管反应降低或消失,并伴随缩血管反应增强以及血管平滑肌细胞增殖,导致血管内皮功能失调出现血管病变。
DA属中医“消渴病血瘀证”范畴,脾肾气阴两虚和瘀血痹阻是其主要病机。穴位埋线疗法是多种方法和效应的集中和整合,有平衡阴阳、调理脏腑、运行气血、疏通经络等作用。“肾俞”可补肾生精,“脾俞”可健脾益气,两穴埋线可调节血管内皮功能,改善微循环[4],增强 INS 的敏感性[2];“足三里”对循环系统有整体调节作用,能改善患者的血液流变学,3穴合用可培补脾肾、益气养阴活血。研究结果表明,治疗后的DM大鼠血浆ET、血清FBG、TG、TC、ox-LDL 、ApoB、Lp(a)均明显下降(P<0.05,P<0.01或 P<0.001),NO、HDL、ApoAI含量及 NO/ET 比值、ISI明显上升(P<0.05,P<0.01或 P<0.001)。提示穴位埋线对DM大鼠脂质代谢紊乱和IR具有良性调整作用,机制可能是羊肠线埋入穴位内,通过神经-内分泌-体液-免疫等多系统、多途径和多靶点以提高机体各种代谢物质的活性,促进机体对葡萄糖和脂肪的利用;通过改善微循环,促进INS与受体结合,增强INS的敏感性,减轻机体的胰岛素抵抗,使LPL、LCAT的活性增高,抑制HSL、HMG-CoA还原酶及HTGL的活性,从而调节脂质代谢,以缓解脂代谢紊乱;调整NO与ET的水平,改善血管内皮功能障碍,最终达到治疗DA的目的。
[1] Grag A.Insulin resistance in the pathogensis of dyslipidemia[J].Diabetes Care,1996,19(4):387-396.
[2] 罗 雄,凌湘力.穴位埋线、中药复方对糖尿病大鼠血管内皮功能及胰岛素敏感性影响的研究[J].中华中医药杂志,2008,23(1):489-491.
[3] 华兴邦.大鼠穴位图谱研制[J].实验动物与动物实验,1991,3(1):1.
[4] 罗 雄,凌湘力.穴位埋线对糖尿病大鼠血浆内皮素、血清一氧化氮的影响[J].甘肃中医,2007,20(3):46-47.
[5] 李光伟,潘孝仁,Stephen Lillionja,等.检测人群胰岛素敏感性的一项新指数[J].中华内科杂志,1993,32(10):656-660.
[6] 杨文英.2型糖尿病与脂代谢紊乱[J].中华心血管病杂志,2003,31(9):718-720.
[7] 邓晋红.2型糖尿病血脂代谢紊乱在其血管病变发生发展中的意义[J].山西医科大学学报,2003,34(6):527-528.
[8] 李 晶,孙 侃,周 婷,等.2型糖尿病脂代谢紊乱及胰岛素抵抗与视网膜病变的关系[J].石河子大学学报(自然科学版),2005,23(6):715-718.
[9] 李玉红,张德芹,王 茜,等.糖脂清对实验性2型糖尿病大鼠脂代谢的影响[J].天津中医药大学学报,2010,29(2):77.
[10] 陈 涛,王中心.血管内皮功能障碍与2型糖尿病[J].医学综述,2006,12(6):376-379.

