红曲霉菌株的诱变及其发酵条件研究
高国赋,魏宝阳,杨 瀚,孙继民
(1.湖南省农业信息与工程研究所,湖南 长沙 410125;2.湖南农业大学生物科学技术学院,湖南 长沙 410128;3.湖南省土壤肥料研究所,湖南 长沙 410125)
红曲霉 (Monascus purpureusWent.)别名 红曲、红糟、红大米,是散囊菌目中的一属子囊菌曲霉科真菌,存在于树木、土壤和堆积物等处。菌落初为白色,老熟后变成淡粉色、紫色或灰黑色,多形成红色。红曲色素是以红曲米(经红曲霉菌发酵的籼稻、粳稻、糯米等)为原料,利用现代的生物技术提取而成的天然着色剂。红曲色素对pH、温度、金属离子氧化还原剂等较其他天然色素稳定,是一种优良的食品天然色素。在食品天然色素中,红曲色素一直是国内外学者研究的焦点。有学者对其进行毒性试验证明:红曲色素安全无毒。红曲色素应用于酒、糖果、熟肉制品、糕点等食品的着色,也可用于医药和化妆品的着色。目前,由于我国红曲色素发酵生产设备、色素后期提取及精炼工艺比较落后,菌种产色的水平较低,色素生产成本较高,限制了红曲色素在生产中的应用。通过菌种诱变选育提高生产菌株的发酵水平,降低生产成本,对我国食用色素产业的提升有着重要的意义。笔者采用紫外线和亚硝酸对红曲霉进行诱变,获得突变株,并对其发酵条件进行研究,以期为红曲色素的生产应用提供参考。
1 材料与方法
1.1 材料与仪器
试验材料为红曲霉(湖南农业大学生物科技学院生物工程系保存);仪器有灭菌锅(TOMY SS-325)、紫外可见分光光度计(VIS-9100)等。
1.2 试验方法
1.2.1 红曲霉紫外诱变处理 紫外灯照射时间分别为:30、60、90、120、150、180、210 s;将盛有孢子悬液的平皿置于震荡器上充分振荡,紫外灯下照射30 s后,接种于3个平板,暗处培养,操作完成后再次紫外线处理30 s,按此操作直到完成7个梯度的照射,30℃暗培养,3 d后观察,选取比出发菌株菌落大、颜色深的菌落。
1.2.2 红曲霉化学诱变处理 制备亚硝酸浓度为0.01、0.02、0.04、0.08 mol/L 的诱变固体平板培养基。每平板涂布接种孢子悬液,30℃培养,2 d后观察生长情况,选择比出发菌株菌落大、颜色深的菌落,接种至不含亚硝酸的PDA斜面培养基上培养。
1.2.3 诱变菌株发酵能力测定 接种诱变株孢子悬液1 mL至发酵培养基,于30℃、130 r/min培养7~8 d,取菌液,4 000 r/min 离心 15 min,用 75%乙醇作为空白对照测定波长410 nm(黄色素)和510 nm(红色素)处的OD值。
1.2.4 色价测定 胞外色素色价测定:在没有标准品的情况下,参照国内外文献,采用测定色素的色价来表示色素含量,色价(μ/mL)=测得的OD值×稀释倍数,取2 mL发酵液过滤,以体积分数75%乙醇做空白对照,分别在410 nm、510 nm处测定胞外红黄色素和红色素。
菌体色素色价测定:称取菌体0.05 g,用70%乙醇溶解,定容至100 mL,振摇30 min后静置,取1.0 mL溶液,加70%乙醇溶液9 mL,用70%乙醇溶液作空白对照,在510 nm处测吸光度,按公式计算成品色价(μ/g)。
成品色价(μ/g)=OD510×1 000/样品质量
1.2.5 发酵条件的研究 发酵条件的影响因素选取按正交表L16(45)(见表1)的设计进行液体培养。

表1 发酵条件研究的L16(45)正交表
(1)发酵条件与产色水平研究:菌液10 mL,4 000 r/min离心15 min,取上清液,以75%的乙醇作为空白对照,分别在510 nm测定红色素和410 nm处测定黄色素,按公式计算总色价。
总色价=测得(OD410+OD510)×稀释倍数。
(2)菌体量与发酵条件间关系的研究:菌液过滤,滤渣用蒸馏水反复冲洗至滤液无色透明,称取菌体的湿重。同时每样品挑取0.05 g菌体备用,余下菌体烘干后称重。
(3)胞内色素与胞外色素含量分析:取16只试管,每支加入75%的乙醇10 mL,取步骤(2)中的0.05 g菌体,30℃萃取24 h后,4 000 r/min离心15 min,取上清液在410 nm和510 nm处测定OD值并记录,按公式计算每g湿菌体色价。
每克湿菌体色价=A值×100×稀释倍数。
2 结果与分析
2.1 优良菌株的筛选结果
经过紫外诱变和化学诱变后,分别筛选出了一株比出发菌株生长快、菌落大、颜色深的优良菌株,编为5-2和1-1-3,对应的照射剂量和诱变剂量为150 s和0.04 mol/L,在对比试验中,5-2和1-1-3的发酵色价分别为7.09 U/mL和12.32 U/mL,并且1-1-3的生长速度大大优于5-2(见图1)。因此最终筛选出1-1-3为最佳菌株,在同时接种的4只斜面试管中,1-1-3生长最为密集,菌落厚约2 mm,2.5 d后有大量菌丝长出,相比之下,5-2号菌落稀疏、2.5 d观察时并未长出菌丝;因此确定1-1-3为最佳诱变菌株。

图1 紫外诱变与化学诱变菌株对比
2.2 正交试验结果
2.2.1 不同因素对产色量的影响 从表2和表3可以看出,各条件下色素产量有差异,色素产量最低的是2号和8号,没有菌体生长,色素产量最高的是10号,其对应的发酵条件为:转速160 r/min,pH为6,温度为32℃,麦芽糖和牛肉膏。
从表2中可以看出,对胞外色素产量影响由大到小依次为:温度>氮源>碳源>pH值>转速,最适培养条件:转速为 160 r/min,pH 值为 6,32℃,麦芽糖和牛肉膏;不同的温度对胞外色素产量影响最大,最适宜温度为32℃,不同氮源胞外色素产量差异较大,无机氮培养均在比较低的水平。
从表2中还可以看出,对胞内色素产量影响由大到小依次为:氮源>pH值>碳源>温度>转速,最适培养条件:转速为130 r/min,pH值为5,26℃,麦芽糖和硝酸钠。培养环境偏酸性,产色量与温度成反比,与胞外色素情况相反,胞内色素对硝酸钠的吸收较好。
2.2.2 不同因素对菌体生长的影响 各因素对干重与湿重的影响效果大致相同,按影响的重要性从大到小依次为:温度>碳源>氮源>转速>pH值。
2.2.3 红色素与黄色素产量间的关系 从表3中可以看出,在细胞外部,黄色素产量普遍大于红色素,单个常量最多是黄色素;总色素的产量以1号、7号、10号为多,所有条件中红、黄色素产量差异较大的也是前述3瓶,可见产量越大,两种色素产量差异越大,但不超过20%。在细胞内部,色素产量总体偏低,黄色素产量普遍大于红色素,与胞外色素一样,色素总产量越大,红黄色素产色量的差异越大。红色素产量的最佳发酵条件与菌丝生长除pH值因素以外基本相同,偏中性有利于红色素的合成,最佳条件也与胞外色素的最佳条件一致,说明胞外色素在色素总产量中占主要部分。研究结果表明,黄色素的最佳发酵条件为:转速160 r/min,pH值为5,温度32℃,麦芽糖和牛肉膏,与红色素基本相同。

表2 正交试验结果
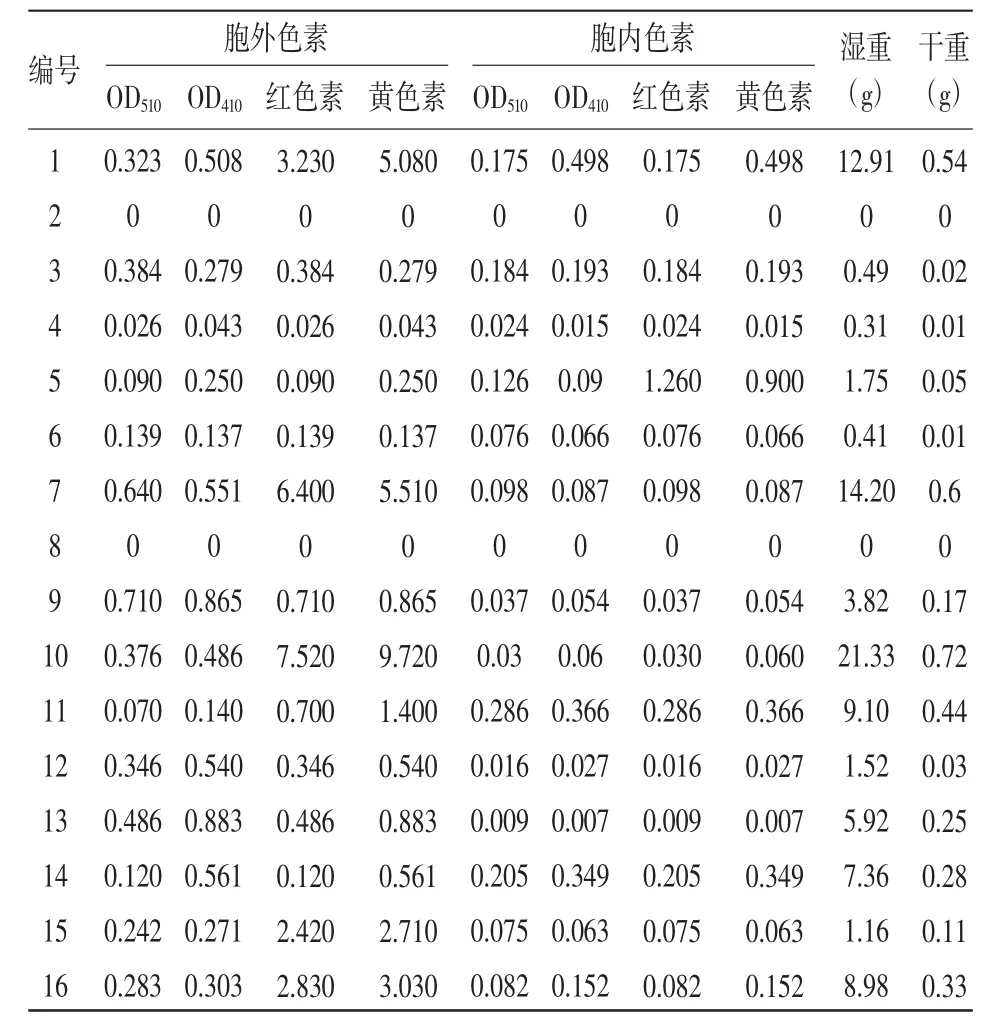
表3 各条件下胞内外色素含量与干湿重
3 讨论
通过紫外诱变和以亚硝酸为诱变剂的化学诱变,得到了一株生长速度快、颜色深、稳定性好的突变株1-1-3号。紫外诱变和化学诱变这两种传统方法仍然是育种的有效手段,操作简便、成本低、效果好,但是也存在缺点:工作量极大、定向诱变难度大,诱变剂量过大易引起负突变株比例增加,而且化学诱变试剂对环境和人体都有一定危害,如果能在代谢水平和基因水平上有所突破,那么传统诱变方法有望退出人们的视线。
在发酵条件的研究中发现,红曲霉所产的色素大部分分泌到胞外,产胞外色素最佳条件为:转速160 r/min,pH 值为 6,32℃,麦芽糖和牛肉膏;产胞内色素最佳条件为:转速 130 r/min,pH值为5,26℃,麦芽糖和硝酸钠;菌体生长最佳条件为:转速160 r/min,pH值为6,32℃,葡萄糖和牛肉膏。
红色素和黄色素波长的最大吸收峰分别为510 nm和410 nm。从研究结果来看,胞内和胞外的两种色素产量差异幅度较小,基本成正比,总色价较大的摇瓶中两色素色价相差的绝对值比总色价小的要大,可能是因为红色素和黄色素在代谢途径上游有相同的前体物质,而在代谢途径下游的酶活性差异较大,相同的前提物质合成量越大,最终产物—色素的产量差异也就越大。红曲色素产量与氮源的种类密切相关,有机氮的利用优于无机氮;试验还发现,酸性条件下有利于黄色素的合成,在生产发酵中如需增加红色素的产量,可以通过调节发酵液的pH值偏中性来达到增产的目的;胞外色素产量的最佳调价为pH=6,有研究认为,偏酸时,H+可以与红曲霉中的营养物质结合,从可交换的结合物或细胞表面置换出某些阳离子,使红曲霉产生较多的色素;而当pH偏碱时,水合氢离子和OH-能降低营养物质的溶解度和细胞表面的电荷,从而降低产色。
[1]周立平.红曲研究生产现状与进展[J].酿酒科技,2003,(4):34-35.
[2]方元超,杨 柳.红曲霉研究进展综述[J].四川食品与发酵,1999,(1):5-10.
[3]谢晓琼,甘纯玑.水溶性红曲黄色素与2种天然黄色素的稳定性比较[J].福建农业大学学报,1997,26(3):378-381.
[4]王雅芬,傅华月.红曲霉的有效生理活性物质及应用[J].杭州科技,2000,(5):25-27.
[5]王伟平,吴思方.复合诱变红曲霉选育红色素高产菌株[J].湖北工学院学报,2003,(8):5-7.
[6]梁智嫦.高色价高稳定性红曲霉菌种的选育[J].食品科技,2000,(5):35-36.
[7]王雅芬,袁康培.低产桔霉素红曲霉菌种的选育研究[J].食品科学,2003,(8):93-97.
[8]赵 华,赵树欣,张 维,等.己酸乙酯高产菌的诱变选育[J].酿酒科技,1997,(3):23-25.
[9]洪智勇,毛 宁.激光对红曲霉的诱变作用[J].激光杂志,2002,(5):53-54.
[10]Hajjaj H,Blance P J,Groussac E,et al.Improvement of Red Pigment Citrinin Production Ratio as a Function of Environmental Conditions by Monascus rubber[J].Biotechnology and Bioengineering,1999,64(4):497-501.
[11]Han O,Mudgett R E.Effect of Oxygen and Carbon Dioxide Partial Pressure on Monascus Growth and Pigment Production in Solid-state Fermentation[J].Biotechnol,1992,(8):5-10.
[12]许赣荣,李凤琴,陈 蕴,等.红曲霉桔霉素的检测方法及红曲霉产桔霉素的判别方法[J].微生物学通报,2004,31(3):16-20.
[13]毛 宁,陈细香,杨 青,等.红曲霉产生的生物活性物质的研究[J].福建师范大学学报,1994,10(4):80-84.
[14]Johns M R,Stuart D M.Production of Pigment by Monascus Purpureus in Solid Culture[J].Ind.Microbiol,1999,(8):23-28.
[15]陈义光,彭德娇,张晓蓉,等.pH对红曲霉产红曲色素的影响[J].湖北农学院学报,2002,22(2):147-149.
[16]Blance P J,Loret M O,Goma G.Production of Citrinin Various Species of Monascus[J].Biotechnology Letters,1995,17(3):291-294.
[17]赖建平,罗 军,曹强辉,等.红曲色素生产菌的诱变筛选及培养[J].广州大学学报,2000,14(3):46-50.
[18]石 鹤,周 毅.红曲霉液体培养条件与产色的关系[J].食品研究与开发,2004,25(3):83-85.

