里氏木霉40359原生质体制备条件研究
张晓烜,李景富,王傲雪
(1.东北农业大学成栋学院,哈尔滨 150030;2.东北农业大学园艺学院,哈尔滨 150030;3.东北农业大学生命科学学院,哈尔滨 150030)
菌种选育是纤维素酶生产的基础性工作,里氏木霉是产纤维素酶最好的菌种之一[1]。目前里氏木霉高产纤维素酶菌株的选育方式有:利用高能电子、紫外线、亚硝酸钠、亚硝基胍、硫酸二乙酯处理和原生质体融合等方法,使酶的活力得到很大的提高[2]。原生质体没有细胞壁,对诱变剂反应灵敏,容易得到正突变株,是得到优良菌种的有效方法。所以原生质体的制备研究是有必要且有应用价值的研究。
本文对影响里氏木霉(Trichoderma reesei)40359原生质体制备和再生的条件:包括菌龄、水解酶液的种类及浓度、酶解温度、酶解时间、再生培养基的稳渗剂进行了研究。得到了较好的里氏木霉原生质体制备的条件,为进一步的育种工作奠定基础。
1 材料与方法
1.1 材料
1.1.1 供试菌株
里氏木霉(Trichoderma reesei)40359 购自于中国工业微生物菌种保藏中心。
1.1.2 培养基
菌丝培养基:200 g马铃薯,20 g葡萄糖,蒸馏水定容至1 000 mL。
霉菌完全培养基(CM):1.4 g(NH4)2SO4、5.0 g葡 萄 糖 、 2.0 g KH2PO4、 6.9 g NaH2PO4、 0.3 g MgSO4·7H2O、10.5 g柠檬酸(含两个结晶水)、0.3 g尿素、0.2 g Tween-80、5 mg FeSO4·7H2O、1.6 g MnSO4、1.4 g ZnSO4·7H2O、2.0 mg CaCl2·2H2O、15%蛋白胨,用蒸馏水定容至1 000 mL。
基础培养基:2.8 g(NH4)2SO4、0.6 g 尿素、4 g磷酸钾、40 g葡萄糖、100 g蔗糖、600 mg CaCl2、200 mg MgSO4·10H2O、10 mg FeSO4·7H2O、1.8 mg ZnSO4·7H2O、3.2 mg MnSO4·H2O、4 mg CoCl2·6H2O,配制固体培养基时需加人琼脂17~20 g,用蒸馏水定容至1 000 mL。
1.1.3 高渗透稳定缓冲液(STC)
0.6 mol·L-1山梨糖醇,1×10-2mol·L-1Tris-HCl,1×10-2mol·L-1CaCl2,pH 7.5,用蒸馏水定容至1 000 mL。
1.2 方法
1.2.1 菌丝的制备
在PDA上培养里氏木霉菌6 d,待绿色的分生孢子产生后,用无菌水洗下孢子,配成1×107个·mL-1孢子悬液,取1 mL加到菌丝培养液中,在30℃和转速150 r·min-1条件下恒温振荡培养6~18 h。
1.2.2 原生质体的制备
取振荡培养的菌丝培养液,用4层无菌纱布过滤收集菌丝体,用无菌水冲洗3次,STC冲洗至菌丝半透明,收集菌丝。称取5 mg菌丝在25 mL小三角瓶中,加入10 mL新配制好的酶液,振荡培养。用移液枪吸取STC在酶解三角瓶中,不断的吸吹,冲散菌丝释放原生质体,用4层无菌的擦镜纸过滤除去菌丝碎片,收集滤液置于小离心管中,3 000 r·min-1,离心5 min,收集原生质体,再用STC反复洗涤3次,采用血球计数板计数,将浓度调到 1×106~7个·mL-1,悬浮于 STC 中在 4 ℃冰箱中保存。
1.2.3 原生质体的再生
将制备的原生质体用STC液稀释至约1×103~1×106个·mL-1,每个稀释度取0.1 mL 并涂再生平板。30℃,培养3 d计算菌落数。用无菌水对原生质体稀释成 1×103~1×106个·mL-1,剧烈震荡,取稀释液各0.1 mL,涂布于基本培养基,30℃,培养3 d计算菌落数,并计算再生率。再生率的计算方法如下:

2 结果与分析
2.1 菌龄对原生质体生成的影响
酶的作用受菌龄的影响,菌龄过长,菌丝细胞壁易发生老化增厚,不易于释放原生质体;过短则菌丝体易破裂,释放原生质数量较少[3]。本实验选择7个菌龄:6、8、10、12、14、16、18 h。由图1可见,12 h释放的原生质体数最多,为6.11×105个·mL-1,其次为 10 h。

图1 菌龄对原生质体形成的影响Fig.1 Effect of fungus age on protoplast formation
2.2 细胞壁水解酶液种类及浓度对原生质体生成的影响
水解酶的种类与浓度对原生质体的形成有重要影响。一般来说,酶浓度越大形成的原生质体越多,但是随着酶浓度的不断加大,但当酶溶液达到一定浓度时,原生质体形成数量就不再增加或增加不明显。由表1可知,在纤维素酶和蜗牛酶的基础上增加溶菌酶,对40359菌株破壁效果有一定的提高。从1号、3号、5号作用结果看,酶解相同时间,原生质体数量随酶液浓度加大而增加。所以,5号酶液即2.0%纤维素酶和2.0%蜗牛酶对40359破壁效果最好。得到的原生质体数为6.13×105个·mL-1。
2.3 酶解时间对原生质体形成的影响
酶解时间对原生质体的质量和产量影响较大。
充足的酶解时间是原生质体化的必要条件。酶解时间过短,原生质体形成不完全,酶解时间过长,原生质体脱壁太完全,原生质体的质膜也易受到损伤,从而影响原生质体的再生。本实验用2%纤维素酶和2%蜗牛酶,设定酶解时间为0.5、1、1.5、2和2.5 h等5个时间组,定时取样观察原生质体形成情况。结果表明(表2),随着酶解时间的延长,原生质体大量形成,酶解2.5 h时原生质体的形成数量虽然在继续增长,但是前期形成的原生质体开始消解、变形,不利于原生质体的再生。
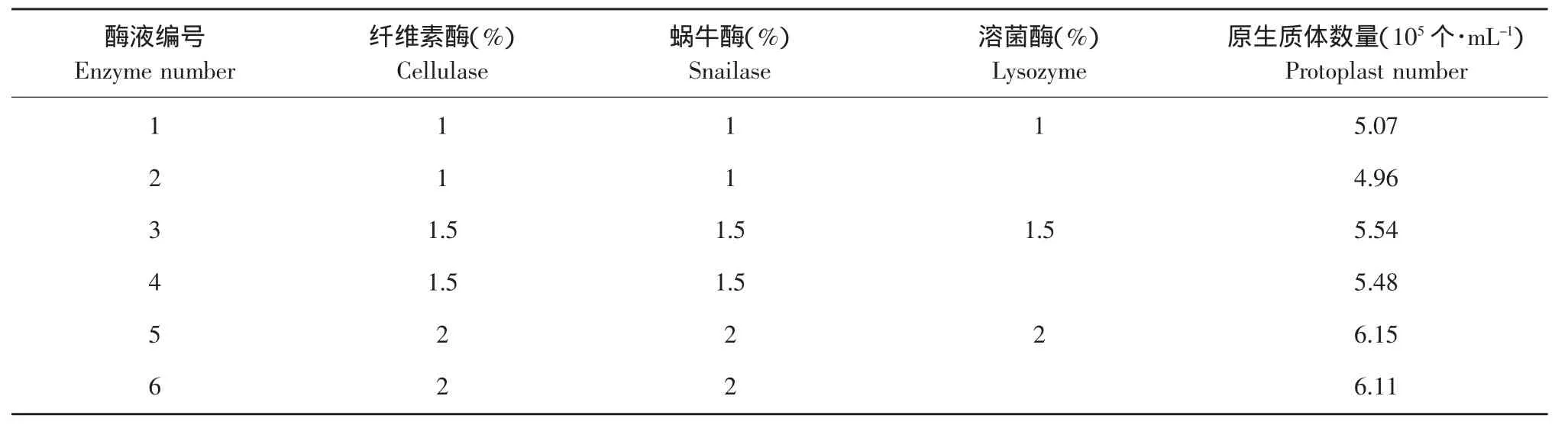
表1 水解酶种类和浓度Table 1 Variety and concentration of hydrolytic enzyme

表2 酶解时间对原生质体形成的影响Table 2 Effect of time of enzymic hydrolysis on protoplast forming
2.4 酶解温度对原生质体形成的影响
细胞壁水解酶受水解温度影响较大,温度不但影响着酶的活性,同时也影响着微生物的生理状态。酶解温度除了要考虑酶的最适温度外,还要考虑原生体再生率。本试验酶解温度选择26℃,28℃,30℃,32℃,34℃作用时间2 h。如图3所示30℃时得到的原生质体数最多,较高的酶解温度会损伤原生质体,使其释放量降低(见图3)。
2.5 不同稳渗剂对原生质体再生的影响
分别用 0.6 mol·L-1KCl、0.6 mol·L-1NaCl、0.6 mol·L-1蔗糖(Sugar)、0.6 mol·L-1甘露醇(Mannitol)、0.6 mol·L-1肌醇 (Inositol)、0.6 mol·L-1山梨糖醇(Sorbitol)作稳渗剂加入到完全再生培养基中,将原生质体稀释成 1×105~6个·mL-1,吸取 0.1 mL 涂于再生平皿,30℃,培养3 d,计算再生率。由图4可见,0.6 mol·L-1蔗糖作稳渗剂,原生质体的再生率高为8.4%。采用上述制备原生质体的最佳条件试验,结果原生质体的形成数为6.14×105个·mL-1,再生率为10.2%。
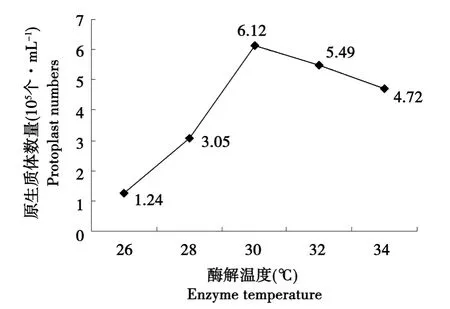
图3 酶解温度对原生质体形成的影响Fig.3 Effects of enzyme temperature on protoplast formation
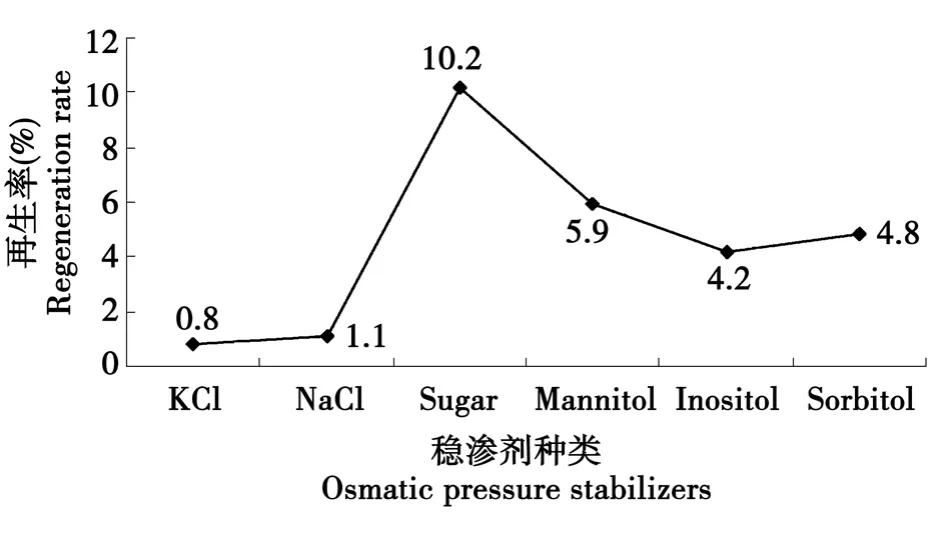
图4 不同稳渗剂对原生质体再生的影响Fig.4 Effects of different osmatic pressure stabilizers on protoplast regeneration
3 讨论
微生物能否较好地形成原生质体与许多因素有关,如:微生物所处的生理状态,酶作用的时间,酶的种类、浓度,酶解时的温度等等。所以在进行原生质体育种的准备阶段,一定要明确所用菌株的原生质体形成条件,为后续工作打好基础。
3.1 菌龄的选择
不同种属及同种属微生物原生质体的制备对菌龄的要求都存在着一定的差异。酶的作用受菌龄的影响,菌龄过长,菌丝细胞壁易发生老化增厚,不易于释放原生质体;过短则菌丝体易破裂,释放原生质数量较少[3]。曾大兴研究表明[4],较幼嫩的菌丝形成的原生质体纯度高、质量好,随着菌龄的增加,原生质体的纯度和质量都下降,不同种属的菌株所要求的菌龄不同。艾云灿等研究认为里氏木霉的最佳菌龄为18~20 h[5],峥嵘、张功的试验则表明绿色木霉在培养11 h时获得的原生质体数量最多[6]。本试验结果表明培养里氏木霉40359的最佳时间是12 h。
3.2 酶解种类与浓度
一般来说,酶浓度过低,不利于原生质体的形成,酶浓度过高,则导致原生质体再生率的降低。若原生质体形成率很高,而其后的再生率很低,对于原生质体育种来说是不大适合的。由于丝状真菌的细胞壁组成较为复杂,有纤维素、几丁质等,要获得较高的原生质体得率,选择适宜的水解酶系统非常重要。本试验采用2%纤维素酶和2%蜗牛酶混合液效果好。
3.3 酶解时间的选择
酶解时间对原生质体的质量和产量影响较大。充足的酶解时间是原生质体化的必要条件。酶解时间过短,原生质体形成不完全;酶解时间过长,原生质体脱壁太完全,原生质体的质膜也易受到损伤,从而影响原生质体的再生。徐敬友等认为禾谷镰孢菌在酶解2 h时细胞壁开始破裂,5 h左右原生质体数量达到高峰后趋于稳定[7]。本试验结果表明,酶解时间在2 h原生质体形成较好。
3.4 酶解温度
细胞壁水解酶受水解温度影响较大,温度不但影响着酶的活性,同时也影响着微生物的生理状态。酶解温度除了要考虑酶的最适温度外,还要考虑原生体再生率。本试验最适酶解温度为30℃。
3.5 稳定剂的选择
丝状真菌原生质体再生率较低,可能是因为有原生质体缺少细胞核或其它重要的细胞器[8]。另外,渗透压稳定剂对原生质体的再生率有重要的影响。由于仅有细胞质膜的原生质体对渗透压很敏感,很容易破裂,致使原生质体外流而使细胞死亡,这必需在再生培养基中加入渗透压稳定剂[9-10]。渗透压在原生质体制备中,不仅起到保护原生质体免于膨胀作用,还有助于酶和底物的结合,本试验用0.6 mol·L-1蔗糖作再生培养基的稳渗剂,这与傅力等的研究结果一致[8]。
4 结论
微生物能否较好地形成原生质体与微生物的生理状态和酶的作用状态等有一定的关系[11],其中酶的作用受菌龄、酶种类及浓度、酶解时间、酶解温度以及渗透压稳定剂的影响[12]。本研究对影响里氏木霉原生质体产生的条件进行研究,通过试验得到里氏木霉40359原生质体制备的最佳条件是:采用2%纤维素酶和2%蜗牛酶混合液,菌龄为12 h,酶解温度30℃,酶解时间2 h,用0.6 mol·L-1蔗糖作再生培养基的稳渗剂,原生质体的形成数为6.14×105个·mL-1,原生质体再生率为10.6%。
[1]王景林.高活力纤维素酶菌株康氏木霉B-7的选育与产酶条件的研究[J].生物技术,1996,6(6):14-17.
[2]王义甫.高活性纤维素酶菌株778-1的筛选鉴定与产酶条件的研究[J].微生物学报,1983,23(2):143-149.
[3]韩黎,陈世平,索继红.微小根毛霉致病株的原生质体形成条件[J].微生物学通报,1998,25(1):27-29.
[4]曾大兴,梁宗琦.哈栖木霉和球孢白僵菌原生质体的形成与再生[J].西南农业学报,1995,8(1):80-85.
[5]艾云灿,赵学慧,汪履绥.黑曲霉和里氏木霉原生质体形成与再生条件选择[J].华中农业大学学报,1994,13(1):55-58.
[6]峥嵘,张功.绿色木霉原生质体的制备与再生研究[J].内蒙古师范大学学报:自然科学(汉文)版,2002,31(2):145-149.
[7]徐敬友.禾谷镰孢原生质体的形成与再生[J].江苏农学院学报,1997,18(2):71-73.
[8]傅力,丁友日,王得培,等.里氏木霉DWC原生质体制备条件的研究[J].新疆农业大学学报,2003,26(2):52-55.
[9]曹玉桃,彭化贤,文成敬,等.木霉生防菌T25与T55原生质体形成与再生条件的研究[J].西南农业学报,2007,20(5):997-1001.
[10]章运,傅力.沪酿3042米曲霉原生质体制备条件的研究[J].石河子大学学报:自然科学版,2004,22(6):519-521.
[11]王敬国,张卫国,夏林,等.黑曲霉原生质体转化效率影响因子研究[J].东北农业大学学报,2007,38(4):511-514.
[12]李楠,许修宏.黑木耳原生质体制备及再生的研究[J].东北农业大学学报,2009,40(7):34-37.

