红花黄色素对内皮细胞增殖及凋亡的保护作用
韩海玲,孙玉芹,2*,宋文刚,朱玉红,吕冬燕,朱艳彬,何海涛,姜 欣
(1.北华大学附属医院心脑科,吉林吉林市132011;2.吉林大学;3.吉林市水务集团职工医院)
血管内皮细胞为衬覆于血管内腔面的单层扁平细胞,依靠其正常的增殖和凋亡平衡,保证了血管的结构和功能正常[1]。近年研究表明,越来越多的心血管疾病的发生、发展与内皮细胞增生及凋亡有关[2-4]。经皮冠状动脉介入治疗(PCI)术后再狭窄作为目前冠心病介入研究领域的研究热点。在目前的研究中,对血管内皮细胞的研究少见。本课题以LPC作用于血管内皮细胞建立再狭窄的内皮细胞模型[4],并探讨红花黄色素对血管内皮细胞增殖的干预作用,以期为为临床应用奠定理论基础。
1 材料与方法
1.1材料RPMI-1640培养基(GIBCO,美国),胎牛血清(杭州四季青公司),红花黄色素、LPC、胰蛋白酶、四甲基偶氮唑蓝(MTT)、二甲基亚砜(Sigma,美国),Annexin VFITCPPI凋亡检测试剂盒(深圳晶美生物工程有限公司),酶联免疫检测仪(Biotek,美国),荧光显微镜(Olymypus,日本),流式细胞仪(BD,美国),低温离心机(Beckman,美国),NO测试盒(南京建成生物工程公司),高速低温离心机(Eppendorf,美国)。
细胞株及细胞培养:人脐静脉内皮细胞(Human umbilical vein endothelial cells,HUVECs)株CRL-1730由吉林大学基础医学院馈赠。采用常规培养,将冻存的HUVECs株解冻复苏后,含15%胎牛血清RPMI1640培养液,于37℃、100%饱和湿度、5%CO2孵箱培养。常规传代,待细胞进入对数生长期后用于实验。
设计分组:取对数生长期细胞,按传代方法制成单细胞悬液,进行如下分组:(1)正常对照组当细胞长至60%-70%满时换培养液。(2)LPC组当细胞长至60%-70%满时换含有浓度为10 mg/L的LPC的PBS培养液。(3)低浓度HYSA组(LPC+HYSA2)当细胞长至60%-70%并加入浓度为50 mg/L的HYSA孵育8 h后,再加入LPC(终末浓度10 mg/L),进行相应检测。(4)高浓度HYSA(LPC+HYSA1)组HYSA浓度为100 mg/L,余同低浓度HYSA组。
1.2MTT实验消化对数生长期的细胞,制成2×105细胞/ml细胞悬液,接种于96孔平板,每孔2×105细胞悬液100 μ l,同时分别加入上述终浓度药物和RPMI1640培养液。培养 24 h、48 h、72 h,采用MTT法检测各组细胞的增殖率。
1.3电镜检测细胞传代培养,分别加入LPC和上述药物浓度的RPMI1640培养液,3 d后倒置镜拍片后,消化并收集细胞,用 Epon 812包埋,切片,随机拍摄电镜照片,观察超微结构。
1.4流式细胞检测细胞凋亡及细胞周期变化消化C6,以5×105,接种25 cm2培养瓶,24 h后更换培养液,分别加入上述终浓度的药物和RPMI1640培养液,此日被称为第0天。在第3天分别收集各组细胞,以去除细胞碎片,加入0.5 ml冰冷的70%乙醇中,-20℃冰箱保存。将制备好的单细胞悬液固定液弃去(1 000 r/min,10min),冷PBS漂洗2次(1 000 r/min,5 min),调整细胞为1×109L-1,加入PI染液1.0 ml,避光染色30 min,上机分析,资料由ModFit软件收集、贮存和分析。检测各组的凋亡和细胞周期变化。见表1。
1.5NO测定(用Griess法测定)将HUVECs接种于6孔板上,置于37℃、5%CO2培养箱中静置培养。24 h后按实验分组进行干预后,每组6个复孔,置于37℃、5%CO2培养箱中静置培养48 h后,采用硝酸还原酶法测定NO含量,按试剂盒说明书操作。
1.6统计学处理
2 结果
2.1HYSA能够逆转LPC对HUVECs细胞增殖具有抑制作用且随剂量的增加和作用时间的延长,作用效果增加明显。经统计学处理,有显著性差异(P<0.05)见图1。
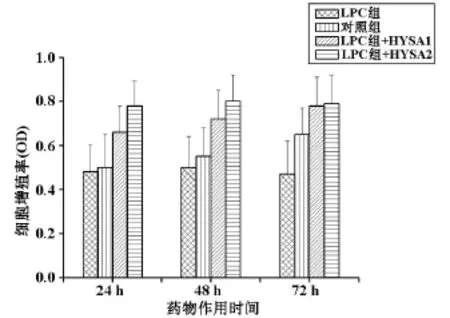
图1 不同剂量不同作用时间红花黄色素对血管内皮细胞增殖的影响
2.2电镜检测细胞凋亡超微结构变化电镜下可见LPC作用后细胞呈现凋亡形态学改变,细胞体积变小(约为原细胞体积的70%)、变圆:细胞核内染色质离散,开始向核膜下集中;细胞表面微绒毛变细,细胞体及细胞核进一步缩小,核内染色质呈颗粒状或块状凝集于核膜下,内质网和粒体膜碎裂呈空泡状;微绒毛脱落、减少,核膜在核膜孔处断裂,将染色质分割成若干个核碎片;胞质内空泡增多。而对照组细胞体积大,胞质少,核内染色质分布均匀;细胞表面有大量的微绒毛。用LPC诱导内皮细胞凋亡可行,见图2a,b。

图2 a 对照组

图2 b 经LPC作用24 h
2.3应用流式细胞术(Flow cytometry,FCM)检测经LPC作用于HUVECs细胞后,与对照组相比凋亡比率有明显提高,同时细胞经HYSA作用后细胞细胞凋亡明显降低并且随浓度的增大,凋亡率降低,LPC可以诱导HUVECs细胞凋亡,而HYSA可降低LPC作用后HUVECs细胞凋亡比率,较对照组,均有明显降低(P<0.05)。见表1。

表1 流式细胞检测不同处理组细胞凋亡比率
2.4HSYA对NO水平的影响由表2结果可见,加药孵育48 h时,HYSA组细胞培养液中的NO水平比对照组显著增高(P<0.01);但LPC组仍远远低于对照组(P<0.01)。
表2 HSYA对HUVECs培养液中NO水平的影响(s,n=6)

表2 HSYA对HUVECs培养液中NO水平的影响(s,n=6)
与对照组及LPC组比较 *P<0.01
组别 浓度/(mmol·L-1)NO/(umo l·L-1)对照 - 47.46±3.28 LPC 10 mg/L 30.65±4.63 HSYA1 50 mg/L 190.12±9.83*HSYA2 100 mg/L 70.75±6.46*
3 讨论
经皮冠状动脉介入术是目前治疗心肌缺血安全、有效和常用的方法,但经皮冠状动脉腔内成形术(PTCA)后 3-6个月内再狭窄发生率达 30%-50%,金属内支架的应用降低了PTA术后急性闭塞的发生率,但并未能彻底解决再狭窄的问题。严重影响了PTCA的远期疗效。支架部位的再狭窄更加难以处理等不利因素。大量实验研究及临床观察表明再狭窄与血栓形成、内膜增厚和血管重构有关,内皮细胞的损伤、修复及功能改变在其中扮演重要角色。一方面血管平滑肌细胞(VSMC)增殖;内皮损伤导致其本身功能障碍,释放NO等活性物质减少,进一步导致内皮功能障碍及VSMC增殖增强;另一方面另外内皮细胞损伤及损伤后增殖减弱、凋亡增强,使其对血管内皮覆盖的完整性遭到破坏,有利于VSMC过度增生及迁移至内膜等,从而导致再狭窄的发生等[1,5-7]。
LPC是磷脂酶A2水解磷脂酰胆碱的产物之一,可由人体内低密度脂蛋白胆固醇氧化过程中经磷脂酶A2催化产生,具有脂的第二信使功能,能够激发细胞的多种反应[8]。LPC是ox-LDL的主要活性成分,在AS发生发展中起着重要作用[9]。
本课题以LPC孵育HUVECs制造PCI术后再狭窄的内皮细胞模型基于以下考虑:内皮细胞损伤是PCI术后再狭窄的生物性因素之一,在再狭窄的形成中ox-LDL是内皮细胞损伤的因素之一[9],ox-LDL作用于内皮细胞膜,引起一系列过氧化链式反应,并产生大量的脂质过氧化物。这些脂质过氧化物不仅直接损伤细胞的DNA,还诱导内皮细胞凋亡。而LPC是ox-LDL的主要活性成分,在ox-LDL致病过程中起重要作用。有研究显示,ox-LDL可导致内皮细胞NO生成减少[10]。NO具有舒张血管、抑制平滑肌细胞增殖和血小板聚集、减少白细胞黏附、减轻内皮细胞损伤的作用[8,9]。本研究以溶血卵磷脂孵育HUVECs后,HUVECs增殖减弱,具有凋亡诱导其凋亡率增加,NO合成减少,和ox-LDL引起的内皮细胞损伤是一致的,亦和动物实验的内皮细胞损伤是一致的[10],因此LPC诱导的血管内皮细胞损伤可作为PCI术后再狭窄的内皮细胞模型。
近年的大量研究显示,中药提取物在保护血管内皮功能、防治PCI术后再狭窄中起重要作用。但对红花黄色素的研究较少。最近的一些研究显示红花黄色素除改善血脂异常外,尚可抑制血小板黏附聚集、预防和延缓动脉粥样硬化进程、降低心血管急性事件的发生率[11]。本研究显示HYSA可改善LPC诱导的血管内皮细胞损伤。HYSA干预后,内皮细胞增殖增强,凋亡减弱,NO合成增加,且红花黄色素的对内皮细胞的保护作用呈时间效应、浓度效应依赖关系,与报道的研究[12]结果一致。红花黄色素的这些作用有利于保护PCI术损伤的血管内皮,避免金属支架与血液的直接接触,减少不良刺激;HYSA促进NO等活性物质分泌,从而舒张血管,抑制平滑肌细胞增殖和血小板聚集,减少白细胞黏附,有效防止血栓形成,因此红花黄色素能够起到防治PCI术后再狭窄的作用。总之,HYSA可改善LPC导致的血管内皮细胞增强及凋亡变化,增加血管内皮细胞NO浓度,加速内皮损伤后的内皮化,为红花黄色素防治PCI术后再狭窄提供了理论基础。当然,HYSA对HUVECs细胞的保护作用的机制尚待进一步探讨。
[1]DiazMN,Frei B,V ita JA,et al.Antioxidants and atherosclerotic heart disease[J].N Eng1 J Med,1997,337(6):408.
[2]MatsumotoT,Kobayash IT,KamataK.Role of Lysophosphatidylcholine(lpc)in atherosclerosis[J].CurrM ed Chem,2007,14(30):309.
[3]Kockx MM,Knaapen MW.The role of apoptosis in vascular disease[J].J Pathol,2000,190(3):267.
[4]Werner N,N icken ig G.Influence of cardiovascular risk factors on endothelial progenitor cells:limitations for therapy[J].Arter ioscler Thromb Vasc Biol,2006,26(2):257.
[5]徐志勇,张良安.经皮冠状动脉介入术的现状[J].国外医学.心血管疾病分册,2003,30(3):147.
[6]Lowe HC,Oester le S N,Khachig ian L M.Coronary instentrestenosis:current status and future strategies[J].J Am Coll Cardiol,2002,39:183.
[7]Wiegman P J,Barry W L,McPherson J A,et al.All-trans-Retinoic Acid Limits Restenosis After Balloon Angioplasty in the Focally Atherosclerotic Rabbit:a favorable effect on vessel remodeling[J].Arterioscler Thormb Vasc Bil,2000,20(1):89.
[8]Asahara T,BautersC,Pastore C,et al.Local delivery of vascular endothelial growth factor accelerates reendothelializat ion and attenuat es intimal hyperplasis in ballon2injured rat carot id artery[J].Circulation,1995,91:2793.
[9]Van Hove C,Carreer Bruhwy ler F,Geczy J,et a.l.Long-term treatment with the NO-donormolsidomine reduces circulating ICAM-1 levels in patients with stable angina[J].Atherosclerosis,2005,180(2):399.
[10]张 岭,宋 艳,李长龄,等.羟基红花黄色素A对常氧/低氧犬胸主动脉内皮细胞增殖的影响[J].中草药,2008,39(1):930.
[11]ZhuHB,Wang ZH,Ma CJ,et al.Neuroprotective effects of hydroxysafflor yellow A:In vivo and in vitro studies[J].Planta Med,2003,69:429.

