神经生长因子对哮喘小鼠TNF-α表达的影响
靳英丽,陈丽波,刘超英,鲁继荣
(吉林大学 1.白求恩医学院 药理教研室,吉林 长春130021;2.中日联谊医院;3.第一医院)
支气管哮喘是一种以气道高反应性和慢性气道炎症为特征的变态反应性疾病,多种炎症细胞及细胞因子介导了这一炎症过程。与哮喘发病有关的细胞因子很多,其中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)是哮喘发病过程中的重要因素。神经生长因子(NGF)是对神经元的生长、分化、存活期延长具有促进作用的一类神经营养因子。Bonini S等[1]在其研究中发现,哮喘患者血清NGF水平增高,且过敏性哮喘病人血清NGF水平比非过敏性哮喘病人高。对过敏性哮喘小鼠进行抗NGF处理,可明显减轻哮喘引起的气道高反应性。提示在哮喘发病的机制中,可能存在NGF与其它炎症因子的协同作用,而此类协同的具体过程和发生机制,则有待进一步研究。
本研究应用抗NGF抗体对哮喘小鼠模型进行处理,研究NGF被动性降低对哮喘小鼠血清及肺组织TNF-α表达水平的影响,由此探讨NGF参与哮喘发病的可能机制。
1 材料与方法
1.1材料动物:选取30只8-10周龄雌性BALB/c小鼠,体重20-24克,由吉林大学白求恩医学院动物室提供。试剂:卵白蛋白(OVA,Sigma公司)、兔抗小鼠β-NGF多克隆抗体及小鼠TNF-αELISA检测试剂盒(武汉博士德生物有限公司)、TaKaRa RNA LA PCR Kit(AMV)Ver.1.1及DNA Marker(大连宝生物公司)。设备:超声雾化器(德国百瑞公司)、水平电泳仪和酶标仪(Bio-Rad公司)、PCR仪(AB-2700型)(基因公司)、凝胶图像分析系统(UVI公司)。
1.2实验动物分组及模型制备取30只8-10周龄雌性BALB/c小鼠,随机分为3组:正常对照组、哮喘组、NGF阻断组,每组 10只。(1)哮喘组:于实验第1 d、第14 d致敏,即卵白蛋白 20 μ g由 1mg氢氧化铝乳化,总体积200 μ l,腹腔注射。在第21~27 d,以超声雾化器雾化3%OVA盐水气溶胶吸入激发,每天1次,每次30 min。(2)NGF阻断组:哮喘模型建立同哮喘组,但于每次激发前3 h,先经鼻滴入抗小鼠β-NGF 抗体(稀释度 1∶50)50 μ l。(3)正常对照组:在每次雾化及腹腔注射时均以等量生理盐水应用对照。各组小鼠均于末次激发后24 h处死,取组织进行相关检测。
1.3ELISA法测定血清TNF-α的含量末次雾化激发24 h后,麻醉小鼠,摘眼球取血约 500 μ l,2 000 rpm离心约2-3 min,取上清冻存于-70℃。收集齐后按照ELISA检测试剂盒的说明书,测定TNF-α含量。
1.4RT-PCR法检测肺组织中TNF-αmRNA的表达
1.4.1肺组织总RNA的提取:依据Trizol法总RNA提取试剂盒说明书操作。
1.4.2引物合成:TNF-α及内参照GAPDH引物均由上海生工生物工程公司合成。TNF-α上游引物:5′-ATGAGCACAGAAAGCATGATCC-3′,下游引物:5′-TCACAGAGCAATGACTCCAAAG-3′,扩 增 产 物 长 度 708 bp;GAPDH上游引物:5′-GGGTGATGCTGGTGCTGAGT ATGT-3′,下游引物:5′-AAGAATGGGAGTTGCTGTTGAAGTC-3′,扩增产物长度616 bp。
1.4.3RT-PCR:用逆转录试剂盒进行逆转录,反应体系为10 μ l。用PCR扩增系统扩增,反应体系为40 μ l,94℃预变性2 min,94℃变性30 s,55℃退火30 s,72℃延伸30 s,共30个循环,再72℃延伸7 min保护。PCR扩增产物在1.5%琼脂糖凝胶中电泳,用凝胶成像系统测定各扩增条带的吸光度(OD)值,将目的条带与内参带的比值作为其mRNA水平的指标。
1.5统计学处理所有数据均用均数±标准差(s)表示,应用SPSS11.5统计软件处理,组间比较进行t检验,P<0.05为有统计学差异。
2 结果
2.1 ELISA法对血清TNF-α含量的测定
哮喘组、NGF阻断组血清TNF-α的水平明显高于正常对照组血清TNF-α的水平(P<0.05),差异具有显著性;NGF阻断组血清TNF-α的水平低于哮喘组血清TNF-α的水平(P<0.05),差异具有显著性。结果见表1。
2.2 RT-PCR法检测肺组织TNF-αmRNA的表达
TNF-α、GAPDH cDNA的扩增产物大小分别为708 bp、616 bp,与预计值相符(图1)。电泳后,将凝胶在图像处理系统上分析,得出二者的OD值。利用GAPDH cDNA的OD值作为参照,求出各组小鼠TNF-α mRNA表达的相对值,单位:%。哮喘组较正常对照组TNF-αmRNA表达明显增强(P<0.05),NGF阻断组较哮喘组显著减弱(P<0.05)。结果见表1。
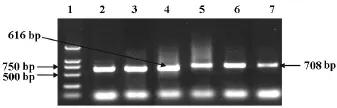
图1 TNF-α的 RT-PCR检测结果
表1 各组小鼠血清TNF-α含量和肺组织TNF-αmRNA的含量(s)

表1 各组小鼠血清TNF-α含量和肺组织TNF-αmRNA的含量(s)
注:*与正常对照组比较,P<0.05;△与哮喘组比较,P<0.05。
正常对照组 10 114.61±18.28 30.54±6.81哮喘组 10 196.83±46.05* 57.39±8.98*NGF阻断组 10 136.27±24.68*△ 37.00±7.95*△
3 讨论
早在三四十年代,人们就发现内毒素能引起小鼠移植肿瘤的出血坏死。1975年,Carswell等人发现卡介苗攻击小鼠后再用内毒素处理,小鼠血清中出现一种能诱导肿瘤组织出血坏死的物质,故命名为肿瘤坏死因子(TNF)。根据来源和结构的不同,可将TNF分为TNF-α和TNF-β两型。TNF-α的生物学活性占TNF总活性的70%~95%,TNF-α主要由单核-巨噬细胞分泌,其他类型的细胞,如成纤维细胞、淋巴细胞、平滑肌细胞等在一定条件下也具有产生和释放TNF-α的能力。TNF-α是一种具有多种生物学效应的前炎症细胞因子,与机体的炎症、免疫反应有着十分密切的关系。适量的TNF-α对机体的保护反应是必需的,但过量的TNF-α则对机体产生损伤反应[2]。TNF-α参与哮喘气道炎症反应的作用机制主要为:(1)增加血栓素的血管收缩活性,使肺血管压力升高,渗出增多,增高肺毛细血管通透性;(2)趋化活性巨噬细胞和中性粒细胞,激活过氧化物阴离子的产生,诱导氧化爆发、细胞脱颗粒等活性作用,导致气道炎症;(3)刺激多种细胞表达IL-8,使中性粒细胞大量进入呼吸道,产生高浓度细胞蛋白酶,使呼吸道腺体分泌增多致气道阻塞;(4)诱导粘附分子、刺激多形核中性粒细胞粘附内皮,使嗜中性粒细胞游出血管壁增多,发挥致炎作用;(5)通过核转移因子AP-1促进与炎症有关的细胞因子受体的基因表达[3]。Silvestri M等[4]报道哮喘发作期患者TNF-α水平明显高于缓解期及对照组,而且哮喘病情越严重,持续时间越长,其血清TNF-α浓度越高,反之病情越轻,持续时间越短浓度越低。在我们的实验中,ELISA法测定了哮喘小鼠血清TNF-α水平,结果发现哮喘小鼠肺组织血清TNF-α水平均较正常对照组明显增高,说明TNF-α参与了哮喘的发生。进一步应用RT-PCR法测定了肺组织TNF-αmRNA的表达,结果显示,哮喘小鼠肺组织TNF-αmRNA的表达较正常对照组增高,说明哮喘小鼠血清TNF-α水平升高可能系由肺组织TNF-α mRNA表达增加,TNF-α生成增多,释放入血所致。由此可知,TNF-α与哮喘有着密切的关系,参与哮喘的病理生理过程。
神经生长因子(nerve growth factor,NGF)是对神经元的生长、分化、存活期延长具有促进作用的一类神经营养因子,属于神经营养因子家族成员之一。NGF是一种多功能的细胞生长和调节因子,除对神经系统的作用外,尚对免疫[5]、生殖[6]、细胞增殖[7]、造血[8]等具有广泛的作用。NGF参与免疫炎症调控以及复杂的神经-免疫相互作用机制,可认为是神经可塑性和免疫可塑性的双重调控介质。支气管哮喘是一种由多种炎症细胞、细胞组分及神经递质参与的气道慢性非特异性炎症。众多实验已证实,NGF在哮喘发病中具有重要的病理生理意义,包括可促成哮喘气道炎症、高反应性及气道重塑[9]。
那么,NGF对TNF-α有何影响呢?有人[10]应用原位杂交方法结合显微图像分析,研究实验性哮喘豚鼠下呼吸道和内脏感觉传入部位TNF-αmRNA表达的变化以及NGF抗体对其的影响。结果发现哮喘豚鼠TNF-α mRNA的表达在气道上皮、肺内炎性细胞、C7-T5段脊神经节及脊髓后角内均明显上调;在哮喘+NGF抗体组,上述部位内TNF-αmRNA的表达明显低于哮喘组。我们的实验在测定哮喘小鼠肺组织TNF-αmRNA的表达及血清TNF-α水平的基础上,观察了拮抗NGF作用后哮喘小鼠TNF-α表达的变化。我们发现哮喘小鼠肺组织TNF-αmRNA的表达及血清TNF-α水平均较正常对照组增高,而应用了抗NGF抗体拮抗了NGF作用后TNF-α表达水平下降。由此,我们判断NGF可能通过增进肺组织TNF-αmRNA的表达作为参与哮喘的发病机制之一。
[1]Bonini S,Lambiase A,Angelucci F,et al.Circulating nerve growth factor levels are increased in humanswith allergic diseases and asthma[J].Proc Natl Acad Sci U S A,1996,93(20):10955.
[2]Shakoory B,Fitzgerald SM,Lee SA,et al.The role of humanmast cell-derived cytokines in eosinophil biology[J].J Interferon Cytokine Res,2004,24(5):271.
[3]Ulich TR,Howard SC,Remick DG,et al.Intratracheal administration of endotoxin and cytokines.VI.Antisetum to CINC inhibits acute inflammation[J].Am J Physiol,1995,268(2 Pt 1):L245.
[4]Silvestri M,Bontempelli M,Giacomelli M,et al.High serum levels of tumour necrosis factor-alpha and interleukin-8 in severe asthma:markers of systemic inflammation[J].Clin Exp Allergy,2006,36(11):1373.
[5]Wilfong ER,Dey RD.The realease of nerve growt h factor from the nasal mucosa following toluene diisocyanate[J].J Toxicol EnvironHeath,2005,68(15):1337.
[6]Li C,Watanabe G,Weng Q,et al.Expression of nerve growt h factor(NGF)and it’s receptors TrkA and p75 in the reproductive organs of the adult male rats[J].Zoolog Sci,2005,22(8):933.
[7]Park MJ,KwakHJ,Lee HC,et al.Nerve growth factor induces endothelial cell invasion and cord formation by promoting matrix metalloproteinase-2 expression through the phosphatidylinositol 3-kinase/Akt signaling pathway and AP-2 transcription factor[J].J Biol Chem,2007,282(42):30485.
[8]Triaca V,Aloe L.Neuronal markers expression of NGF-primed bone marrow cells(BMCs)transplanted in the brain of 6-hydroxydopamine and ibotenic acid lesioned littermate mice[J].Neurosci Lett,2005,384(1-2):82.
[9]Freund-Michel V,Frossard N.The nerve growth factor and its receptors in air way inflammatory diseases[J].Pharmacol Ther,2008,117(1):52.
[10]刘晓湘,曹德寿,闫军浩,等.NGF对哮喘豚鼠下呼吸道及内脏感觉传入部位TNF-mRNA表达的上调作用[J].解剖学报,2004,35(3):225.

